第一章 绪论
1.1 引言
卡特兰(Cattleya) 在国际上被誉为“洋兰之王”,其花型花色千姿百态,艳丽非凡,花期较长并具有特殊的芳香,具有很高的观赏价值,为世界人们喜爱。现在国内外对卡特兰的研究主要集中在栽培和养护上,对卡特兰分子方面的研究比较少。利用分子技术可以进行杂交后代的鉴定,探讨相近种间亲缘关系,研究花发育等。而作为分子生物学和基因工程研究的对象,提取出高质量的 DNA 是开展这些研究的前提。目前针对卡特兰的 DNA 提取研究十分缺乏,特别是卡特兰这种材料叶片较厚,汁液较多,次生代谢产物含量高,表面呈革质,很难得到得高质量的 DNA(赵九洲,2005),这一点限制了其在分子方面研究的开展。因此本文以卡特兰漂亮女孩‘考娃’品种为主要材料,探讨卡特兰 DNA 提取的方法,提取出高质量高含量的 DNA,为以后的分子研究提供基础的参考。
1.2 国内外对卡特兰的研究现状
1.2.1 卡特兰植物概述
卡特兰又名卡特利亚兰或嘉得丽亚兰,为兰科(Orchidaceae)卡特利亚兰属(Cattleya)多年生草本植物。卡特兰原产于热带美洲一带的热带雨林和较为湿润的湿地或者海岸地带,是典型的附生植物。William Cattleya 是世界上第一个发现卡特兰并且将其种植成功的园艺学家,为了纪念 William Cattleya 发现卡特兰的巨大贡献,世界着名的植物学家约翰·德莱博士将这种花的名字命名为卡特兰。卡特兰美丽大方,高贵典雅,代表了主人的身份和审美。卡特兰还是哥斯达黎加和哥伦比亚的国花,被世界人民喜爱(陈明莉 等,2007)。
卡特兰家族十分庞大,包括一百多个原种和大量的属内种间杂交品种。英国皇家园艺协会(RHS)是国际认可的兰科植物杂交属和集体杂种登录权威机构(InternationalRegistration Authority for Orchid Hybrids )。该协会负责兰科植物的登陆和发表工作,这一登录制度对全世界的兰花杂交育种有极大的意义,使全世界范围内的兰花杂交育种工作有条不紊的进行,避免混乱和重复的杂交工作。目前世界上所有的卡特兰杂交种都能清楚无误的知道其血统来历,这对卡特兰及其他兰花的育种工作有极大的参考价值(王雁 等)。
1.2.2 卡特兰观赏特性及应用
卡特兰作为兰科植物,具有明显假鳞茎,并且假鳞茎的大小和种类有关。每个假鳞茎上仅长有 1 至 2 片叶子,且生长缓慢,肥厚的叶片不仅能够储存大量的养分,还能够抵抗干旱(卢思聪,2003)。卡特兰花朵与众不同的是其三枚延伸在最外延且伸直的萼片,此外除了左右各一枚侧瓣,中间还有一枚形态各异的唇瓣,唇瓣的颜色十分丰富,具有很高的观赏价值。
卡特兰的品种不同,其花在花型大小,花色以及花期上的特征也明显不同:在花型上,有大花型,中花型,小花型,迷你花型以及更小的掌上型卡特兰之分;在开花时间上,品种不同花期差异很大,春夏秋冬各有开花的品种,是很好的年宵花;在开花时间上,一般室内栽培花朵开放时间在 2-3 周,甚至一个月以上(卢思聪,2003);在花色上,卡特兰花色丰富艳丽,有紫红色花系,橙红色及砖红色花系,浅色至粉色花系,白色系,蓝色系,黄色系,绿色系,斑点花系,以及介于两个颜色之间的复色系。
卡特兰硕大艳丽的花朵,怡人的香气,令人心情舒畅的特点,决定了它成为优秀的盆花。其日常欣赏与应用主要有以下几个方面:首先是居室布置,在窗台,阳台,小花圃的栽培开花与摆设等或将卡特兰栽培或者在花开时将其装饰在器皿上都十分生动,或者还可以将组成活泼有趣的小组盆花;在公共场所景观装饰方面,可以布置成公司,会场,办公室一角的小景观,或者办公桌上的组合盆;在庭院公园树干上的着生的栽培的卡特兰,可以增添绿化的趣味,当花开时更是给人美丽的惊喜;此外卡特兰可以做胸花,腕花,肩花,手捧花,这些都可以用于婚礼上的新娘,伴娘,花童装饰,近年来各种社交场合,开幕迎宾走秀展览等,使用的越来越多;最后卡特兰与绘画、摄影、雕塑、瓷盘、小饰品等艺术有紧密的关系,许多以卡特兰为原型的艺术品,将卡特兰花开的瞬间美丽为永恒,装点了人们的生活和心灵(王雁 等,2012)。
1.2.3 卡特兰及其他兰科植物的研究进展
在上世纪四十年代之后,许多国家开始大力建立卡特兰基地,进行卡特兰的种植和栽培,比如荷兰美国等花卉生产大国,他们专注于生产卡特兰切花和盆花,并且将其大量的投入市场,为卡特兰产业的发展做出了巨大的贡献(陈明莉 等,2002)。近些年来,中国大陆地区也看到了卡特兰的发展前景,开始努力发展卡特兰产业。
1.2.3.1 卡特兰繁殖及栽培养护方面的研究进展
我国大陆近十年来从台湾省及泰国,印尼等地引进了上百个卡特兰品种,主要用于卡特兰的栽培适应性和组培快繁等方面的研究,由于时间较短,与国外还存在一定差距(陈明莉 等,2002)。
吕复兵等人通过研究发现了卡特兰适宜的实生苗成苗培养基(吕复兵 等,2003)。吕复兵还通过实验表明 5~6 个月龄未完全成熟果实的种子最容易培养萌发成功,并且种子无菌播种初期必须进行暗培养,待种子膨大,原球茎形成后逐步进行加光培养(吕复兵等,2003)。马生健等通过试验得出了不同有机添加物对卡特兰组织培养的影响(马生健等,2010)。郭达初等以卡特兰为试材研究继代培养过程中快速繁殖,发现通过原球茎状体的增殖,是实现气生兰工厂化生产的最重要途径(郭达初,1991 年)。陈曦进行了卡特兰的水培生长基本条件研究,发现了卡特兰在营养生长阶段和生殖生长阶段所适宜的不同的处理组合(陈曦,2012)。侯卓婕以卡特兰根蔸为外植体诱导丛生芽,探索以丛生芽途径再生植株的方法进行快速繁殖,建立卡特兰最优再生体系,扩大了卡特兰外植体选择范围(侯卓婕,2008)。
卡特兰的成苗生长势很强,比较容易养护,在北方温度和水分适宜的温室内较容易栽植成功(卢思聪,2003)。钱桦进行了卡特兰常见病虫害的防治的研究(钱桦,2006年)。邵和平等对冬季及早春花品种温室栽培管理和花期调控栽培的技术要点作了概述(邵和平,2008 年)。郑宝强通过对花芽分化期间的温度进行处理与研究,发现了能够使花期提前且花朵增大的方法,此技术可以作为花期调控的重要手段 (郑宝强,2011 )。
1.2.3.2 卡特兰杂交选育方面的研究进展
在亚洲对卡特兰研究较多的是泰国和台湾等温度较高的地区,他们的水平在亚洲处于前列,主要集中在选育新品种方面上(陈明莉 等,2002)。近些年来我国也从台湾等地区引进大量卡特兰,进行卡特兰的杂交育种研究。
郑宝强发现卡特兰的花朵在不同发育时期具有不同程度的可授性,杂交工作应尽量选在适宜时间进行(郑宝强,2011)。吕复兵等通过对 ‘大眼睛’,‘白雪公主’等七个卡特兰亲本进行杂交获得杂交组合,通过观察发现卡特兰果实的色泽,形态等性状由母本决定(吕复兵 等,2003)。
1.3 DNA 的研究进展
DNA 又称脱氧核糖核酸,是染色体的主要组成部分。DNA 是所有生物遗传信息的载体和遗传物质的基础,生物体亲子间的相似性和继承性即所谓遗传信息都储存在 DNA分子中,DNA 分子在生物体中有重要的作用和功能(段永红,2010)。DNA 作为生命体特有的遗传物质载体,携带生命个体生长和发育等必需的所有遗传信息,以纯化的 DNA分子形式或者基因组文库的方式进行保存就意味着对种质资源的保存,是传统资源保存方式的重要补充。从生物体中提取 DNA 已成为分子生物学实验室中的一项常规技术。因此,DNA 提取纯化技术作为一项基础研究工作,具有理论和实践双重意义。
1.3.1 DNA 的提取的原理
DNA 提取的方法很多,细胞核中 DNA 大部分是以 DNA-蛋白复合物的形式存在于细胞核内的。提取 DNA 时,一般要先破碎细胞释放出 DNA-蛋白复合物,再用含有少量异戊醇的的氯仿除去蛋白质,最后把 DNA 从抽提液中抽提出来。DNA-蛋白复合物与RNA-蛋白复合物在不同浓度的电解质溶液中溶解度差别很大,利用这一特性可以将二者分离。例如当 NaCl 浓度大于 1mol/L 时,DNA-蛋白复合物溶解度很大,RNA-蛋白复合物很小,因此可以用高浓度 NaCl 溶液提取 DNA。为了提取得到纯净的 DNA 制品,还可以使用适量的 Rnase 处理提取液,以降解 DNA 中掺杂的 RNA。
1.3.2 DNA 提取方法
1.3.2.1 CTAB 提取方法
十六烷基三甲基溴化铵法,简称 CTAB 法。CTAB 是一种阳离子去污剂,可溶解细胞膜,并且能与核酸形成复合物,这些复合物在高盐溶液中是可溶的,在低盐溶液中会因溶解度的降低而沉淀,从而使 DNA 和多糖分开,再用乙醇沉淀 DNA 而除去 CTAB。
在实验中经常会根据实验材料对方法进行细微的改良。肖鲲等(2007)等用 CTAB法提取石斛(Dendrobium)总 DNA,试验研究表明 2 倍的 CTAB 提取缓冲液可有效结合蛋白质和多糖形成复合物,得到纯净的 DNA,并且 PVP 和 β-巯基乙醇是石斛兰 DNA 提取过程中不可缺少的。王国鼎用改良的 CTAB 法提取春兰 DNA(Cymbidium goeringii),发现对于春兰来说酚的用量过高会影响残留 DNA 的质量,建议减少酚的使用并且加入5mol/L NaCl 来去除多糖,同时这还可以减轻 DNA 的褐化(王国鼎 等,2007)。李冬梅等(2006)分别使用了几种不同的方法提取大花蕙兰(Cymbidium)的叶片基因组 DNA,发现用改良的 CTAB 法提取的 DNA 和产量都较高。
CTAB 法主要有以下优点:第一,应用广泛。近年来利用 CTAB 法已经成功提取了多种植物的 DNA,其中包括新鲜的花、茎、叶、根,多糖的蔗类以及木质化严重的木本。
Jeff 等人(1990)甚至从经过了两年干燥保存的叶片中成功提取出了 DNA。第二,该提取方法操作简便,节省时间。第三,此方法的 DNA 产率很高,DNA 产率和材料的年龄与种类有关,一般以新鲜的叶片提取 DNA 的产率较高(廖俊杰,1993)。第四,能很好地消除糖类杂质, 所以 CTAB 法是含有多糖植物的很好的选择(徐建堂 等,2007)。第五,在提取的前期能得到高含量的 DNA 与 RNA,可根据实验的需要,分别进行纯化,如只需要 DNA 则可用 RnaseA 水解掉 RNA(周东新 等,2001)。
1.3.2.2 SDS 提取方法
利用含高浓度 SDS 的抽提缓冲液在较高温度(55—65℃)条件下裂解植物细胞,使染色体离析,蛋白质发生变性,释放出核酸,然后通过提高盐浓度(KAc)和降低温度(冰上保温)的办法沉淀除去蛋白质和多糖(在低温条件下 KAc 与蛋白质及多糖结合成不溶物),离心除去沉淀后,上清液中的 DNA 用酚/氯仿抽提,反复抽提后用乙醇沉淀水相中的 DNA。
SDS 法操作简单温和,也可提取到高分子量的 DNA,但是该方法提取的 DNA 常含有较多的多糖,因此该方法适用于本身多糖含量不高的材料或多糖含量不致影响后续实验分析的样品(易庆平,2007)。
1.3.2.3 试剂盒法
目前国内外开发了多种商品化的 DNA 提取纯化试剂盒,其最基本的分离原理是利用DNA 与阴离子交换树脂在特定条件下可逆的特异性吸附来达到纯化 DNA 的目的的。首先粗提 DNA 以除去大多数不可溶杂质,然后调节 DNA 上清液的酸度条件使 DNA 可与阴离子交换树脂特异性的结合。最后处理和洗脱含有 DNA 的阴离子交换树脂柱以纯化和收集 DNA。还有少数的试剂盒利用核酸的分子量差异。这些试剂盒针对不同的材料来源设计了不同的提取方法,操作简单、高效,得到 DNA 质量较高,但是价格昂贵,提取量少。
1.3.2.4 其他方法
除了主要方法 CTAB 法及 SDS 法,此外还有氯化苄法,果胶酶法,偏重亚硫酸钠法,磁珠吸附法等方法,都各适用于不同的植物。
1.3.3 DNA 的纯化
植物细胞中贮藏有次生物质,会影响提取 DNA 的质量和产量对于 DNA 过程中常含有的杂质,去除方法有以下:
1.3.3.1 饥饿处理法
由于成熟叶片中次生代谢产物含量较高,且部分 DNA 可能已降解,所以从完全成熟叶片中提取的 DNA 质量较差(易庆平,2007)。提取 DNA 所用的叶片尽量选用幼嫩组织,如果材料有限,无法选择新鲜材料,通常将植物置于暗处 1~2d,可有效减少代谢物的产生并能够增加糖类等物质的消耗(段永红,2007)。
1.3.3.2 抗氧化剂的使用
在提取介质中加入抗氧化剂,能有效去除多酚类物质。β-巯基乙醇,抗坏血酸钠、半胱氨酸等是常用的抗氧化剂。抗氧化剂可以提供 SH-,与多酚类物质竞争氧,可以有效防止酚氧化成为醌,避免褐变。其中 β-巯基乙醇是 DNA 提取实验中最为常用的。
1.3.3.3 高浓度盐去多糖
在氯仿/异戊醇抽提后的水相中加入 0.5 体积的 5mol/L NaCl,然后加入两体积的无水乙醇使 DNA 沉淀,此时大部分多糖则仍留在上清液中。NaCl 的终浓度为 0.5-3mol/L都能去糖。对于多数叶厚汁多、含有大量多糖类和其他次生代谢产物的植物来说,采用常规的方法很难提取出高质量的 DNA,因而需要自行改良常规的分离方法。李宏(1999)在提取 DNA 的实验中发现在乙醇沉淀 DNA 时加入 NaCl 溶液,有利于 DNA 与多糖和其他次生代谢产物的分离。
1.3.3.4 分离蛋白质
酚与氯仿(1:1)或者氯仿与异戊醇(24:1)能有效去除蛋白。酚与氯仿是非极性分子,水是极性分子,当蛋白水溶液与酚或氯仿混合时,蛋白质分子之间的水分子就被酚或氯仿挤去,使蛋白失去水合状态而变性。经过离心,变性蛋白质的密度比水的密度为大,因而与水相分离,沉淀在水相下面,从而与溶解在水相中的 DNA 分开。而酚与氯仿有机溶剂比重更大,保留在最下层。,异戊醇有助于分相,使离心后的上层水相,中层变性蛋白相以及下层有机溶剂相维持稳定。杨丽(2008)等人在实验中发现用氯仿:异戊醇(24:1)代替苯酚抽提,不仅可以降低苯酚去除不干净对 DNA 质量的影响,而且能减少对人的伤害。
1.3.3.5 沉淀核酸
一般选用冰冷的 0.6 体积的异丙醇或者 2 倍体积的乙醇沉淀核酸,收集沉淀,最后用70%的乙醇洗去沉淀中的无机离子。
乙醇沉淀法是最常用的沉淀方法,原理是 DNA 在 70%乙醇中,因降低了介电常数,同时乙醇争夺与 DNA 结合的水分子,使 DNA 结合的水化膜破坏,DNA 聚集而沉降下来,所以要加 2 倍体积的无水乙醇。无水乙醇沉淀 DNA 有时还需阳离子如 Na 离子的存在,因为在 pH 为 8 左右的溶液中,DNA 分子是带负电荷的,加入一定浓度的 NaAc或 NaCl,使 Na 离子中和 DNA 分子上的负电荷,减少 DNA 分子之间的同性电荷相斥力,易于互相聚合而形成 DNA 钠盐沉淀。当加入的盐溶液浓度太低时,只有部分 DNA 形成DNA 钠盐而聚合,这样就造成 DNA 沉淀不完全,当加入的盐溶液浓度太高时,其效果也不好。
异丙醇沉淀法所用试剂较少,在 DNA 溶液中加入 2/3 倍体积的异丙醇,短时间放置后,经离心可得 DNA 沉淀。但异丙醇沸点较高,残留在 DNA 中的异丙醇不易除去。
在沉淀效果上,无水乙醇沉淀 DNA 的效果更好些,DNA 在体积较大的条件下可以沉淀的更充分,而且沉淀的盐少,易挥发除去。乙醇的优点是可以任意比和水相混溶,乙醇与核酸不会起任何化学反应,对 DNA 很安全,因此是理想的沉淀剂。缺点是总体积较大,需在-20℃放置时间较长。
1.3.3.6 去除 RNA
用 Rnase 核糖核酸酶消化沉淀去除 RNA。加进去的 Rnase 本身是一种蛋白质,为了纯化 DNA,又必须去除之,加 SDS 可使它们成为 SDS-蛋白复合物沉淀,再加 KAc 使这些复合物转变为溶解度更小的钾盐形式的 SDS-蛋白质复合物,使沉淀更加完全。也可用饱和酚、氯仿抽提再沉淀,去除 Rnase。
1.3.4 DNA 检测与分析
提取出的植物 DNA 质量的检测一般用琼脂糖凝胶电泳技术检测。DNA 的迁移率与分子量的对数值成正比关系,观察 DNA 的迁移距离,与标准的 DNA 片段进行对照,就可获知该样品分子量大小。如果带型不弥散,在与 Marker20kb 的带的相应位置出现整齐明亮的条带,说明基因组 DNA 完整,没有降解。在电泳时加入已知浓度的 DNA Marker作为 DNA 分子量及浓度的参考,观察样品 DNA 的荧光强度就可以大致表示 DNA 量的多少。
近些年发展起来的紫外分光光度计法可以有效对 DNA 进行质量检测和浓度测量。由于核酸中碱基都具有共轭双键,所以具有紫外光吸收的性质。当 DNA 中有蛋白质,酚类和杂质小分子的时候会影响 DNA 对紫外线的吸收。所以通过测定样品对紫外线的吸收就可以测定样品的纯度。核酸的吸收高峰在 260nm 处,蛋白质对紫外的吸收高峰在 280nm处,而杂质小分子的吸收峰多集中在 230nm 处。但紫外法不能区分 DNA 和 RNA,只能用来鉴定核酸的纯度和含量。纯度鉴定时,需测定在 230、260 和 280nm 处的吸光值,经验数据表明,纯净的核酸溶液 A260/A230 的吸光值比大于或等于 2.0;A260/A280 大于或等于 1.80。(1)当 A260/A280 值介于 1.6~1.9 之间,且 A260/A230 值大于 2,则为合格的 DNA 浓度。(2)当 A260/A280 大于 2.0 时,表明 DNA 双链断裂,在操作过程应尽量轻摇轻晃,减少因剧烈晃动造成的 DNA 双链断裂;(3)当 A260/A280 大于 1.9 小于 2.0 时,表明有 RNA 污染。(4)当 A260/A280 值小于 1.6 时,表明有酚类物质或蛋白质污染。(5)A260/A230 值小于 2.0 时,表明测定样品中含有盐类杂质和残存的小分子,用 75%乙醇洗涤一次即可。含量测定时,对于纯净的 DNA 来说,在实际应用中可根据 260nm 处的消光值 OD260 值换算成含量,一般认为 OD260 值为 1 时,相当于 50?g/ml。在测定核酸粗制品时,样品中残留的蛋白质和色素等与其它具紫外吸收的杂质对测定有明显干扰作用,大分子核酸制备过程中变性降解后有增色效应。
1.3.5 DNA 的保存
环境中的很多因素都会影响 DNA 的稳定性,导致 DNA 变性或降解,所以在 DNA提取成功后进行保存时应该严格注意保存的盐浓度、pH 的稳定性以及环境温度等,避免DNA 的结构被破坏(田广厚,2008)。由于水可以断裂 DNA 的氢键,故不宜将 DNA溶解于 ddH20 中长时间保存,最好是溶解于 TE(pH8.0)溶液中。用 TE 溶解 DNA 后置-20℃保存,可稳定保存 DNA 数年。
1.4 研究目标和主要研究内容
1.4.1 研究目标
作为世界着名洋兰,人们对卡特兰的研究主要集中在养护栽培和杂交育种方面上,在分子方面研究较少,对卡特兰 DNA 提取方面的研究还未见报道。而 DNA 作为主要遗传物质,在遗传变异、代谢调控等方面起着重要作用,是分子生物学和基因工程研究的对象,无论是以基因组文库的形式进行种质资源的保存,还是实施分子标记、基因图谱、遗传多态性分析、DNA 重组、RAPD(随机引物多态性 DNA)、RFLP(限制性酶多态性)、基因分离及遗传转化和鉴定等技术都是以提取 DNA 为前提的。因此,DNA 提取纯化技术作为一项基础研究工作,具有理论和实践双重意义。
1.4.2 研究内容
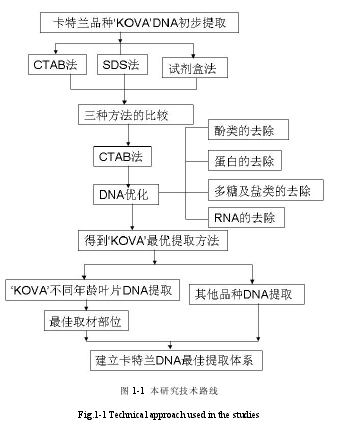
本试验针对目前对卡特兰 DNA 提取研究缺乏的现状,以卡特兰代表品种漂亮女孩‘考娃’(Rlc.Beautiful Girl ‘KOVA’)为主要材料,进行 DNA 的提取试验研究,旨在建立和完善一套高质量 DNA 提取方案,主要有以下几个部分。
(1)用 SDS 法,CTAB 法以及试剂盒法分别对卡特进行 DNA 的提取,并且对提取效果进行对比,得出较适合卡特兰的 DNA 提取方法。
(2)对上一步选出的适合卡特兰的提取方法进行改良,通过纯化得到高质量的 DNA,由此确定最终方法。
(3)用改良后的方法对漂亮女孩‘考娃’不同叶龄的叶片进行 DNA 提取,对比试验结果,研究叶龄对提取 DNA 效果的影响。
(4)用同样方法提取卡特兰其他 4 个品种‘绿晶灵’(Rlc.Village Chief North ‘GreenGenius’),‘大牛’(Rlc.Pamela Finney ‘Big Cattle’),‘seto’(Rlc.TriumPhal Coronation ‘Seto ’),‘杨铭金童’(Rth.Shinfong Little Sun ‘Yong-Min Golden Boy’)的 DNA,验证该方法能否适用于其他品种。从而得出一套成功并且经济高效的 DNA 提取卡特兰 DNA 的方法,为卡特兰种质保存和分子生物学研究提供技术参考。
1.5 研究技术路线