第二章 DNA 的提取
2.1 试验材料与研究方法
2.1.1 试验材料与试剂及器材
2.1.1.1 试验材料
试验材料取自中国林科院温室培养的卡特兰品种漂亮女孩‘考娃’。漂亮女孩‘考娃’是着名的大花品种,其生长健壮,开花容易,花初开时花瓣白色中带有绿色,后变为略带粉色,盛开后将近全白,十分有趣。此外其花瓣颜色和唇瓣颜色形成强烈对比,具有淡淡花香,不仅具有很高的观赏价值,还是很好的育种亲本。

2.1.1.2 试剂
试剂为 CTAB、SDS、试剂盒(天根),Tris-HCl、NaCl、EDTA、5 mol/LKAc、氯仿、异戊醇、70%乙醇、无水乙醇、TE 缓冲液、蒸馏水、液氮、Golden view(艾德莱生物试剂有限公司)、Loading Buffer(天根生物试剂有限公司)、Marker 1kb ladder(天根生物试剂有限公司)以下为溶液的配制方法:
(1)0.5M EDTA(PH8.0):18.61g EDTA 加入 80mol 双蒸水,加入 NaoH(促溶,约 2g)调节 pH8.0,EDTA 完全溶解后,定容至 100ml,灭菌室温保存。
(2)1M Tris-HCl(PH8.0):12.11g Tris 碱加入 80ml 双蒸水,加浓盐酸调 pH8.0,加水定容至 100ml,灭菌室温保存。
(3)5 M NaCl:29.2g NaCl 加入 50ml 双蒸水,加水定容至 100ml,灭菌室温保存。
(4)CTAB 提取液:取 2g CTAB 粉末放入瓶中,加入 10ml 浓度为 1M/L 的 Tris-HCL,加入4ml配好的0.5M/L的EDTA,再加入28ml 5M/L的NaC1,加入58ml双蒸水至100ml,灭菌室温保存。
(5)SDS 缓冲液配制:取 2g SDS,10ml 配好的 1M/L 的 Tris-HCL,4ml 配好的 0.5M/L的 EDTA,再加入 28ml 5M/L 的 NaC1,加入 58ml 双蒸水至 100ml,灭菌室温保存。
(6)醋酸钾溶液配制:49.07g KAC 加入 60ml 双蒸水,加冰乙酸调节 PH 到 5.3,加水定容至 100ml,灭菌室温保存。
(7)TE 缓冲液(pH8.0):取 1ml 浓度为 10mM/L 的 Tris-HCL,0.2ml 配好的 0.5M/L的 EDTA ,再加入 98.8ml 双蒸水至 100ml。灭菌室温保存。
(8)氯仿:异戊醇(24:1):将氯仿和异戊醇以 24 比 1 的体积比混合,装在棕色试剂瓶中待用。
2.1.1.3 试验器材
试验器材为镊子、刀片、锡箔纸、液氮罐、水浴锅、试剂瓶、移液器、手套、冰箱、高压灭菌锅、1.5ml 的离心管、2.0ml 离心管、移液枪,枪头、锥形瓶、电泳槽、计算机、凝胶成像仪、离心机、振荡器、紫外分光光度计、研钵、研棒、烘箱。
2.1.2 试验方法
2.1.2.1 取材与保存
在温室用刀片切取卡特兰叶片 3~5 g,将其包裹在锡箔纸中,用记号笔在锡箔纸上做好标记,迅速放入小液氮罐中,以防止材料氧化。将材料装在小液氮罐中带回重点实验室进行试验。
2.1.2.2 试验前准备
除了试验中所用有机溶剂不用做处理,其余的所有的接触 DNA 的容器,器材以及蒸馏水都需进行高压灭菌,以消除外源的污染。
准备开始试验之前要先将水浴锅打开并调到所需要的温度,将提取液放入水中,进行预热。实验中要用到预冷的无水乙醇,将其放入-20℃冰箱中预冷。一切准备好之后,带好线手套,开始将材料从液氮罐中取出,准备进行实验。
2.1.2.3 实验方法
(1)CTAB 法提取 DNA
①将材料用液氮研磨成粉末,取约 700?l 转入 2ml 离心管中,迅速加入 700?l CTAB溶液,进行摇匀震荡,混匀后水浴,每隔 5 min 摇匀,水浴 40min。②取出离心管,加入700?l 氯仿异戊醇,温和摇动,使其呈乳液状,12000 rpm 离心 10min。③取出离心管,用移液枪吸取上清液,转移入新的离心管中。④加入 2 倍体积-20℃预冷的无水乙醇,颠倒混匀,放入-20℃静置 40min。5000rpm/min 离心 2min 后,弃上清。⑤向离心管中加入600?l 70%乙醇洗涤沉淀两次,轻轻晃动离心管,使 70%乙醇与 DNA 充分接触,5000rpm/min 离心 2min 弃掉上清,留下沉淀,用无水乙醇洗涤沉淀,洗后 5000rpm/min离心 2min,在室温下倒置晾干至刚出现半透明状态为止。晾干后溶于 200?lTE 溶液中,保存于 4℃。
(2)SDS 法提取 DNA
①将材料用液氮研磨成粉末后转入 2ml 离心管中,迅速加入 1.2 ml 于 65℃水浴锅中预热的提取缓冲液,65℃水浴中保温 60min,每隔 5 min 晃动几次;②取出后加入0.45ml 5mol/L KAc,振荡,然后冰浴 30min;在 12000 rpm 离心 10 min;③吸取上清转入另外一个离心管中,加入等体积的氯仿:异戊醇(24:1),轻缓摇匀;④ 12000 rpm 离心 10 min,吸取上清加入 2 倍体积的无水乙醇,颠倒混匀;将离心管放置-20℃冰箱 40分钟。⑤10000 rpm,离心 5min,收集沉淀。弃上清,70%乙醇洗两次。⑥室温下凉干加TE 缓冲液使沉淀完全溶解放入-20℃冰箱中保存备用。
(3)试剂盒(天根生化科技有限公司)提取法
①将抽提缓冲液(2%CTAB)置于 65℃水浴锅中预热。②将新鲜叶片置于液氮中迅速研磨成粉末,每个样取 0.2g 左右移至 2ml 离心管中,加入 700?l 65℃预热的抽提液迅速振荡混匀。③ 65℃水浴 40min,每 5-7min 颠倒离心管充分混匀,在此过程中注意轻摇轻放。
④取出后室温冷却,加入 700?l 氯仿,颠倒充分混匀,12000rpm,离心 6min。⑤取上清液转入新的离心管中,加入等体积缓冲液(约 700?l),再次颠倒充分混匀。⑥将混匀的液体转入吸附柱中,12000rpm,离心 1min,弃除下部废液。⑦如步骤⑤中还有剩余液体可重复步骤⑥。⑧向吸附柱中加入 500?l 缓冲液,离心 1min,弃废液。⑨加入 700?l 漂洗液PW,离心 1min,弃废液,重复一次。⑩打开吸附柱的盖子,12000rpm 离心 3min,弃废液,室温中放置 20-30min,以彻底晾干残留的漂洗液,无乙醇味即可。?悬空加入50-100ulTE 缓冲液,室温放置 5min,12000rpm 离心 2min,重复一次,放入-20℃冰箱中保存备用。
(4)DNA 浓度与纯度的检测
量取 40mlTAE 溶液于三角瓶中,称取 0.4g 琼脂糖溶于 TAE 溶液中,配制浓度为 1%的胶。将三角瓶放在微波炉中加热,待琼脂糖全部溶解,取出三角瓶加入 0.2?l Golden view核酸染料,倒入电泳槽,待自然冷却将制好的胶放入电泳槽中,使缓冲液刚好超过凝胶面约 1mm;向点样孔中加入 5?l 的 Marker;将 1?l Loading Buffer 与 5?l DNA 混匀,将其点入点样孔中。同样方法进行其他点样。在 120V 电压,400mA 电流下电泳 45min。
将胶从胶板上取出,放在在紫外透射仪下进行质量检测拍照。
用紫外分光光度计测量 DNA 的含量和质量时要用溶解 DNA 的 TE 作空白对照,于紫外分光光度计上测定 260nm、280nm 和 230nm 吸收值,记录 A260/A230 和 A260/A280的比值,并记录下核酸的含量。
2.2 试验结果与分析
2.2.1 试验结果
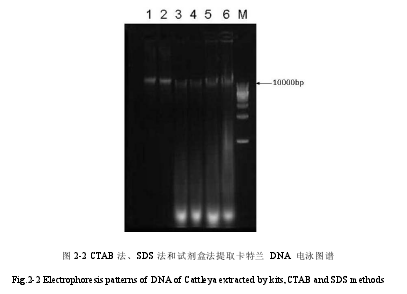
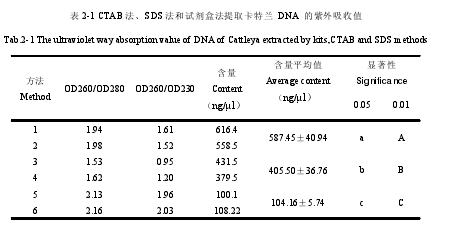
1,2 泳道为用天根试剂盒提取的卡特兰 DNA,3,4 泳道为用 CTAB 法提取的卡特兰DNA,5,6 泳道为用 SDS 法提取的卡特兰 DNA。M 为使用的 1kb ladder 的 Marker(见图2-2)。1,2 号为试剂盒方法提取的 DNA 的紫外吸收值,3,4 号为 CTAB 法提取的 DNA 的紫外吸收值,5,6 号为 SDS 法提取的 DNA 的紫外吸收值(见表 2-1)。
2.2.2 试验分析
电泳图像表明三个方法都提取出了 DNA。具体分析如下:(1)1,2 泳道是用试剂盒提取的 DNA,其条带整齐,表明 DNA 质量较好;DNA 条带上方有轻微弥散,可能含有少量的蛋白等大分子杂质,下方有轻微弥散,可能有轻微的 DNA 断裂。试剂盒提取的DNA 的紫外吸收值显示 A260/280 值均大于 2.0,A260/230 均大于 2.0,表明质量合格,但是 DNA 有断裂。(2)3,4 泳道是用 CTAB 法提取的 DNA,从电泳图上可以看出 DNA下方出现明显亮带,表明 RNA 污染严重,同时 DNA 下方有拖尾,可能是有盐类等小分子等杂质。3,4 号的紫外吸收值显示 CTAB 法提取的 DNAA260/280 值在 1.9 和 2.0 之间,表明有 RNA 污染。A260/230 小于 1.8,说明含有糖类或者盐类等小分子杂质。(3)5,6泳道是用 SDS 方法提取出来的 DNA 的电泳图,从电泳图可以看出胶孔处明显发亮,说明有蛋白质等大分子杂质,表明蛋白质污染严重。DNA 带下方 RNA 处有明显发亮的带,表明 RNA 污染严重。5,6 号的紫外吸收值 A260/280 大于 2,还表示 DNA 出现断裂,A260/230 都在 1 附近,远远小于合格值 2.0,所以说明糖类等杂质污染严重。
从表 2-1 的 DNA 含量可以看出三种方法提取 DNA 含量差异显着,含量平均值从高到低依次为 CTAB 法(587.45±40.94 ng/?l ),SDS 法(405.50±36.76 ng/?l)和试剂盒法(104.16±5.74ng/?l)。CTAB 法提取的 DNA 含量均值为 587.45±40.94 ng/?l,SDS 法提取的 DNA 含量均值为 405.50±36.76 ng/?l,试剂盒提取的 DNA 含量明显低于 CTAB法和 SDS 法,平均值为 104.16±5.74ng/?l。
通过比较发现用试剂盒提取的 DNA 虽然有 DNA 断裂现象,质量优于其他两种方法,但是 DNA 含量最低,远远小于其他两种方法的提取量。CTAB 法和 SDS 法提取的 DNA有杂质污染,从 DNA 的紫外吸收值比较二者,看出 CTAB 法提取的 DNA 质量和含量明显优于 SDS 方法提取的 DNA。
CTAB 法和试剂盒法相比较,虽然 CTAB 质量相对较差,但是 DNA 提取量为试剂盒的 5 倍以上,而且 CTAB 法价格较低,大量提取时所需费用仅为试剂盒的几百分之一。
所以选择 CTAB 法为最终方法,下一步进行其改良。
2.3 小结
在质量方面,3 种方法提取的 DNA 质量从高到低依次为试剂盒法,CTAB 法,SDS法。3 种方法提取的 DNA 含量从小到大依次为 CTAB 法,SDS 法,试剂盒法。3 种方法所需的费用从高到低排序依次为试剂盒法,SDS 法和 CTAB 法。试剂盒价格十分昂贵,实验成本是 CTAB 和 SDS 方法的百倍。比较 CTAB 和 SDS 方法,CTAB 法提取的 DNA从质量还是含量上都要优于 SDS 方法,所以从提取 DNA 的质量,含量,以及价格 3 个方面考虑,选 CTAB 法为最适合卡特兰 DNA 提取的方法,进行下一步优化。





