2.1、毕赤酵母基因工程菌株的PCR扩增检测
以电转化筛选到阳性转化子破壁后的菌液为模板,PCR扩增FGA、FGB和FGG基因,1%琼脂糖凝胶电泳检测,结果见图2,目的片段大小与理论值(1.9kb、1.5kb、1.3kb)相一致,说明重组质粒成功在毕赤酵母基因组中同源重组。

图2 阳性酵母转化子的PCR验证
2.2、重组人纤维蛋白原的表达SDS-PAGE电泳检测目的
蛋白的表达情况见图3,与含pGAPZαA空载体毕赤酵母对照相比,在相对分子质量40~70kDa之间,上清液(泳道2)及全细胞破碎液(泳道3)均有3条特异性条带,而菌体沉淀和对照没有条带,这表明目的蛋白表达部位主要在胞外上清液中,属于分泌型表达。ELISA试剂盒检测结果显示毕赤酵母上清液中目的蛋白表达量约为15mg/L。

图3 毕赤酵母表达人纤维蛋白原的SDS-PAGE检测
为进一步确定蛋白的表达情况,利用小鼠单克隆一抗(α、β、γ)和羊抗鼠IgG-HRP二抗进行Westernblot检测,结果见图4,与pGAPZαA空载体转化毕赤酵母的对照相比,样品的FGA、FGB、FGG蛋白(泳道2)均有明显的特异性条带,蛋白分子量大小与理论值α(63.5kDa)、β(56kDa)、γ(47kDa)相一致,表明杂交条带确为目的蛋白,重组人纤维蛋白原FGA、FGB、FGG蛋白在毕赤酵母中均有较强的表达。
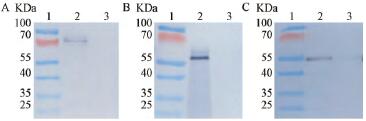
图4 人纤维蛋白原Westernblot印迹分析
2.3、重组人纤维蛋白原的生物活性检测
分离纯化后的重组人纤维蛋白原在添加外源Ca2+、凝血酶和凝血因子ⅩⅢ条件下,按照2015年版中国药典方法检测凝固活力[14],结果显示待测样品与对照相比变浑浊并有沉淀产生,这表明纯化获得的人纤维蛋白原具有生物凝集活性。
3、讨论
人纤维蛋白原在凝血系统中发挥着关键作用,在凝血酶的作用下,纤维蛋白原转变为纤维蛋白,并与其他血细胞成分聚集从而达到止血目的。纤维蛋白原缺乏常见疾病有:先天性纤维蛋白原减少或缺乏症,弥散性血管内凝血、外伤、手术等导致的获得性纤维蛋白原缺少症,这些纤维蛋白原功能异常均可引发不可控制的出血症状。目前纤维蛋白原缺乏症只能靠补充人纤维蛋白原制剂治疗,因此临床应用需求较大,同时人纤维蛋白原还是一种军事战略储备药品,每年必须有一定的储备量。
目前我国仅有9家血液制品单位生产人纤维蛋白原注射剂,2008~2010年全国总产量不足10万瓶(0.5g/瓶),临床长期供不应求,且原料来源于人体,提取资源短缺、工艺复杂,因此利用基因工程手段开发重组人纤维蛋白原具有良好的市场前景,有助于为科研和临床治疗提供新思路,为其大规模产业化生产提供重要的实验依据和技术支持。本课题将人纤维蛋白原的3个基因串联插入到真核表达载体pGAPZαA中,成功获得了重组人纤维蛋白原的毕赤酵母菌株,SDS-PAGE和Westernblot检测证实目的蛋白在发酵上清液中得到高效分泌表达,且分离纯化的蛋白具有生物凝集活性。
目前仅有2008年Tojo等报道利用酵母作为宿主细胞表达人纤维蛋白原的研究,表达量仅为8mg/L,且需甲醇诱导表达,而本研究获得的人纤维蛋白原发酵产量约为15mg/L,较其产量提高了87.5%,毕赤酵母表达为组成型表达,不需要诱导,更适合工业上大规模生产。本课题后续将进行发酵罐扩培和发酵条件优化,以提高蛋白表达量,并将从氧化还原角度和蛋白翻译后修饰角度探索二硫键形成和稳定条件,对纤维蛋白原在凝血酶作用下的凝集条件进行大量的研究和探索。





