脂肪肝在中国人群中的总患病率约为10%,不同职业的人群脂肪肝患病率不同。基本上随着年龄的增长,脂肪肝的患病率增加,有资料表明,脂肪肝患病率正在不断上升,在人群中呈年轻化趋势。饮酒是发生酒精性脂肪的主要原因,并且和饮酒量、饮酒年限有关,酒精性脂肪肝的XX标准:①饮酒史超过5年,折合酒精量>40点/天(如20克/天);②2周内暴饮史(80克/天)者,即符合长期饮酒或酗酒者,如果查出脂肪肝者才能诊断为酒精性脂肪肝。本文是特地为大家搜索分享的脂肪肝论文,供大家参考阅读。
脂肪肝论文第一篇:脂肪肝对慢性乙型肝炎患者应用阿德福韦酯抗病毒治疗效果的影响分析
摘要:目的 研究脂肪肝对慢性乙型肝炎患者应用阿德福韦酯抗病毒治疗效果的影响。方法 选取2018年2月至2019年10月于本院诊治的慢性乙型肝炎患者180例作为研究对象,根据患者是否合并脂肪肝分为两组,每组90例。对照组为单纯慢性乙型肝炎患者,观察组为慢性乙型肝炎合并脂肪肝患者,根据观察组患者的肝脂肪病变程度评估分为轻度组(n=56)和中重度组(n=34),所有患者均给予阿德福韦酯抗病毒治疗,比较各组患者HBeAg转阴率、HBV DNA转阴率、ALT/AST复常率及血清学与生化学指标等。结果 观察组HBeAg转阴率、HBsAg转阴率、HBV DNA转阴率和ALT/AST复常率均低于对照组(P<0.05);轻度组患者HBeAg转阴率、HBsAg转阴率、HBV DNA转阴率和ALT/AST复常率均高于中重度组(P<0.05);治疗前,轻度组患者ALT、AST、GGT、ALP水平均低于中重度组(P<0.001)。结论 脂肪肝对慢性乙型肝炎患者应用阿德福韦酯抗病毒治疗效果会产生一定影响,随着肝脂肪病变程度加重,阿德福韦酯的抗病毒治疗效果越差。
关键词:脂肪肝;慢性乙型肝炎;阿德福韦酯;抗病毒治疗;转阴率; ALT/AST复常率;
Abstract:Objective To study the effect of fatty liver on the antiviral treatment of adefovir ester in patients with chronic hepatitis B. Methods 180 patients with chronic hepatitis B who were diagnosed and treated in our hospital from February 2018 to October 2019 were selected as the research subjects. They were divided into two groups according to whether the patients had fatty liver or not, with 90 cases in each group. The control group was simple chronic hepatitis B patients, and the observation group was chronic hepatitis B patients with fatty liver. At the same time, the observation group was divided into mild group(n=56) and moderate to severe group(n=34), all patients were given adefovir ester antiviral treatment, and the HBeAg conversion rate, HBV DNA conversion rate, ALT/AST normalization rate, and serological and biochemical indexes of each group were compared. Results The rate of HBeAg turns shade, HBsAg turn overcast rate, HBV DNA and ALT/AST after often rate comparison in the observation group were lower than the control group(P<0.05); mild group of patients with HBeAg overcast rate, HBsAg turn overcast rate, HBV DNA and ALT/AST after often rate were higher than in moderate to severe group(P<0.05); before treatment, the ALT, AST, GGT and ALP levels of mild group were less than moderate to severe group(P<0.001). Conclusion Fatty liver in patients with chronic hepatitis B application adefovir ester antiviral treatment effect have an impact, as the fat liver lesion degree aggravating, adefovir ester of antiviral treatment effect is poorer.
慢性乙型肝炎(CHB),简称乙肝,是我国常见的一类传染病,主要临床症状为腹胀、恶心、乏力、肝区疼痛,重者会出现脾肿大、肝硬化甚至肝癌等,危及患者生命安全[1,2]。目前对于乙肝治疗中依然以抗病毒治疗为主,我国医疗卫生体系已有明确的乙肝防治指南[3]。但是对于合并脂肪肝的乙肝患者抗病毒治疗方案则还存在较多争议,两种肝损害的叠加会加重肝脏病变,需及时给予有效治疗。但脂肪肝是否会对抗病毒治疗效果产生不良影响,抗病毒治疗后的病毒学、生化学、血清学应答模式是否会发生变化等有待进一步探究。本研究选择阿德福韦酯抗病毒治疗,探究脂肪肝对CHB患者抗病毒治疗效果的影响,现报道如下。
1 资料与方法
1.1 临床资料
选取2018年2月至2019年10月于本院诊治的慢性乙型肝炎患者180例,根据患者是否合并脂肪肝分为两组,每组90例。对照组为单纯慢性乙型肝炎患者,其中男49例,女41例;年龄23~57岁,平均(40.4±7.2)岁。观察组患者均合并脂肪肝,男46例,女44例;年龄21~58岁,平均(40.6±7.4)岁。两组患者临床资料比较差异无统计学意义,具有可比性。观察组患者根据肝脂肪变的程度分成轻度组(肝脂肪变程度为Ⅰ级)和中重度组(肝脂肪变程度为Ⅱ~Ⅲ级)。轻度组56例,男28例,女28例;年龄21~56岁,平均(40.4±7.2)岁。中重度组34例,男18例,女16例;年龄22~58岁,平均(40.9±7.7)岁。两组患者临床资料比较差异无统计学意义,具有可比性。
纳入标准:(1)符合2000年制定的《病毒性肝炎防治方案标准》中关于CHB的诊断标准;(2)合并脂肪肝患者符合2010年《非酒精性脂肪性肝病诊疗指南》中的相关诊断标准;(3)年龄18~60岁,性别不限;(4)HBs Ag阳性和HBe Ag阳性均>6个月,HBV DNA≥105copy/m L;(5)近6个月未进行抗病毒治疗;(6)签署知情同意书。排除标准:(1)对阿德福韦酯过敏者;(2)确诊为肝硬化或肝癌者;(3)有失代偿性肝病的表现;(4)有其他造成活动性肝病的原因,如合并自身免疫性肝病、HCV、HDV等;(5)合并其他严重脏器功能障碍、精神疾病者;(6)抗病毒治疗依从性差者。本研究已经医学伦理委员会审批同意。
1.2方法
所有患者均口服阿德福韦酯片(四川美大康华康药业有限公司,国药准字H20100092,规格:10 mg×14 s)进行抗病毒治疗:口服,每次10 mg,于饭前或饭后口服均可,每天1次,连续服药24周。
1.3 观察指标
(1)治疗前、治疗24周后分别采集患者外周静脉血检测HBe Ag、HBs Ag、HBV DNA,计算治疗24周后患者上述指标转阴率。(2)ALT/AST复常率:治疗前、治疗24周后采集患者外周静脉血检测AST、ALT水平,计算患者治疗24周后患者ALT和AST水平同时恢复正常发生率。(3)血清学指标和生化学指标:治疗前,采集观察组中两个亚组患者外周静脉血,检测指标包括丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转移酶(GGT)。
1.4 统计学方法
采用SPSS 23.0统计学软件进行数据分析,计量资料以“±s”表示,采用t检验,计数资料以[n(%)]表示,采用X2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者转阴率和复常率比较
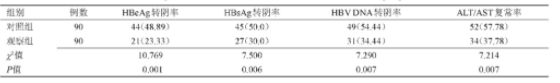
观察组HBe Ag转阴率、HBs Ag转阴率、HBV DNA转阴率和ALT/AST复常率均显着低于对照组患者(P<0.05),见表1。
表1 两组转阴率、复常率比较[n(%)]
2.2 轻度组和中重度组转阴率和复常率比较
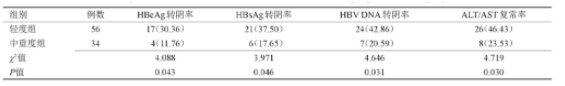
轻度组与中重度组HBe Ag转阴率、HBs Ag转阴率、HBV DNA转阴率及ALT/AST复常率比较差异均有统计学意义(P<0.05),见表2。
表2 轻度组和中重度组转阴率、复常率比较[n(%)]
2.3 轻度组和中重度组血清学、生化学指标比较
轻度组患者ALT、AST、ALP、GGT水平均显着低于中重度组(P<0.001),见表3。
表3 轻度组和中重度组血清学、生化学指标比较(U/L)
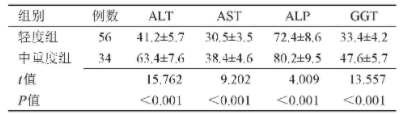
注:ALT,丙氨酸氨基转移酶;AST,门冬氨酸氨基转移酶;ALP,碱性磷酸酶;GGT,谷氨酰转移酶
3 讨论
我国是慢性乙型肝炎的高发国家,严重威胁人们健康。目前临床上治疗本病的方法主要包括单一使用抗病毒治疗和抗病毒药物与干扰素联合应用两种。阿德福韦酯是目前国内治疗乙肝的常见抗HBV药物,其不仅对HBV野生株以及对拉米夫定耐药变异株具有显着的抗病毒效果,而且该药耐受性好,不易出现耐药问题,同时阿德福韦酯的价格低廉,更适用于经济水平较差的患者[4]。
在我国,约有1/3的乙肝患者合并脂肪肝,此类患者的肝脂肪变性程度与肝纤维化呈正相关,肝脂肪变性的加重将会导致肝纤维化进程加快。越来越多学者认为肝脂肪变性会对乙肝患者的抗病毒疗效产生一定影响,这种影响可能是肝脂肪变性导致药物与细胞的有效接触面积下降,从而导致抗病毒疗效降低[5];另一方面常规的抗HBV治疗是否能缓解脂肪肝病情的研究较少。刘国旺等[6]一项慢性乙肝HBe Ag阳性初治患者抗病毒治疗中,对于HBe Ag血清学转换的影响因素研究,结果发现乙肝家族史、脂肪肝、HBe Ag、log10(HBV DNA)可以作为抗病毒治疗144周的HBe Ag血清学转换的预测因素。于忠省等[7]研究认为,肝脂肪变性程度可作为乙肝患者抗病毒治疗效果的预测因子,肝脂肪变性程度直接影响抗病毒治疗效果。本研究结果显示,观察组患者HBe Ag转阴率、HBs Ag转阴率、HBV DNA转阴率和ALT/AST复常率均低于对照组(P<0.05),提示合并脂肪肝会对阿德福韦酯抗病毒疗效产生一定影响。轻度组HBe Ag转阴率、HBs Ag转阴率、HBV DNA转阴率和ALT/AST复常率均高于中重度组(P<0.05),提示随着肝脂肪病变程度加重,阿德福韦酯抗病毒疗效也降低。
轻度组ALT、AST、GGT、ALP水平均低于中重度组(P<0.001),提示在乙肝合并脂肪肝患者中,ALT、AST、ALP、GGT与肝脂肪病变的严重程度有关,对于临床医师预测患者脂肪肝严重程度有一定的价值[8,9]。同时,对于合并脂肪肝的CHB患者,若治疗前检测到ALT、AST水平偏高,可能是由脂肪肝本身引起的,因此,在抗病毒治疗中需慎重选择治疗方案,不仅要采取必要的护肝措施,还要针对脂肪肝进行干预治疗。另外,临床研究指出慢性乙肝患者的脂蛋白、脂肪酶活力降低,从而导致脂肪分解代谢减少,是乙肝患者合并脂肪肝的主要原因之一,而肝细胞脂肪变又与年龄、总胆固醇、空腹血糖、BMI等因素有关,因此,对于合并脂肪肝的慢性乙肝患者治疗中还需加强对患者的健康教育,指导患者的日常生活,如稳定血压血糖、控制体质量、稳定血脂水平等,进一步促进肝功能的稳定,提高治疗效果[10,11]。
综上所述,脂肪肝对慢性乙型干预患者应用阿德福韦酯抗病毒治疗效果会产生一定影响,且随着脂肪肝严重程度增加,对抗病毒疗效的影响也越大,临床医师应慎重考虑合并脂肪肝的慢性乙型肝炎患者的抗病毒治疗方案。
参考文献
[1]月芹,李俊英,匡涌,等慢性乙型肝炎患者肝纤维化的代谢影响因素分析[J].中华医院感染学杂志,2016,26(17):3889-3891.
[2]王艳玲,张冰,李炳庆,等.脂肪肝对阿德福韦酯治疗慢性Z型肝炎抗病毒疗效的影响分析[J].重庆医学,2016,45(20):2772-2774.
[3]王艳玲,张冰,李炳庆,等脂肪肝对HBeAg阳性慢性乙型肝炎患者疗效的影响[J].中国当代医药,2016,23(33):23-26.
[4]肖春花,利旭辉,张春兰等阿德福韦酯治疗慢性乙型肝炎合并非酒精性脂肪性肝病的疗效观察[J] .临床肝胆病杂志.2015,31(2):266-268.
[5]杨汉青,张天挺,孙海荣等双环醇对慢性Z型肝炎合并脂肪肝长期抗病毒后生物化学应答不佳的干预效果[J].肝脏.2019,24(10):1178-1180.
[6]刘国旺,唐克诚,李谦,等.慢性乙型肝炎抗病毒治疗HBeAg血清学转换的预测模型建立[J].中华肝脏病杂志,2018,26(9):641-645.
[7]于忠省,周彬,唐德为,等.肝脂肪变对慢性乙肝抗病毒治疗效果的影响研究[J].中国实用医药,2019,14(10):48-49.
[8]朱国福钡拉唑序贯疗法治疗消化性溃疡的效果及对胃泌素的影响[J].江西医药,2015,50(12):1440-1441.
[9]彭春仙,卢滔,吴志字,等恩替卡韦或恩替卡韦联用阿德福韦酯治疗核苷(酸)类似物经治复发慢性乙型肝炎患者96周临床疗效[J].中华临床感染病杂志,2019,12(4):280-283,287.
[10]李飞鹏恩青卡韦与阿德福韦酯治疗乙型肝炎失代偿期肝硬化的疗效及对甲状腺功能的影响[J]肝脏, 2019,24(1):54-57.
[11]李新文,范玉琛,邢延清,等阿德福韦酯联合拉米夫定治疗慢性乙肝和肝硬化致肾损害的特点及处理探讨[J].中国医药导报,2019,16(20):164-167.
脂肪肝论文第二篇:不同运动对非酒精性脂肪肝康复效果的研究现状
健康是全人类的共同追求,是个人发展和社会进步的基础。党的十八届五中全会明确提出要推进健康中国建设,要坚持预防为主,减少疾病发生。随着经济的发展和人们生活方式的改变,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)已成为全球健康问题,调查发现,在发达国家其患病率已达30%,而在我国NAFLD患病人数已超过2亿人,且近些年发病率一直在迅速上升[1]。目前研究认为,NAFLD的发病过程同时受到胰岛素抵抗、脂肪组织激素分泌、营养因素、肠道微生物群以及遗传和表观遗传等多种因素的影响,这些因素可能以一种平行或协同的方式起作用[2,3,4]。虽然NAFLD发病机制已经得到一定了解,但仍然没有正式批准的有效治疗该疾病的药物。而NAFLD发生发展过程是可逆的,因此,找到能够早期预防和康复NALFD的有效策略,对于逆转NAFLD及预防其诱发2型糖尿病、心血管疾病、肝炎和肝细胞癌的发生具有重要意义[1]。运动是保持机体健康的重要方法,运动疗法作为代谢性疾病最基本的治疗方法之一已逐步应用于临床[5,6],但运动疗法对于NAFLD的临床康复效果及改善NAFLD最佳的运动方式、运动强度、运动量尚未确定。
1 资料与方法
1.1 文献检索策略
本研究通过查阅中外文献收集了不同类型运动对NAFLD作用效果的临床试验,分析不同类型运动对NAFLD患者肝脂肪变性的影响。(1)检索CNKI全文数据库:关键词为“运动,身体活动,非酒精性脂肪肝,肝脏脂肪变性,有氧,抗阻,高强度间歇训练法(high-intensity interval training,HI-IT),康复”。(2)检索PubMed文摘数据库,关键词为“exercise,sport,liver steatosis,NAFLD,aerobic exercise,resistance exercise,HIIT,rehabilitation”。(3)检索美国国家图书馆临床试验网站(ClinicalTrials.gov),查找关键词为“NAFLD,exercise”。
1.2 文献筛选标准
文献筛选标准是:(1)研究对象为NAFLD患者。(2)主要研究问题是运动干预对NAFLD患者肝脏脂肪变性的影响。(3)近十年且研究结果发表在中文核心或SCI数据库收录的杂志。本研究通过总结不同运动对NAFLD临床效果,以期为临床设计针对NAFLD更为高效合理的运动处方提供数据支持。
2 研究结果
2.1 有氧运动防治NAFLD的临床康复效果
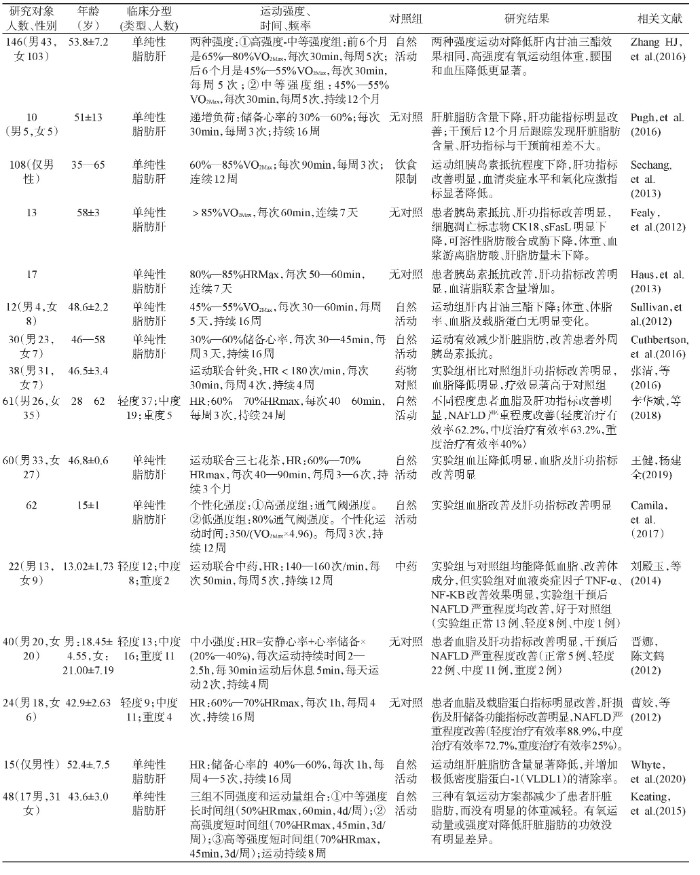
有氧运动是可以保持一段时间内使用大量肌肉群连续做功的任何活动。多项研究证实了有氧运动在NAFLD中的临床效果,见表1。大部分研究运动方案遵循每次30—60min、每周3—5次中到大强度的运动模式,运动方式包括自行车、跑步、健身气功等,对于儿童青少年患者可结合体育游戏和球类运动等。从研究结果来看,有氧运动能够显着降低肝内脂肪含量,提高胰岛素敏感性,改善肝功指标丙氨酸氨基转移酶,天冬氨酸氨基转移酶和γ-谷氨酰转肽酶等活性,降低血清炎症水平和氧化应激水平。综合当前临床研究结果发现,不同强度的有氧运动对减少肝脂肪变性没有显着差异,而强度较高的有氧运动对于减重作用效果更加明显。一些研究将有氧运动与针灸、降脂中药或某些天然产物结合使用,对减少肝脏脂肪起到了很好的临床效果,同时也能发挥药物减压降血脂的作用[7,8]。从当前研究结果看,有氧运动对于轻度、中度NAFLD患者治愈有效率较高,重度患者治愈有效率低[18,20]。Pugh等[9]的研究证实了虽然有氧运动对于NAFLD有很好的临床效果,但是停止训练一段时间后这种效果难以维持。如何帮助NAFLD患者养成自主运动的习惯对于疾病的康复至关重要。
2.2 抗阻运动防治NAFLD的临床康复效果
抗阻运动,通常称力量训练,是使肌肉抵抗外加负荷或者自身重量做功的运动方式。与有氧运动相比,抗阻运动可以有效改善肌肉力量、肌肉质量和代谢调控[23]。从目前研究结果上看,抗阻运动可减少NAFLD中的肝脏脂肪积累并增加全身脂肪动员能力,改善胰岛素敏感性。抗阻训练对NAFLD患者肝内脂质含量降低效果不如有氧运动,但是仍然可以减少肝脏脂肪,并且有效控制患者体重。抗阻运动发挥作用可能是通过增强机体游离脂肪酸和葡萄糖的摄取,研究发现在大强度抗阻运动的急性作用后,机体长达48h的能量消耗会增加。在运动后的头24h,基础代谢增加了21%,随后的24h中,基础代谢增加了19%[24]。因此,抗阻运动不仅带来了运动中直接的能量消耗,而且还使运动后脂肪氧化增加,减少了肝脏脂肪生成。
表1 有氧运动对非酒精性脂肪性肝病(NAFLD)患者临床试验研究[7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22]
针对NAFLD患者的抗阻运动可以结合患者自身情况,选择如坐姿腘绳肌卷曲,俯卧飞鸟,背部伸展,引体向上等全身各部位肌群训练,运动强度循序渐进,一般选择50%—80%1RM,每日3—5组,每周3次,抗阻运动干预至少需要8周以上,与有氧运动一样,抗阻运动效果在患者停训一段时间后同样难以维持。但对于心肺功能差、体重过高和耐力差的患者,抗阻运动作为一种相对安全的运动形式可供患者选择。
表2 抗阻运动对非酒精性脂肪性肝病(NAFLD)效果的临床试验研究[25,26,27,28]

2.3 有氧联合抗阻运动防治NAFLD的临床康复效果
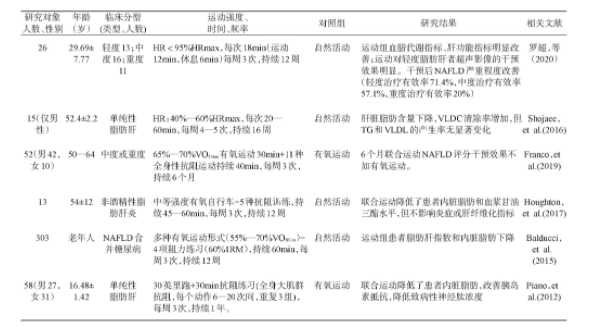
从当前临床研究来看,以有氧和抗阻为基础的混合运动干预能够降低患者肝脏脂肪和内脏脂肪,改善血脂水平以及促进脂肪因子的变化[29]。Shojaee[31]研究发现小强度、短时间的联合运动虽然对降低肝脏脂肪有效,但并没有改善肝脏胰岛素抵抗,临床上可采用中等强度,60min左右,每周3—5次,持续12周以上的联合运动干预。一般认为,有氧联合抗阻运动在临床实践中更加灵活有效,可以有效改善NAFLD患者的代谢状态。但也有研究认为联合运动对于肝脏脂肪降低效果不如单纯有氧运动干预效果好[32]。
2.4 HIIT对NAFLD的临床康复效果
HIIT是一种近年来新兴的锻炼方法,目前研究认为,HI-IT具有强度大、时间短、运动有间歇等特点,能够大大提升运动效率,较传统时间长,运动方式单一的运动训练模式对机体起到更好的锻炼效果[36,37,38]。
目前,多项研究报告了HIIT对NAFLD患者的影响。Hallsworth等[39]研究发现,为期12周的HIIT,每周3次,每次运动30—40min,可以显着降低肝内脂质水平(-27%)、脂肪量(-1.8kg)、体脂百分比(-1.2%)和肝氨基转移酶水平(-3U/L)。Sechang等[40]比较了为期12周的HIIT、中等强度的有氧运动训练和抗阻训练的效果。HIIT包括3组循环训练,最大强度80%—85%VO2Max。结果发现尽管各组肝内脂质降低水平相似,但仅HIIT组可以观察到肝硬度的改善(-16.8%)。同时伴随血液铁蛋白水平,脂肪代谢基因如乙酰辅酶A羧化酶等的表达,以及血液中的瘦素水平的改善。Winn等[41]比较了总运动量相同的HIIT和中等强度有氧运动对于NAFLD患者肝内脂质水平的改善程度,发现4周HIIT降低肝内脂质(-37.0%)高于4周中等强度有氧运动(-20.1%),但差异未达到显着性水平。Abdelbasset等[42]对比了8周的HIIT、中等强度有氧运动对NAFLD患者的作用,发现这两种运动干预方式都能降低患者肝内脂质和内脏脂质,两者作用无明显差异。冲刺跑间歇训练(sprint interval training,SIT)是HIIT的一种形式,它由若干组最大强度运动30s的高速跑组成。研究发现,为期6周的SIT训练(每周进行4—6次,连续三组30s冲刺)可显着改善胰岛素敏感性,并减少内脏脂肪组织(-16.9%)和肝内甘油三酯水平(-12.4%)[43]。从目前研究结果来看,4—12周的HIIT对NAFLD患者的临床疗效较好,并且能够提高运动效率,在当前快节奏的生活方式下更容易被患者接受,但HIIT对心肺耐力要求较高,有一定的运动风险[44]。
通过分析运动干预NAFLD的临床研究,能够发现运动对NAFLD患者肝脏脂肪降低具有很好的效果,一般可使肝脂肪变性相对减少20%—30%。数据表明,不同类型的运动(有氧运动、抗阻训练或HIIT)对肝脏脂肪作用相对接近,但也有部分研究发现有氧运动的降脂作用要优于抗阻运动[45]。运动强度差异对改善肝脏脂肪的水平影响很小,中强度运动与大强度运动同样能够有效地减少肝脏脂肪,对于大多数NAFLD患者运动强度过高,难以长期维持,更多的人可能能够坚持中等强度的运动处方。研究数据表明,如果患者持续接受运动干预12个月,在运动干预结束后的一年内,肝脏脂肪、腹部肥胖和血压的改善仍将持续。相反,时间较短的运动干预,干预后如果患者不继续定期运动,则在干预过程中获得的益处会很快丧失。这提示我们对患者运动干预周期应尽量延长,并促使患者养成定期运动的生活习惯。
表3 有氧联合抗阻运动对非酒精性脂肪性肝病(NAFLD)效果的临床试验研究[29,30,31,32,33,34,35]
2.5 运动对NAFLD临床康复的不良影响
在临床试验中并未发现运动可能引起的副作用,这可能是由于临床试验一般选用安全有效的运动方案。但运动不会适合所有脂肪肝患者,对于NAFLD伴有心血管疾病等运动禁忌证的患者运动疗法具有高风险,因此,临床上应用运动疗法时需要进行运动风险评估。而且,对于过量运动也可能会干扰NAFLD患者的肝脏代谢,Rocha[46]通过构建8周力竭运动动物模型发现长期力竭运动会造成肝脏脂肪堆积,诱导细胞肿胀并伴有急性炎症,这侧面验证了过量运动不利于脂肪肝的康复。
2.6 运动对NAFLD的临床康复的影响机制
目前运动疗法对NAFLD的临床研究结果证明,运动可能从调节脂代谢、炎症反应、氧化应激、细胞凋亡与细胞自噬等途径作用于NAFLD。
2.6.1 运动调节肝内脂肪含量:
研究证明运动可以降低肝内脂肪含量,长期运动时,骨骼肌大量分解和利用脂肪酸,降低体内游离脂肪酸,减少TG来源。运动还可提高肝线粒体β氧化相关酶的活性,加速肝内脂肪酸的分解利用[27]。运动可能通过促进脂肪因子瘦素、脂联素等分泌调节脂代谢通路,影响脂肪生成和β氧化。Haus[14]发现运动可以调节代谢治疗NAFLD,可能与运动分泌血清脂联素的增加有关。Piano等[35]发现有氧联合抗阻运动可增加青少年单纯脂肪肝患者血清瘦素、脂联素水平,同时首次发现运动能够降低NAFLD患者神经肽黑色素聚集激素水平,这可以使患者食欲下降、代谢率增高。
2.6.2 运动降低NAFLD诱导的氧化应激:
氧化应激对于NAFLD的发展有重要影响,氧化应激和线粒体功能障碍导致肝细胞损伤和星状细胞活化和纤维化。而运动能够产生抗氧化作用,可以通过提高抗氧化酶水平和调节活性氧水平来减轻NAFLD引起的氧化损伤,为细胞提供有益的影响[47]。Sechang等[11]发现有氧运动可降低NAFLD患者氧化应激标志物硫代巴比妥酸反应物,缓解氧化应激。
2.6.3 运动减少肝脏炎症:
炎症反应是NAFLD发展为非酒精性脂肪肝炎中主要标志之一,临床试验表明,运动可能通过下调促炎介质来改善NAFLD,Sechang等[11]发现有氧运动可降低NAFLD患者血清TNFα、TGF-β1、IL-6等炎症标志物水平。刘殿玉[8]研究发现有氧运动对NAFLD患者血清TNF-α、NF-κB改善效果明显,运动对NAFLD防治的生物学机制可能是通过对炎性因子的调节实现的。
2.6.4 运动改善NAFLD诱导的肝细胞凋亡:
肝细胞凋亡是促进NAFLD向NASH发展的重要环节,研究发现,肝细胞脂毒性凋亡是NASH重要特征,参与整个发病过程[48]。抑制肝细胞凋亡是治疗NAFLD重要策略,Fealy[13]发现有氧运动使NAFLD患者细胞凋亡标志物CK18、sFasL明显下降,证明运动能有效地减轻肝细胞凋亡。Sechang等[49]研究发现运动能够降低NAFLD患者凋亡标志物M30、M65,以及纤维化标志物M2BP、HA和NFS。
2.6.5 运动激活肝细胞保护性自噬:
过度的脂质积累被认为可能是NAFLD进展的起始事件,自噬功能可能通过降低TC和TG积累对NAFLD产生有益的影响。运动一方面能直接激活肝细胞自噬,减轻肝脏内脂质沉积及炎症反应;另一方面可间接通过提高骨骼肌细胞的自噬水平减轻外周胰岛素抵抗从而达到防治脂肪肝的目的[50]。Dasarathy[51]认为运动可能会改变肌肉肌动蛋白水平,运动后营养响应型肌动蛋白5的减少会阻断雷帕霉素表达,从而诱导自噬。同时,鸢尾素的增加会促进AMP依赖的蛋白激酶表达,随后诱导ULK1蛋白激酶增强自噬。运动还可能通过程序性死亡受体-1与B淋巴细胞瘤-2途径直接启动自噬,肝脏中的线粒体自噬和脂肪细胞自噬分别被激活以清除异常的线粒体和过多的脂质,使脂肪肝中多余的脂质在线粒体中得到更有效地氧化,并被溶酶体选择性清除,从而改善NAFLD。
2.6.6 运动调节肠道微生物影响NAFLD:
当前研究认为肠道微生物的变化对NAFLD有重要影响,研究发现与没有NAFLD纤维化的患者相比,出现NAFLD纤维化患者表现出血液微生物群升高,这说明微生物从肠道转运到门静脉循环可能是导致NAFLD严重程度的刺激因素[52]。微生物群产生代谢物的能力受到饮食、运动等因素影响,适宜运动可以使人类肠道菌群结构向正常化发展,运动可以使人体肠道内拟杆菌群和双歧杆菌群显着增加,其产生的短链脂肪酸有助于维持肠道免疫系统动态平衡[53]。孙红梅[54]研究发现长期坚持运动的老年人,肠道中嗜酸杆菌、双歧杆菌和乳酸杆菌丰度增加,促进老年人血脂代谢正常。Huber[55]发现运动能够调节NAFLD患者肠道菌群,表现出宏基因组丰富度增加,在分类上,拟杆菌门和广古菌门增加,而放线菌门减少,运动可能通过调节肠道菌群影响肝脏脂肪变性和纤维化。
3 结论
(1)虽然改善NAFLD的最佳运动频率、强度、持续时间和类型尚不明确,但中等强度以上,时间在40—60min,每周3—5次,持续8周以上的有氧运动、抗阻运动、混合运动对NAFLD患者肝脏脂肪变性均有明显的改善效果,且干预总时长与预后效果维持呈正相关,患者停止规律运动一段时间后康复效果逐渐消失。(2)运动通过多种机制影响NAFLD患者康复。(3)NAFLD患者脂肪肝严重程度不同,个人对运动刺激反应不同,这意味着临床康复运动处方建议是非特异性的,应针对个体患者的临床体征、并发症、当前的健康状况和运动偏好定制个性化的NAFLD运动处方。
参考文献
[1] Kumar R,Priyadarshi RN,Anand U.Non-alcoholic fatty liver disease growing burden,adverse outcomes and associations[J]J Clin Transl Hepatol,2020,8(1):76-86.
[2] Koo SH.Nonalcoholic fatty liver disease:molecular mechanisms for the hepatic steatosis[J].Clin Mol Hepatol,2013,19(3):210-215.
[3] Neuschwander-Tetri BA. Non- alcoholic fatty liver disease[J]. BMC Med,2017,15(1):45.
[4] Kim KH,Lee MS Autophagy--a key player in cellular and body metabolism[J].Nat Rev Endocrinol,2014,10(6):322-337.
[5] Tang Haiying,Tan Xiaoyan,Zhu Lei,et al.Swimming prevents nonalcoholic fatty liver disease by reducing migration inhibitory factor through Akt suppression and autophagy activation[J].American Journal of Translational Research,2019,11(7):4315-4325.
[6] Ross R,Soni S,Houle SA.Negativeenergy balance induced by exercise or diet:effects on visceral adipose tissue and liver fat[J]. Nutrients,2020,12(4):891
[7]王健杨建全运动康复锻炼联合三七花、山楂茶饮对中老年单纯性脂肪肝患者肝功能及血流变学指标的影响[J]中国老年学杂志,2019,39(16):3913-3915.
[8]刘殿玉,张鑫华,梁国强等中药结合运动疗法对儿童非酒精性脂肪肝干预作用的实验研究[J].中国运动医学杂志,2014,33(5):426-443.
[9] Pugh CJ,Sprung VS ,Jones H,et al. Exercise-induc ed improvements in liver fat and endothelial function are not sustained 12 months following cessation 0f exercise supervision in nonalcoholic fatty liver disease[J].Int J Obes (Lond),2016 ,40(12):1927-1930.
[10] Zhang HJ.He J,Pan LL.et al. Effects of moderate and vigorous exercise on nonalcoholic fatty liver disease:a randomized clinical trial[J.JAMA Intern Med,2016, 176(8):1074-1082.
[11] Oh Sechang,Tanaka K,Warabi E, et al. Exercise reduces inflammation and oxidative stress in obesity-related liver diseases[J].Med Sci Sports Exerc ,2013, 45(12):2214-2222.
[12] Whyte MB, Shojaee-Moradie F Sharaf SE ,et al.HDL-apo A-I kinetics in response to 16 weeks exercise training in men with non-alcoholic fatty liver disease[J] Am J Physiol Endocrinol Metab ,2020,10:1152.
[13] Fealy CE.Haus JM,Solomon TP,et al. Short-term exercise reduces markers of hepatocyte apoptosis in nonalcoholic fatty liver disease[J].J Appl Physiol(1985),2012.113(1):1-6.
[14] Haus JM,Solomon TP,Kelly KR,et al. Improved hepatic lipid composition following short-term exercise in nonalcoholic fatty liver disease[J]J Clin Endocrinol Metab,2013,98(7):E1181-E1188.
[15] sullivan S,Kirk EP,Mittendorfer B,et al.Randomized trial of exercise effect on intrahepatic triglyceride content and lipid kinetics in nonalcoholic fatty liver disease[J].Hepatology,2012, 55(6):1738-1745.
[16] Cuthbertson DJ,Shojaee-Moradie F, Sprung VS,et al.Dissociation between exercise-induced reduction in liver fat and changes in hepatic and peripheralglucose homoeostasis in obese patients with non-alcoholic fatty liver disease[J].Clin Sci (Lond),2016, 130(2):93-104.
[17]张清.杨永和罗和平.针灸结台运动康复训练对非酒精性脂肪肝疗效的临床研究[J]中华肿瘤防治杂志,2016,23(S2):178-179.
[18]李华斌,孙萍陈瑛,等八段锦对非酒精性脂肪肝的干预研究[J].成都体育学院学报,2018,44(5):79-83+90.
[19]晋娜,陈文鹤中小强度有氧运动对肥胖症患者脂肪肝的影响[J]..上海体育学院学报2012,36(6)-58-61+71.
[20]曹姣何应先,肖国强健步走和太极拳综合练习后非酒精性脂肪肝患者肝损伤及储备功能的变化[J].中国运动医学杂志2012,31(12): 1048-1053+ 1102.
[21] Keating SE,Hackett DA,.Parker HM,et al.Effect of aerobic exercise training dose on liver fat and visceral adiposity[J].J Hepatol,2015,63(1):174-182.
[22] de Lira CT,DoS Santos MA, Gomes PP,et al.Aerobic training performed at ventilatory threshold improves liver enzymes and lipid profile related to non-alcoholic fatty liver disease in adolescents with obesity[J].Nutr Health,2017,23(4):281-288.
[23] Rissel C,Curac N,Greenaway M,et al.Physical activity associated with public transport use--a review and mdelling of potential benefits[J].Int J EnvironRes Public Health,2012,9(7):2454-2478.
[24] Lonardo A.Bellentani S ,Argo CK,et al. Epidemiological modifiers of non-alcoholic fatty liver disease:Focus on high-risk groups[J].Dig Liver Dis,2015,47:997-1006.
[25] Hallsworth K,Fattakhova G,Hollingsworth KG,et al.Resistance exercise reduces liver fat and its mediators in non-alcoholic fatty liver disease independent of weight loss[J].Gut,2011 ,60(9):1278-1283.
[26] Bacchi E,Negri C,Targher G,et al Both resistance training and aerobic training reduce hepatic fat content in type 2 diabetic subjects with nonalcoholic fatty liver disease (the RAED2 randomized trial)J] Hepatology,2013, 58(4):1287-1295.
[27] Zelber-Sagi S ,Buch A,Yeshua H,et al. Effect of resistance training on non-alcoholic fatty-liver disease a randomizedclinical trial[J].World J Gastroentero1,2014,20(15):4382-4392.
[28] Jakovljevic DG,Hallsworth K, Zalewski P,et al.Resistance exercise improves autonomic regulation at rest and haemodynamic response to exercise in non-alcoholic fatty liver disease[J].Clin Sci (Lond),2013, 125(3)-143-149.
[29]贾国瑜韩涛高磊等有氧运动和抗阻运动改善非酒精性脂肪肝的随机对照研究[J]中华肝脏病杂志,2018,26(01):34-41.
[30]罗超李晗冉.田东华,等.体医融合模式FHIIT干预NAFLD的运动方法与效果评价[J]北京师范大学学报(自然科学版),2020,56(1):132-140.
[31] Shojaee-Moradie F,Cuthbertson DJ,Barrett M,et al. Exercise training reduces liver fat and increases rates of VLDLclearance but not VLDL production inNAFLD[J]J Clin Endocrinol Metab,2016, 101(11):4219-4228.
[32] Franco I,Bianco A,Diaz MDP,et al. Effectiveness of two physic al activity programs on non-alc oholic fatty liver disease a randomized controlled clinical trial[J].Rev Fac Cien Med Univ Nac Cordoba,2019,76(1):26-36.
[33] Houghton D,Thoma C,Hallsworth K et al.Exercise reduces liver lipids and visceral adiposity in patients with nonalcoholic steatohepatitis in a randomized controlled trial[J]. Clin Gastroenterol Hepatol,2017,15(1):96-102.
[34] Balducci S,Cardelli P,Pugliese L,et al.Volume-dependent effect of supervised exercise training on fatty liver and visceral adiposity index in subjects with type 2 diabetes the Italian diabetes exercise study (IDES)[J]. Diabetes Res Clin Pract,2015, 109(2):355-363.
[35] de Piano A,de Mello MT,Sanches Pde L,et al.Long-term effects of aerobic plus resistance training on the adipokines and neuropeptides in nonalcoholicfatty liver disease obese adolescents[J] Eur J Gastroenterol Hepatol,2012,24(11):1313-1324.
[36] Maillard F,Pereira B,Boisseau N. Effect of high-intensity interval training on total, abdominal and visceral fat mass:a meta-analysis[J]. Sports Med,2018,48(2):269-288.
[37] Ramos JS ,Dalleck LC,Tjonna AE,et al.The impact of highintensity interval training versus moderate-intensity continuous training on vascular function:asystematic review and meta-analysis[J].Sports Med,2015,45(5):679-692.
[38] Astorino TA. Edmunds RM.Clark A.et al.High-intensity interval training increases cardiac output and VO2max[J].Med Sci Sports Exerc 2017.49(2):265-273
[39] Hallsworth K.Thoma C.Hollingsworth KG,et al.Modified high-intensity interval training reduces liver fat and improves C ardiac function in non-alcoholic fatty liver disease:a randomized controlled trial[J] .Clin Scl,2015, 129:1097-1105.
[40] Oh S,So R,Shida T,et al. High-intensity aerobic exercise improves both hepatic fat content and sfffness in sedentary obese men with nonalcoholic fatty liver disease[J] SciRep,2017,7:43029.
[41] Winn NC,Liu Y,Rector RS,et al. Energy -matched moderate and high intensity exercise training improves nonalc oholic fatty liver disease risk independent of changes in body mass or abdominal adiposity-a randomized trial[J]. Metabolism,2018,78:128-140.
[42] Abdelbasset WK, Tantawy SA, Kamel DM,et al. Effects of high-intensity interval and moderate- intensity continuous aerobic exercise on diabetic obese patients with nonalc oholic fatty liver disease:a comparative randomized controlled tria[J].Medicine (Baltimore),2020,99(10):e19471.
[43] Sargeant JA,Bawden S.Aithal GP.et al. Effects of sprint interval training on ectopic lipids and tissue-specific insulin sensitity in men with non-alcoholicfatty liver disease[J] Eur J Appl Physiol,2018,118(4):817-828.
[44] Hamasaki H. Perspectives on interval exercise interventions for non-alcoholic fatty liver disease[J].Medicines(Basel),2019,6(3):83..
[45] Takahashi H.Kotani K, Tanaka K,et al.Therapeutic approaches to nonalc oholic fatty liver disease:exercise intervention and related mechanisms[J].FrontEndocrinol (Lausanne),2018,9:588.
[46] da Rocha AL,Pinto AP,Teixeira GR,et al.Exhaustive training leads to hepatic fat accumulation[J]J Cell Physiol,2017,232(8):2094-2103.
[47] Farzanegi P,Dana A, Ebrahimpoor Z.et al.Mechanisms of beneficial effects of exercise training on non-alc oholic fatty liver disease (NAFLD):roles of oxidative stress and inflammation[J].Eur J Sport Sci,2019,19(7):994-1003.
[48] Akazawa Y,Nakao K.Lipotoxicity pathways intersect in hepatocytes.endoplasmic retic ulum stress,c-Jun N-terminal kinase-1,and death receptors[J].Hepatol Res.201646(10):977-984.
[49] Oh Sechang,Shida T, Yamagishi K,et al.Moderate to vigorous physical activity volume is an important factor for managing nonalcoholic fatty liver disease:a retrospective study[J].Hepatology,2015,61(4):1205-1215.
[50] Takahashi H,Kotani K,Tanaka K,et al. Therapeutic approaches to nonalcoholic fatty liver disease:exercise intervention and related mechanisms[J].FrontEndocrinol (L ausanne),2018,9:588.
[51] Dasarathy S .A reexercise benefits in nonalcoholic fatty liver disease due to increased autophagy?[J] Exerc Sport Sci Rev,2017 ,45(3):125.
[52] Panasevich MR,Peppler WT,Oerther DB,et al. Microbiome and NAFLD:potential influence of aerobic fitness and lifestyle mdific ation[J] Physiol Genomics. ,2017,49(8):385-399.
[53]蒋兴宇赵霞邹凌云,等适度运动对人体肠道菌群结构的影响[J].第三军医大学学报2017,39(18):1824-1831.
[54]孙红梅健身气功八段锦练习对老年人肠道菌群的影响[J].中国运动医学杂志,2012,31(11):973-977.
[55] Huber YPirmann D. ,Gebhardt 1,et al.lmprovement of non-invasive markers of NAFLD from an individualised,web-based exercise program[J] Aliment Pharmacol Ther,2019,50(8):930-939.





