遗传性耳聋携带夫妇的基因序列检测与预防
时间:2018-11-02 来源:检验医学与临床 作者:曾黎,尚晶晶,刘正立, 本文字数:4456字摘 要: 目的 探讨对耳聋突变基因携带孕妇的配偶进行基因测序在降低出生缺陷二级预防中的意义。方法 从1 951例孕妇中检出78例耳聋突变基因携带者, 对其丈夫进行相应基因测序, 若Sanger测序法检测发现双方为同一耳聋突变基因携带者, 在知情同意前提下, 对胎儿进行耳聋基因产前诊断。结果 对78例耳聋基因携带孕妇的配偶进行相应基因测序, 发现耳聋基因突变12例, 其中相同突变基因的携带者4例, 其中SLC26A4基因杂合突变与GJB2基因杂合突变携带者各2例。4对夫妇在充分告知和知情同意的前提下通过羊水穿刺进行胎儿耳聋基因产前诊断。结论 在孕妇群体中使用基因芯片进行耳聋基因筛查, 可以有效检出耳聋基因携带者, 通过对其丈夫进行相应耳聋基因测序分析, 针对双方为同一致病突变基因携带者的夫妇进行相应基因的产前诊断, 可以有效降低先天性耳聋患儿出生率。
关键词: 孕妇; 耳聋基因; 携带者; 筛查; 产前诊断;

Abstract: Objective To investigate the significance of conducting the spouse gene sequencing of pregnant women carrying deafness gene mutation in the secondary prevention for reducing birth defects.Methods Among 1 951 pregnant women, 78 cases of deafness gene mutation carriers were detected and the corresponding gene sequencing was conducted in their spouses.If the Sanger sequencing method found that both sides were the carriers with same deafness gene mutation, the fetus conducted the prenatal diagnosis of deafness gene on the premise of informed consent.Results The corresponding gene sequencing was performed in the spouses of78 pregnant women carrying deafness gene, 12 cases of deafness gene mutation were found, of which 4 cases carried the same mutant gene, including 2 cases of SLC26 A4 gene heterozygous mutation and GJB2 gene heterozygous mutation.Four couples conducted the prenatal diagnosis of fetal deafness gene by amniocentesis under full informed and informed consent.Conclusion Conducting the deafness gene screening in the pregnant group by gene chip can effectively detect the deafness gene carriers.Conducting the corresponding deafness genes sequencing analysis in their husbands and the prenatal diagnosis of the corresponding genes for the couples with the same gene mutation carrier can effectively reduce the birth rate of neonates with congenital deafness.
Keyword: pregnant women; deafness gene; carrier; screening prenatal diagnosis;
听力障碍会严重影响人类的生活, 根据世界卫生组织 (WHO) 的分级标准, 当听力损失超过40dB及以上时, 定义为耳聋[1]。根据中国人群流行病学调查分析, 目前中国人群耳聋基因携带率为5%[2], 而目前60%以上的新生儿耳聋是由遗传因素所导致[3]。遗传性耳聋主要分为综合征型耳聋和非综合征型耳聋, 其中非综合征型耳聋约占70%[4]。在分子诊断技术的迅速发展以及大力倡导精准医学的背景下, 基因芯片检测目前已成为检测遗传性耳聋的主要方法。流行病学研究表明, 中国人群的主要遗传性耳聋致病基因是4个, 分别为GJB2、SLC26A4、GJB3和MT-RNR1 (线粒体12SrRNA) [2]。通过对婚育人群和孕妇群体进行4个耳聋基因的热点突变筛查, 实现一级预防和二级预防, 达到遗传性耳聋的早发现、早预防、早治疗[5], 这也是目前预防耳聋患儿出生最为经济、有效的方法。尤其是对于高危人群, 选择产前诊断技术可有效避免遗传性耳聋患儿的出生, 为家庭和社会减轻负担。
1、 资料与方法
1.1、 一般资料
受检对象来自2017年4-12月在长沙市妇幼保健院遗传科就诊孕妇 (均为耳聋基因携带者) 的配偶78例。耳聋基因携带孕妇是从1 951例孕妇中筛查得到, 均已进行9项遗传性耳聋基因检测。
1.2、 方法
1.2.1、 采样
抽取受检者外周血1~3mL, 乙二胺四乙酸抗凝。
1.2.2、 测序位点
GJB2基因全长, SLC26A4基因18个外显子区域, GJB3基因全长, MT-RNR1全长。
1.2.3、 Sanger测序
当孕妇进行耳聋热点突变基因筛查时, 若筛查结果为携带者, 对孕妇配偶相应的基因进行测序, Sanger测序试验委托北京博奥医学检验所进行, 并出具第三方检测报告。
1.2.4、 产前检测
若夫妻双方为同一耳聋突变基因携带者, 经夫妻双方知情同意签字, 在B超定位引导下行羊膜腔穿刺术, 抽取羊水8~10mL用于Sanger测序。
2、 结果
2.1 孕妇配偶耳聋基因检测情况
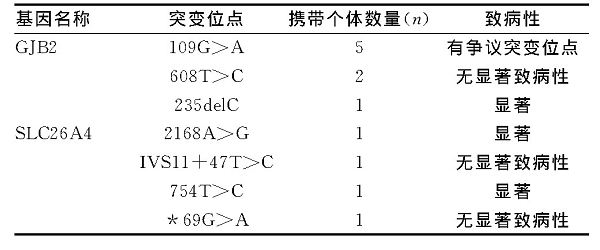
在受检的78例孕妇配偶个体中, 共检出12例耳聋基因携带者, 见表1。
表1 孕妇配偶耳聋基因检测情况
2.2、 产前诊断
对4对耳聋突变基因携带夫妇进行遗传指导, 告知先天性儿聋发生的概率和风险 (GJB2和SLC26A4基因突变致聋属于常染色体隐性遗传, 生育患儿的风险为25%) , 4对夫妻均接受了产前诊断, 见表2。
表2 4对耳聋突变基因携带夫妇产前诊断情况

注:-表示无数据
3、 讨论
目前临床上对遗传性耳聋缺乏有效的治疗手段, 部分耳聋患儿虽借助助听器或人工耳蜗改善听力状况, 但大多数因未能及时诊治而影响生活与学习, 给整个家庭带来沉重负担[6]。近20年来, 我国的出生缺陷率呈上升趋势, 目前出生缺陷总发生率约为5.6%, 有研究表明, 80%的听力障碍患者都是由听力正常的父母所生。
在倡导精准医疗的大背景下, 基因芯片技术目前已成为耳聋基因检测的主流技术, 性价比也逐渐显现, 将基因筛查纳入婚前和孕前检查, 实现出生缺陷一级和二级预防[5], 是目前临床的主流选择。本研究共对78例耳聋基因携带孕妇的配偶进行相应突变位点测序, 发现耳聋基因突变12例, 其中109G>A共5例, 608T>C共2例, 235delC共1例, 2168A>G共1例, IVS11+47T>C共1例, 754T>C共1例, *69G>A共1例。
109G>A (NM_004004:p.Val 37Ile) 位于GJB2基因EXON2, 在109位点G突变为A, 氨基酸由缬氨酸 (Val) 突变为异亮氨酸 (Ile) , 109G>A纯合突变可能与轻中度 (25~40dB) 听力损失相关[7], 但是目前还具有一定的争议性, 未纳入产前诊断。608T>C (NM_004004:p.Ile 203 Thr) 位于GJB2基因EX-ON2, 氨基酸由Ile突变为苏氨酸 (Thr) , 该位点比较保守, 但是根据已有参考文献与案例, 目前认为其属于多态[8]。IVS11+47T>C (NM_000441:c.1341+47T>C) 位于SLC26A4基因Intron11, 已有文献认为其属于多态[9], 但是在耳聋人群中发现比例较高, 致病性不明确[10]。754T>C属于显着致病性位点, 并且有试剂盒纳入筛查范围[11], 本次筛查的754T>C位点也是最先在耳聋先证者中获得。*69G>A位点属于3`UTR区, 还未有相关报道, 致病性不明确。
GJB2基因在先天性耳聋患者中最为常见, SLC26A4基因在后天突发性耳聋人群中最为常见, 与大前庭导水管综合征 (LVAS) 高度相关。MT-RNR1基因位于线粒体上, 临床上主要与药物性耳聋相关, 常呈现家族性, 一般不作为产前诊断的依据, GJB3基因致病性与临床相关性不是非常明确, 目前不作为产前诊断的依据[12,13]。
GJB2基因定位于13q11-12, 属于常染色体隐性遗传, DNA全长4 804bp, 编码区长678bp。GJB2基因编码的缝隙连接蛋白26 (Cx26) 属于缝隙连接蛋白基因家族, 调节K+的运输, Cx26蛋白在人类的耳蜗毛细胞中高表达[14]。突变会导致移码突变, 产生无功能蛋白质, 使K+回流进入内淋巴液的循环受阻, 导致Corti氏器的钾中毒, 从而引起感音神经性聋[15]。在本研究中在耳聋基因携带孕妇的配偶中发现两例致病性耳聋突变, 1例为父方299delAT杂合, 母方235delC杂合, 经家属同意, Sanger测序诊断腹中胎儿在测序位点范围内为235delC杂合;1例为父方235delC杂合, 母方235delC杂合, 经家属同意, Sanger测序诊断腹中胎儿在测序位点范围内为235delC杂合突变。在测序研究过程中有许多受检者还发现109G>A突变, 由于临床意义不明确[15], 不进行产前诊断。另外还发现79G>A, 341A>G多态, 在人群中检出率较高, 不纳入产前诊断。
SLC26A4基因定位于7q22-31.1, 属于常染色体隐性遗传, 含有21个外显子, 编码含有780个氨基酸的蛋白质Pendrin。Pendrin是一种跨膜蛋白, 属于离子转运体26A家族, 主要在甲状腺、肾脏和内耳中高表达。研究表明Pendrin主要与Cl-、I-、HCO3-和蔗糖转运有关[16]。此次发现有1例孕妇生育第一胎为听力障碍患者, 经过Sanger测序确诊是SLC26A4基因387delC/754T>C复合杂合突变 (父方754T>C杂合突变, 母方387delC杂合突变) 导致听力障碍, 经过家属同意, 进行羊水穿刺诊断, 经过测序诊断腹中胎儿为387delC单杂合突变, 预测胎儿听力正常。另外一对夫妇是父方为2168A>G杂合, 母方为IVS7-2A>G杂合, 经过测序诊断腹中胎儿在测序位点范围内为野生型, 预测听力正常。
对于耳聋发生的高危人群, 应明确耳聋病因, 实现出生缺陷的一级预防[13], 从而减少耳聋出生缺陷, 提高人口素质, 这对我国妇幼保健工作具有重要的临床意义和研究价值。
参考文献:
[1]翟秀云, 刘博, 张玉和, 等.老年听力障碍筛查量表在老年性聋调查中的应用与相关性分析[J].中国耳鼻咽喉头颈外科杂志, 2016, 23 (1) :27-30.
[2]赵燕潮.中国残联发布我国最新残疾人口数据[J].残疾人研究, 2012, 2 (1) :11.
[3]王国建, 袁永一, 李荣, 等.不同听力学表型人群中常见耳聋基因突变检出率的分析[J].临床耳鼻咽喉头颈外科杂志, 2011, 25 (10) :445-448.
[4]周学军, 欧阳小梅, 刘学忠.常见遗传性聋致病基因研究进展及基因诊断的临床应用[J].听力学及言语疾病杂志, 2011, 19 (1) :73-77.
[5]吴皓, 黄治物, 杨涛, 等.先天性耳聋三级防控体系建设[J].听力学及言语疾病杂志, 2017, 25 (1) :1-4.
[6]曾玉坤, 刘玲, 丁红珂, 等.针对孕期耳聋基因突变携带者配偶行相应基因测序在降低出生缺陷中的意义研究[J/CD].中国产前诊断杂志 (电子版) , 2017, 9 (2) :22-25.
[7]崔庆佳, 黄丽辉, 阮宇, 等.915例新生儿GJB2基因筛查单杂合突变测序结果分析[J].临床耳鼻咽喉头颈外科杂志, 2015, 29 (13) :1164-1167.
[8]郭伟.山西地区耳聋流行病学调查及分子病因学分析[D].太原:山西医科大学, 2015.
[9]赵娟, 邬玲仟, 冯永, 等.变性高效液相色谱法分析非综合征型耳聋人群SLC26A4基因突变[J].中华医学遗传学杂志, 2009, 26 (1) :21-25.
[10]刘闽, 刘水霞, 胥亮, 等.广西壮族135例非综合征性聋常见致病基因的研究[J].中华耳科学杂志, 2016, 14 (5) :654-659.
[11]王旭东, 洪拥军, 陈艺文, 等.厦门地区遗传性耳聋流行病学调查[J].中华耳科学杂志, 2016, 14 (6) :753-758.
[12]查树伟, 查佶, 许豪勤, 等.孕前耳聋基因筛查和耳聋预防[J].中国计划生育学杂志, 2016, 24 (4) :274-278.
[13]谢康, 刘艳秋, 阳彦, 等.江西省1 409例孕期女性耳聋基因筛查结果及耳聋出生缺陷的防控[J].中国妇幼保健, 2017, 32 (18) :4464-4467.
[14]王辉兵, 于飞, 戴朴, 等.GJB2结构功能及致病机制研究[J].中华耳科学杂志, 2013, 11 (1) :131-137.
[15]CHAI Y, CHEN D, SUN L, et al., The homozygous p.V37Ivariant of GJB2is associated with diverse hearing phenotypes[J].Clin Genet, 2015, 87 (4) :350-355.
[16]梅凌云.大前庭水管综合征相关基因突变检测及功能研究[D].长沙:中南大学, 2008.
- 相关内容推荐
- 新生儿耳聋基因的检测研究2015-11-24





