
细胞融合,又称细胞杂交,是指在离体条件下人为地将不同种生物或者同种生物不同类型的单细胞通过无性方式融合成一个杂合细胞的技术.PEG法诱导细胞融合,细胞容易制备、活性稳定、不需要特制的仪器设备、操作方便、融合率较高,因而被广泛用于细胞遗传、细胞免疫、基因定位、病毒、肿瘤等基础研究,也用于单克隆抗体制备和生物新品种培育,同时也被作为大学细胞工程实验教学内容.在实际操作中,该方法易受许多因素的影响,如PEG浓度、PEG作用时间、鸡血细胞悬液浓度、鸡血细胞悬液放置时间、钙离子浓度等,致使有时融合率不高或不稳定.
本研究以家鸡血红细胞为材料,探索影响细胞体外融合的各种因素,为动物细胞融合研究和细胞生物学相关实验提供参考.
1 材料与方法
1.1 实验材料及仪器
公鸡 全 血,PEG,NaCl,Hanks液,0.5%酚红,GKN液.血细胞计数板,刻度离心管,离心机,水浴锅,盖玻片,容量瓶,载玻片,移液管等.
1.2 实验方法
1.2.1 0.85% NaCl溶液的配制称取NaCl 0.85g,溶于100mL的蒸馏水中.
1.2.2 GKN液的配制称取NaCl 8.0g、葡萄糖2.0g、Na2HPO4·2H2O 1.77g、KCl 0.4g、NaH2PO4·H2O 0.69g、酚红0.01g,溶于1 000mL的重蒸水中.
1.2.3 Hanks液的配制原液A:称取NaCl 16.0g、KCl 8.0g、MgSO4·7H2O 2.0g、MgCl2·6H2O 2.0g、CaCl2(无水)2.8g,溶于双蒸水至1 000mL,滤纸过滤,储存于4.0℃;原液B:葡萄糖20.0g、Na2HPO4·12H2O0.06g、KH2PO41.2g、双蒸水800mL,用滤纸过滤,加入0.5%酚红80mL,加水至1 000mL,储存于4.0℃.
Hanks液:A、B液各1份,双蒸水18份,用5.6% NaHCO3调节pH至7.4.
1.2.4 不同浓度的PEG溶液(m/V)的配制(1)分别称取PEG 6g置于4个小烧杯中,然后放入恒温水浴锅中水浴加热,使其融化.
(2)让PEG缓慢冷却到50~60℃,注意不要使PEG凝固.
(3)向4个小烧杯中分别加入预热至50℃的GKN液 混 匀,配 制 成10%,30%,50%,70%的PEG溶液.
1.2.5 鸡血细胞悬液的配制
(1)用注射器在鸡翼下静脉采血,注入试管后,迅速加入肝素(20U肝素/mL全血),混合均匀,制成抗凝全血.
(2)向 抗凝全血 的试管中加入4倍体积的0.85%的生理盐水溶液.混合均匀,制成红细胞贮备液,4℃冰箱保存.
(3)取1mL的鸡血细胞贮备液于刻度离心管中,加入4mL 0.85%的生理盐水,混合均匀,放入低速离心机中,1 000r/min条件下离心5min,弃上清.按上述条件再离心一次.
(4)将沉淀物配制成悬浮液.并采用血球板计数法将悬浮液分别稀释成细胞密度为1×106,1×107,1×108个/mL的悬液.
1.2.6 细胞融合实验方法
(1)不同条件下细胞融合方法①不同鸡血细胞悬液浓度下细胞融合方法分别取1mL细胞密度为1×106,1×107,1×108个/mL的鸡血细胞悬浮液(其中含有的CaCl2浓度为12.6mmol/L)到3支刻度离心管,分别加入4mL Hanks液后混匀,1 000r/min条件下离心5min,弃上清,通过用手指多次轻弹离心管底部使沉淀的血细胞团块变得松散.向3支刻度离心管中分别加入0.5mL浓度为50%的PEG溶液(预热至37℃),要沿管壁缓慢加入,边加边摇匀,加入后在37℃水浴锅中静置10min.②不同PEG浓度下细胞融合方法按照①的操作方法进行,其中1mL鸡血细胞悬浮液的细胞密度固定为1×107个/mL,加入浓度分别为10%,30%,50%,70%的PEG溶液.③不同PEG作用时间下细胞融合方法按照②的操作方法进行,其中PEG溶液的浓度固定为50%,加入PEG溶液后静置时间分别为2,5,10,20min.④不同鸡血细胞悬液放置时间下细胞融合方法按照③的操作方法进行,其中加入PEG溶液后静置10min,1mL鸡血细胞悬浮液分别放置5,10,15min后再加入到离心管中.⑤不同钙离子浓度下细胞融合方法按照①的操作方法进行,其中1mL细胞密度为1×107个/mL的鸡血细胞悬浮液中含有的钙离子浓度分别为0,12.6,50.0,75.0,100mmol/L.
(2)终止PEG作用及染色观察①向各离心管中缓慢加入5mL Hanks液,然后轻轻吹打混匀,在37℃水浴锅中静置5min,终止PEG作用.②为使细胞团分散,多次用吸管轻轻吹打细胞团,1 000r/min条件下离心5min,使细胞完全沉降,弃上清.然后按上述条件,再次离心,弃上清,加入少许Hanks液,混匀.③在上述各离心管中加入Janus green B染液,用牙签搅匀,染色3min.分别用不同的吸管吸取各刻度离心管中溶液制成装片,在显微镜下观察细胞融合情况.
1.2.7 细胞融合率计算细胞融合率是指在显微镜的视野内,已发生融合的细胞其细胞核总数与该视野内所有细胞的细胞核总数的百分比.融合率(%)=(融合细胞核数/总细胞核数)×100%.每一处理制成3个装片,每个装片统计5个视野,细胞融合率取其平均值.
2 结果与分析
2.1 细胞融合过程的观察
显微镜下观察到的细胞融合过程见图1和图2(箭头所指),两个细胞逐渐靠近,细胞膜首先发生融合,然后再到细胞质,出现融合桥,最后细胞内物质通过这种通道得到转移.
2.2 不同鸡血细胞悬液浓度对细胞融合率的影响
细胞密度是影响细胞融合的重要因素之一.
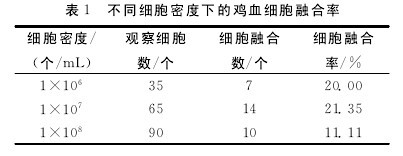
不同鸡血细胞悬液浓度对鸡血细胞融合率的影响结果见表1.表1数据显示:鸡血细胞密度为1×107个/mL时 融 合 效 果 最 好,细 胞 融 合 率 达 到21.35%,这与李秀兰等研究结果一致.【表1】
2.3 不同PEG浓度对鸡血细胞融合率的影响
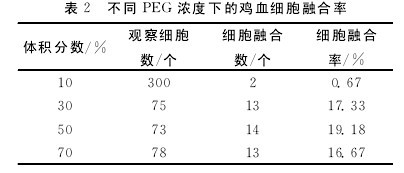
PEG的体积分数大小是PEG融合技术的关键.由表2可知:同一细胞密度下,PEG体积分数≤50%时,细胞融合率与PEG的体积分数成正比;PEG体积分数为70%时,细胞融合率反而降低.由于PEG具有一定的毒性,体积分数越大对细胞的毒性越大,并且对融合率和融合后细胞的存活率影响也非常明显,故PEG的体积分数一般为50%时细胞融合效果及融合后细胞的存活情况较好.【表2】
2.4 不同PEG作用时间对鸡血细胞融合率的影响
不同PEG作用时间对鸡血细胞融合率的影响结果见表3.【表3】
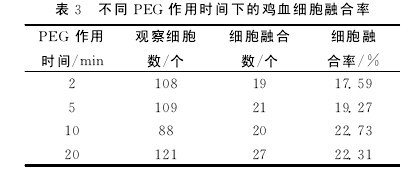
由表3可知:PEG作用时间≤10min时,细胞融合率随着作用时间的延长呈增加趋势;作用 时 间 为10 min时 细 胞 融 合 率 最 大,达22.73%;作 用 时 间 为20 min时 细 胞 融 合 率 为22.31%.
虽然下降不明显,但部分细胞已经破碎.因此,10min为最佳融合时间,这与仇燕等研究结果相一致.
2.5 不同鸡血细胞悬液放置时间对细胞融合率的影响
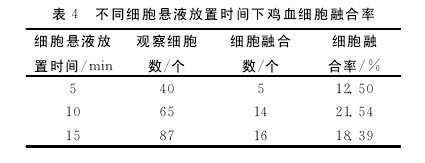
不同鸡血细胞悬液放置时间对鸡血细胞融合率的影响结果见表4.表4数据显示,细胞悬液放置时间为10min时细胞融合率最大,达21.54%.因此,细胞悬液最佳放置时间为10min.【表4】
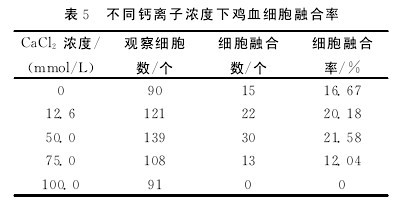
2.6 不同钙离子浓度对鸡血细胞融合率的影响
表5统计结果说明:CaCl2浓度≤50.0mmol/L时,细胞融合率随着钙离子浓度的增大而增加.当CaCl2浓度>50.0mmol/L时,细胞融合率随着钙离 子 浓 度 的 增 大 而 减 少.钙 离 子 浓 度 为50mmol/L时细胞融合率达到最大,为21.58%.钙离子浓度为100mmol/L时,细胞大部分破裂,细胞融合率为0.这与赵咏梅等研究结果基本一致.【表5】
3 讨论
PEG是普遍应用的融合剂,它与水分子的氢键结合,导致细胞质膜结构发生变化,使细胞接触的部位膜脂双层中磷脂分子发生疏散,细胞膜结构发生重排,然后使细胞胞质沟通,相互接触的细胞发生融合.影响PEG诱导细胞融合的因素很多,如细胞密度、PEG浓度、PEG作用时间、钙离子浓度等,将影响细胞融合的因素进行合理的组合就能获得较高的细胞融合率.研究表明,鸡血细胞融合的最 适温度 为37 ℃.在此条件下,本实 验 证 明PEG的最适体积分数为50%,在最适PEG体积分数下,细胞融合的最适时间即PEG作用时间为10min,若超过10min,PEG作用时间越长,对细胞毒害越大,最终会致使细胞破裂.细胞密度为1×107个/mL时融合效果最好,细胞悬液放置10min时细胞融合率最大.钙离子浓度对细胞融合也有明显的影 响,本 实 验 结 果 表 明:当CaCl2浓 度 为50mmol/L时,细胞体外融合效果最好,融合率高达21.58%.
当然,细胞的种类不同,也会导致融合时的最适条件也有差别,有待进一步研究.细胞融合技术为单克隆抗体和抗肿瘤疫苗的制备以及动物、植物远缘杂交育种开拓了新途径.伴随着细胞融合技术的改进,其在各个领域被充分应用,在实际应用中又不断伴随着新的问题出现,在解决实际问题中又促使细胞融合技术跃上一个又一个新的台阶.PEG法以其低廉的成本实现相对较高的融合率,在许多实验中应用更加广泛.因此,对于PEG化学融合方法的改进有着十分重要的意义.此外,PEG化学融合方法与其他学科的技术交叉,例如物理、计算机科学等,也将会是细胞融合技术发展的新方向.
参考文献:
[1]刘哲,张峰,佟丹丹,等.鸡红细胞体外融合最适条件的研究[J].辽东学院学报,2009,16(4):335-337.
[2]赵彦禹,张艳华,冯照军.鸡红细胞融合最适条件的探讨[J].生物磁学,2006,6(1):43-44.
[3]王金发,何炎明.细胞生物学实验教程[M].北京:科学出版社,2004:150-152.
[4]徐承水,党本元.现代细胞生物学技术[M].青岛:青岛海洋大学出版社,1995:73-78.
[5]赵志强,郑小林,张思杰,等.细胞融合技术[J].生物学通报,2005,40(10):40-41.
[6]杨汉民.细胞生物学实验[M].2版.北京:高等教育出版社,1997:109-111.





