
0 、引言
【研究意义】促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)是 Tsutsui 等于 2000 年在鹌鹑下丘脑内分离到的一种神经肽,哺乳动物的类似物为 RF 酰胺相关肽(RFRP)。具有抑制促性腺激素分泌和影响性行为、摄食、生长激素分泌等作用。猪作为中国重要的家畜之一,繁殖能力是决定其养殖经济效益的主要因子。因此,研究 GnIH/ RFRP对母猪生殖调控的机理具有重要的理论意义和经济价值。【前人研究进展】国内外已对鸟类、鱼类、两栖类及人、鼠、猴、牛、羊等的 GnIH 及其受体的基因克隆、分布定位和生理功能做了大量研究。已有研究显示,GnIH/RFRP 通过其受体发挥作用,其特异性受体为 GPR147,为具有 7 次跨膜结构域的 G 蛋白耦联受体(GPCR)。关于 GnIH 分布的研究,主要集中在脑部,GnIH 在外周分布的研究相对较少。有报道显示GnIH mRNA 除在中枢神经系统有表达外,在眼、卵巢、睾丸、脾、肾等外周组织中也有表达。除了下丘脑和垂体,GnIH 及其受体已被证实在许多鸟类的性腺中分布,并通过旁分泌或自分泌的形式参与生殖调控[10]。
此外,GnRH 和 GnIH 的信号通路存在相互作用[11-12]。
【本研究切入点】目前,有关 GnIH 对哺乳动物生殖功能调控的研究较少,且尚未见对猪的研究报道。【拟解决的关键问题】本文对GnIH mRNA 在母猪体内的表达模式,不同剂量 GnIH 对卵巢颗粒细胞类固醇激素分泌和增殖相关蛋白表达的影响,以及GPR147 与GnRH 的形态学关系进行了研究,从分子和蛋白水平入手,旨在探讨 GnIH 参与母猪生殖调控的可能机制,为全面而深入地研究GnIH 生理功能提供理论基础。
1、 材料与方法
试验于 2010 年 10 月至 2012 年 11 月,在南京农业大学农业部动物生理生化重点实验室及南京农业大学动物科技学院实验中心完成。
1.1 试验动物及材料
30 日龄健康苏钟仔母猪 7 头,体重为(10±2)kg,购自江苏省农科院苏钟种猪场。试验动物经颈总动脉放血处死,4 头动物立刻取其延髓、脑桥、中脑、大脑、小脑、下丘脑、海马、嗅球、脊髓、垂体、心、脾、肾、肾上腺、胃、眼球、卵巢、子宫、肝、肠(十二指肠、空肠、回肠、盲肠和结肠)、腰大肌、胆囊和膀胱,迅速投入液氮冷冻,然后转入-70℃冻存,用于GnIH 表达研究。3 头动物取其下丘脑,按照文献[13]的方法固定下丘脑和制作脑片,用于GnRH和GPR147定位研究。
卵巢样品采自 36 头三元杂交长白青年母猪,体重(90±5)kg,均来自江苏省天环食品有限公司。宰杀后,打开腹腔取出两侧卵巢。按照文献[14]的方法分离培养卵巢颗粒细胞。6 孔细胞板中加入 1×106个/mL 的卵巢颗粒细胞悬液,37℃静置培养 72 h 后,弃去培养液,加入 10-6、10-8、10-10和 10-12mol·L-1GnIH 静置培养 24 h 后,收集上清,-20℃保存,用于放射免疫法检测 E2和 P4的浓度;处理后的卵巢颗粒细胞用蛋白裂解液裂解后,收集于 EP 管,-20℃保存用于 Westernblotting。
1.2 主要试剂与仪器
Trizol、反转录酶(M-MLV)、RNA 酶抑制剂(RNase inhibitor)、dNTPs、寡聚脱氧胸腺嘧啶核苷酸(Oligo d(t)18)、rTaq DNA 聚合酶、SYBR PremixEx Taq Kit 购自 Takara 公司;DMEM/F12、D-Hanks、胎牛血清、胰蛋白酶、青链霉素购自南京维森特生物有限公司;40%Acr-Bis(39﹕1)、TEMED、丽春红染色液、western 细胞裂解液、超敏 ECL 化学发光试剂盒、BCA 蛋白浓度测定试剂盒、鼠抗羊 IgG、PVDF膜、厚滤纸购自碧云天生物技术研究所。
兔抗人 NPFF-1R(GPR147)(185-203)(H)多克隆抗体,货号:H-001-58,Phoenix Pharmaceuticals,USA;羊抗 GnRH,cyclin B1,PCNA 和 β-actin,购自 SANTA CRUZ,USA;驴抗山羊罗丹明(TRITC)标记的荧光二抗和驴抗兔异硫氢酸荧光黄标记的荧光二抗(FITC)(Jackson Immunoresearch Laboratories,Inc.,West Grove,PA),正常驴血清(Jackson,WestGrove,PA,USA),购自上海基因公司;人 RFRP-3(GnIH)(货号:No. 048-46,Phoenix Pharmaceuticals,USA);P4和 E2放射免疫试剂盒购自北京北方生物技术研究所。
ABI PRISM 7300 实时荧光定量 PCR 仪为美国 ABI公司产品;制胶器、垂直电泳槽、半干转印仪为美国Bio-red 公司产品;激光共聚焦显微镜为德国 zeiss 产品。
1.3 试验方法及步骤
1.3.1 半定量 RT-PCR 母猪 24 个组织的总 RNA 提取按照 Trizol 试剂说明书在无 RNA 酶的环境下进行。
提取的 RNA 进行均一性和完整性检测。RNA 在无RNA 酶的环境下按两步法进行逆转录。以 GAPDH 为cDNA 合成及 PCR 内源性参照,用混合样品(取各待测样品 cDNA 等量混合)作为模版,分别对 PCR 反应条件和循环圈数进行优化,建立最佳 PCR 反应条件和校正不同批次间RT和PCR效率的差异。取20 ?L PCR产物在 2.0%的琼脂糖凝胶上电泳,溴化乙锭染色,紫外光下显示 DNA 条带并照相。用 Kodak ID 凝胶图像分析系统分析条带灰度,根据目的基因 GnIH 和内参GAPDH 的 PCR 产物的灰度比,确定各样品组织中的GnIH mRNA 表达的相对含量。

1.3.2 放射免疫测定 所有卵巢颗粒细胞培养液中E2和 P4的含量均用同一批 I125标记的 E2和 P4放射免疫试剂盒检测。E2的测定范围:8—5 000 pg·mL-1;灵敏度:2 pg·mL-1;批内变异系数(CVw)<10%;批间变异系数(CVb)<15%。P4的测定范围:0.2—100ng·mL-1;灵敏度:0.1 ng·mL-1;批内变异系数(CVw)<6.7%;批间变异系数(CVb)<9.4%。
1.3.3 Western blotting 测定 Western blotting 按标准实验步骤进行,SDS-PAGE 电泳,转膜,丽春红染色,封闭,孵育一抗,孵育二抗,加入 ECL 化学发光液,按时曝光,扫描胶片进行灰度分析。其中,一抗羊抗 PCNA 稀释比 1﹕200,Cyclin B1 稀释比 1﹕200,β-actin 稀释比 1﹕1 000,二抗羊抗兔 IgG 稀释比 1﹕1 000。
1.3.4 荧光双标记 切片经 37℃恒温箱干燥 3 h,洗涤,灭活内源性过氧化物酶,用正常驴血清的缓冲液封闭非特异性抗原。滴加抗 GPR147 特异性抗体(1﹕400 稀释)孵育。洗涤后用驴抗兔 FITC 荧光标记的二抗孵育。充分洗涤,抗 GnRH 特异性抗体(1﹕200稀释)孵育,PBS 洗 3 次/5 min,再用驴抗兔 TRITC 标记的荧光二抗孵育,充分洗涤后甘油封片,激光共聚焦显微镜观察并照相。
1.4 统计学处理
结果均以平均数±标准误(Mean ± SE)表示。数据处理应用 SPSS 11.0 统计软件统计,同一处理不同浓度之间的比较采用单因子方差分析(one-wayANOVA),LSD 检验各组之间的差异显著性。检验结果以 P<0.05 为差异显著,P<0.01 为差异极显著。
2、 结果
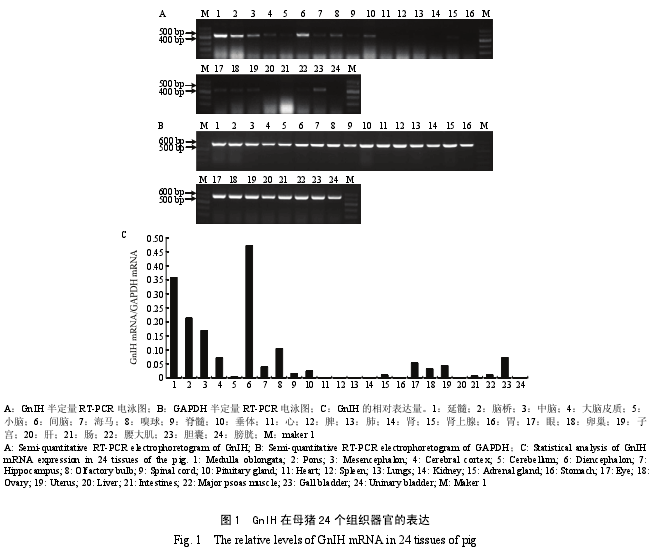
2.1 GnIH mRNA 在母猪 24 个组织中的表达
根据目的基因 GnIH 和内参 GAPDH 的 PCR 产物条带(图 1-A 和 B)灰度比,分析得出 GnIH mRNA在母猪各器官组织中的表达情况为:高丰度表达组织(GnIH 与 GAPDH 灰度比大于 0.1):间脑、延髓、脑桥、中脑和嗅球。中丰度表达组织(GnIH 与 GAPDH灰度比小于 0.1 大于 0.025):大脑皮质、海马、眼、子宫、卵巢和胆囊。低丰度表达组织(GnIH与GAPDH灰度比小于 0.025 大于 0):小脑、垂体、脊髓、肾上腺、腰大肌和肠。无表达组织:心、肾、脾、肺、胃、肝和膀胱(图 1-C)。
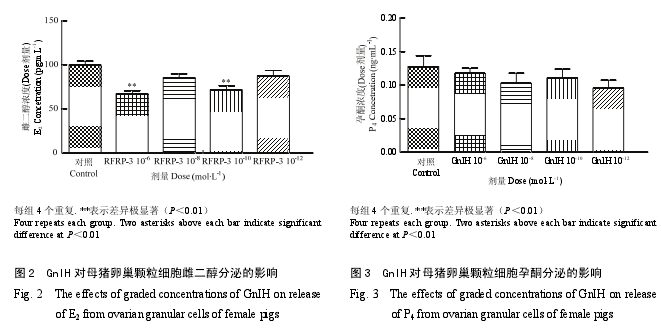
2.2 GnIH 对猪卵巢细胞类固醇激素释放的影响
GnIH 影响体外培养猪卵巢颗粒细胞类固醇激素的释放。如图 2 所示,10-6和 10-10mol·L-1GnIH 能极显著地抑制雌二醇的分泌(P<0.01),其他剂量组差异不显著。如图 3 所示,不同剂量(10-6,10-8,10-10和 10-12mol·L-1)GnIH 对孕酮的分泌与对照组相比无显著性差异。
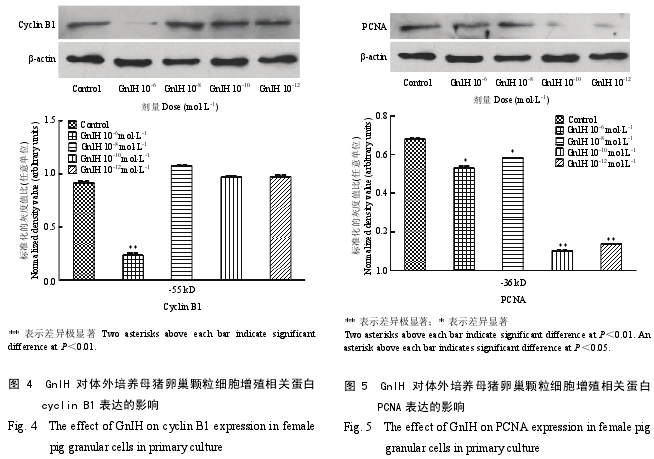
2.3 GnIH 对猪卵巢细胞增殖相关蛋白表达的影响
cyclin B1 的免疫印迹显示单一条带,为 55 kD。
研究了不同剂量 GnIH 对母猪卵巢颗粒细胞中 cyclinB1 表达的影响,结果显示,与对照组相比对,所有剂量组中只有 10-6mol·L-1GnIH 对 cyclin B1 的表达具有极显著的抑制作用(图 4)(P<0.01),其他剂量组(10-8、10-10和 10-12mol·L-1)GnIH 对卵巢颗粒细胞cyclin B1 的表达影响不显著。
PCNA 的免疫印迹显示单一条带,为 36 kD。研究结果显示,不同剂量的 GnIH 对母猪卵巢颗粒细胞中 PCNA 的表达均具有显著的抑制作用(图 5)。低剂量组(10-10和 10-12mol·L-1)GnIH 能极显著抑制PCNA 的表达(P<0.01),抑制作用强于高剂量组(10-6和 10-8mol·L-1GnIH)(P<0.05)。
2.4 GPR147 与 GnRH 的共存关系
本研究结果显示,GPR147 与 GnRH 在视前区及室旁核可见有阳性胞体与胞体或纤维密切接触(图 6)。【图6略】
3、 讨论
3.1 GnIH 与下丘脑-垂体-性腺轴
目前的研究显示,GnIH 及其受体不仅在下丘脑-垂体-性腺轴有分布,而且 GnIH 可在下丘脑、垂体和性腺 3 个水平调控生殖相关激素的合成和分泌。因此GnIH 对生殖调控的相关研究主要集中在下丘脑-垂体-性腺轴。
GnIH 在下丘脑对生殖的调控主要是通过对下丘脑中生殖相关神经肽(如GnRH、褪黑激素和kisspeptin等)的相互调节完成的。GnIH 与 GnRH 在羊下丘脑的形态学研究显示,GnIH 与 GnRH 在视前区有突触接触。GnIH 对 GnRH 影响的电生理学研究显示,GnIH 能抑制雌性和雄性大鼠脑片中 49% 的细胞GnRH 的释放频率。有研究提出 GnRH 并不是下丘脑中唯一能够调控促性腺激素的作用因子,kisspeptin 和 GnIH 也能在下丘脑中调控促性腺激素的释放,并且 kisspeptin 和 GnIH 互为拮抗物,共同调节下丘脑中 GnRH 的合成和分泌。
GnIH 在垂体水平参与动物生殖的调控,主要是通过影响促性腺激素的合成和释放。2000 年,Tsutsui等首次分离到 GnIH 时,即通过体外试验发现这种神经肽能抑制垂体前叶 LH 和 FSH 的分泌,此外,免疫组织化学法研究证明 GnIH-ir 神经元投射到下丘脑中最接近垂体的位置—ME。
GnIH 在性腺对生殖的调控主要体现在对排卵的调控,参与性腺的发育等。已有的研究显示,当排卵前 LH 峰到来时,下丘脑 GnIH 神经元的数量和 GnIH在卵巢中的表达均降低,证明 GnIH 参与调控动物的排卵。Singh 等研究发现 GnIH 可影响小鼠卵巢的组织学变化,与健康卵泡相比,给小鼠体内服用 GnIH 后,卵泡中出现异常和退化的黄体,卵巢颗粒细胞核浓缩或者肥大、卵巢膜细胞肥大或形成空泡,卵母细胞的细胞形态也出现异常,提示 GnIH 可能参与调控卵巢颗粒细胞的增殖和凋亡。
关于 GnIH 在生殖调控方面的研究才刚刚开启,其调节作用机制尚不清楚,在哺乳动物研究尚未深入。本试验针对母猪,从性腺水平入手探讨GnIH 的微调作用。
3.2 GnIH mRNA 在母猪各组织中的表达
目前,人们已研究了许多动物 GnIH 及 GPR147mRNAs 在组织中的表达情况。Ikemoto 和 Park 研究发现鸡 GnIH mRNA 仅在间脑表达,其受体则在间脑、端脑、视顶盖中表达,在卵巢中无表达。但是Maddineni 等利用不同的 PCR 引物和步骤则从鸡的卵巢和睾丸中扩增出 GnIH 受体片段。在日本鹌鹑,GnIH 受体在间脑、端脑、中脑、脊髓及垂体中有表达。
最近,Zhang 等研究发现 GnIH mRNA 主要表达于斑马鱼的中枢神经系统、眼、卵巢和睾丸,在脾、肾中有少量表达。在哺乳动物,仅在人和大鼠做了相关的表达研究。Hinuma 等研究发现 GnIH mRNA 在大鼠下丘脑、眼及睾丸,GPR147 mRNA 在垂体、睾丸、卵巢及胎盘中高表达。但是 Bonini 等却得出不一样的结论,他研究了 GPR147 mRNA 在人 24 个组织及大鼠 41 个组织中的表达情况,结果显示 GPR147mRNA 除了在中枢神经系统中高表达外在许多外周组织如脾、肾、肠等也有较高丰度的表达。不同物种的研究结果可能由于引物条件或种属特异性导致结果不太一致,但是 GnIH 及 GPR147 mRNAs 在中枢神经系统和生殖系统具有高表达则是物种间保守的。本研究结果也印证了这一点,猪 GnIH 及 GPR147 mRNAs主要在中枢神经系统中表达,且丰度较高,在卵巢和子宫呈中等表达,提示 GnIH 可能通过中枢调控动物的生殖活动。值得注意的是 GnIH 及 GPR147 mRNAs均在下丘脑表达丰度最高,GPR147 mRNA 在垂体的表达丰度仅次于下丘脑,提示 GnIH 及其受体可能具有多种生理功能,GnIH 可通过其受体在下丘脑水平影响 GnRH 来参与动物的生殖调控。在垂体水平,GnIH可通过其受体调控垂体前叶促性腺激素的合成和释放。此外,GnIH 及 GPR147 mRNAs 在卵巢及子宫中也有中等以上程度的表达,提示 GnIH 也可能在卵巢水平调控性激素的合成释放或者参与卵泡的募集等一系列生殖活动。GnIH 及其受体 mRNA 还在肾上腺、肾及肠道中表达,推测 GnIH 系统可能还参与应激和摄食等生理活动,但目前尚无猪 GnIH 在应激和摄食等方面的研究报道。
3.3 GnIH 对母猪卵巢类固醇激素分泌的影响
在母猪卵巢水平,已有研究证实 GnIH 及其受体在卵巢中分布,而且它们在生殖周期不同时期的表达也呈现规律性波动,提示 GnIH 在母猪卵巢水平可通过旁分泌或自分泌形式调控性激素的分泌、卵泡的发育等,从而参与母猪的生殖调控。本试验深入探讨了GnIH对体外培养卵巢颗粒细胞性激素分泌的影响,研究发现 GnIH 能显著抑制卵巢颗粒细胞中 E2的分泌,但对 P4的分泌影响并不显著。Oishi 等最新的研究发现与本研究结果一致,RFRP-3 能显著抑制FSK、LH 和 FSH 诱导的 P4的分泌,但却对8-Br- cAMP(8-bromoadenosine 3′5′-cyclic monophosphate)诱导及基础分泌的 P4影响并不显著,此外,加入双功能的GPR147 阻断剂 RF9 或者 GPR147 siRNA 后 P4的分泌则显著上升。目前,GnIH/RFRP-3 在卵巢水平参与动物生殖调控的研究较少,GnIH/RFRP-3 在卵巢的生理功能和作用机制尚不明确,还需要更多更深入的研究。
3.4 GnIH 对母猪卵巢颗粒细胞凋亡相关蛋白表达的影响
本试验首次证明了 GnIH 能在哺乳动物卵巢中抑制细胞周期蛋白的表达。有研究显示 cyclin B1 及PCNA 分别参与了卵巢细胞有丝分裂 S 期和 G1 后期细胞的增殖和转化。本研究发现 GnIH 能抑制卵巢颗粒细胞中周期蛋白 cyclin B1 及 PCNA 的表达。因此,推测 GnIH 可能通过影响卵巢颗粒细胞的细胞周期来抑制细胞的增殖。GnIH 可能通过抑制卵巢颗粒细胞的增殖及周期蛋白的表达来参与调控卵泡的生长发育。Maddineni 等也在鸡上发现,用鸡的 GnIH 处理等级前卵泡的颗粒细胞显著降低基础的而不是FSH刺激的细胞发育能力,提示卵巢 GnIH 可能参与卵巢卵泡的发育。由于性成熟或E2或P4处理使卵巢GnIHRmRNA 丰度降低,表明 GnIHR 在卵巢卵泡发育中的抑制作用。此外,GnRH 在外周生殖器官也有表达,其调控类似于 GnIH,这就意味着在生殖调控中 GnIH可能是 GnRH 的拮抗物。
3.5 GPR147 与 GnRH 的共存
在下丘脑水平,Bentley 和 Ubuka 等利用激光共聚焦技术研究发现 GnIH 神经元与 GnRH 神经元有突触联系,并且 GPR147 在 GnRH-I 神经元上表达。本研究发现 GPR147 与 GnRH 在视前区及室旁核有阳性胞体与胞体或突起密切接触,结果提示在下丘脑水平 GnIH 可通过其受体直接作用于 GnRH 神经元,影响 GnRH 的合成和分泌,进而参与猪的生殖调控。
4、 结论
本研究采用半定量 RT-PCR 方法证实 GnIHmRNA 在猪中枢神经系统及外周组织广泛表达,尤其在间脑中表达含量最高,在卵巢和子宫呈中等表达。
体外试验结果表明,不同剂量 GnIH 对卵巢颗粒细胞类固醇激素的分泌以及增殖相关蛋白的表达均有影响。下丘脑室旁核及视前区中 GPR147 与 GnRH 存在密切联系。本研究从分子和蛋白水平,生理学及形态学角度揭示了 GnIH 参与猪生殖调控的作用及机制,为深入研究 GnIH 的生理功能奠定了基础。
参考文献:
[1] 雷治海, 李月. 促性腺激素抑制激素的研究进展. 畜牧与兽医,2008, 40(9): 96-99.





