
间充质干细胞(mesenchymal stem cells,MSCs)具有高度增殖和多谱系分化能力,与各种组织的功能维持与修复再生有着密切的联系。但 MSC可在体内外环境的影响下,出现增殖能力下降,甚至发生凋亡等现象。在这些影响因素中,活性羰基类物质(reactive carbonyl species,RCS)对 MSCs的生物学行为的影响尚未报道。RCS 主要由多不饱和脂肪酸过氧化,在氧化应激条件下,其生成量显著增加.对组织功能和正常更新产生严重影响。
丙二醛(malondialdehyde,MDA)是一种代表性的RCS。本工作进行以小鼠骨髓 MSCs 的体外培养,研究 MDA 对这种干细胞凋亡的影响,为全面认识 RCS 的病理生理作用提供实验证据。
1、 材料与方法
1.1 材料
雌、雄性 Balb/c 小鼠各半,6~8 周龄,体重20±1.5 g,购自湖南斯莱克景达实验动物有限公司,1,1,3,3-四甲氧基丙烷(美国 Fluka 公司);低糖 DMEM 培养基(美国 Gbico 公司);胎牛血清(美国 Hyclone 公司);荧光定量 PCR 仪(7500 fastrealtime system, 美国 ABI 公司);TRIzol 试剂(美国 Inritrogen 公司);Taq man 逆转录酶试剂盒和SYBR Green MasterMix (美国 Applied Biosystems公司;Anti-Bcl-2;Anti-Bax;Anti-Caspase-3(美国 Santa Cruz 生物公司);Anti-actin(美国 Sigma公司);TUNEL 细胞凋亡检测试剂盒(美国 Roche公司)。
1.2 MDA 的配制
将 0.423 mL(2.5 mmol/L)的 TMP 与 1.0 mol/L的 HCl 2.0 mL 混合后,在 40 ℃的水浴中振荡水解 2.5 min,TMP 完全水解后用 6.0 mol/L 的 NaOH调节 pH 值至 7.2,最后用 PBS 定溶到 50 mL,并测定储备液在 267 nm(ε=31 500)的紫外吸收值来确定是否符合要求浓度。利用酸水解 1,1,3,3-四甲氧基丙烷(TMP)法配置 50 mol/L 的 MDA 储备液。
1.3 MSC 的体外培养
无菌条件下取小鼠双侧股骨胫骨,以 DMEM培养液冲洗髓腔,获得骨髓细胞,制备骨髓单细胞悬液。将骨髓有核细胞种于培养瓶中,接种密度为每 mm2培养瓶底 5×106个,培养体系为含 10%胎牛血清的 DMEM,于 37 ℃、10% CO2、饱和湿度下培养。每 3 d 更换培养液,继续培养, 细胞至铺满瓶底时,用胰蛋白酶消化法收集贴壁细胞,于同样培养体系和条件下传代培养, 以扩增和纯化骨髓MSCs. 取传代培养 P3 代的 MSCs,实验组另加MDA(终浓度为 0、0.01、0.1、1.0 mmol/L),培养 24 h后,所有组更换培养基,继续培养 9 d。
1.4 流式细胞技术
细胞以 2×l03/cm2细胞密度接种于细胞培养瓶中,每瓶 8 mL,培养至 7 d,用胰蛋白酶将细胞消化,取单细胞悬液 2×106个细胞于 PBS(pH=7.2)缓冲液中,500 g 离心 5 min,弃上清,反复两次,将单细胞悬液放置于 2~3 mL 冷 70%乙醇中,混匀,保存于 4 ℃,至少 30 min,离心洗涤两次,加入PI,上机检测。
1.5 TUNEL 法
实验具体步骤参照 Roche 公司细胞凋亡试剂盒说明书, 结果分别用荧光显微镜观察。凋亡细胞即 TUNEL(TdT-mediated dUTP nick end label-ing)阳性细胞,在荧光显微镜下呈黄绿色荧光,非凋亡细胞无荧光显示。油镜下,每一组随机观察500 个细胞,分别计数视野内 TUNEL 阳性细胞和TUNEL 阴性细胞。 以凋亡细胞数与细胞总数的比率作为该标本的凋亡指数 (Apoptosis index,AI),计算 4 组凋亡指数。
1.6 荧光定量 PCR
各组细胞经 7 d 诱导培养后,RNA 的分离提取,按 Trizol 试剂说明书进行。按 Taq Man 试剂盒要求,2 μg RNA 被逆转录成 cDNA。用 SYBRGreen MaterMix 试剂检测待测的基因的 mRNA 水平,共重复检测 3 次。PCR 反应条件:95 ℃ 45 s,94 ℃ 45 s,50 ℃ 45 s, 72 ℃ 90 s, 35 个循环, 72 ℃延伸 10 min。mRNA 水平用 β-Actin 作内对照标化,基因的表达用△△Ct 法定量分析。PCR 引物序列见表 1。

1.7 Western 印迹分析
用冰冷的 PBS 洗涤细胞 3 次,加细胞裂解液,在冰上将细胞迅速刮下,冰浴条件下超声破碎细胞,离心后吸出上清液体,用 Bradford 方法进行蛋白质浓度测定,取提取的蛋白质样品(25 μg)加入等体积上样缓冲液,100 ℃煮 5 min,10% SDS-聚丙烯酰胺凝胶电泳后电转移至 PVDF 膜上,封闭液室温封闭 1 h,1∶1 000 一抗 4 ℃孵育过夜,TBST 洗涤 3 次,1∶2 000 二抗室温孵育 1 h,TBST洗涤 3 次,ECL 发光显影。条带进行图像分析,测定灰度值,用 β-Actin 作内对照标化来表示各组MSC 的 Bcl-2、Bax、Caspase-3 相对表达量。
1.8 统计学处理
所有数据用平均值±标准差(x±s)表示。多组间比较,采用方差分析;显著性水平为 P<0.05。Sigma Plot 计算机软件作图。
2、 结果
2.1 MDA 增加 TUNEL 阳性细胞百分率如图 1 所示,与对照组相比,0.1、1.0 mmol/LMDA 处理组 TUNEL 阳性细胞百分率明显增加。0.01 mmol/L 组 TUNEL 阳性细胞百分率,与对照组差异无显著性。
2.2 MDA 增加 MSC 亚 G1 峰凋亡细胞百分比流式细胞术结果显示,与对照组相比,MDA处理使得 MSC 亚 G1 峰凋亡细胞百分比增加。0.01、1.0 mmol/L MDA 处理作用更明显,呈一定的剂量相关性(见图 2)。
2.3 MDA 降低 Bcl-2 mRNA 及蛋白的表达与对照组相比,MDA 处理组的 Bcl-2 mRNA及蛋白表达水平随着浓度增加,明显降低,呈浓度依赖性,这表明 MDA 能降低 Bcl-2 mRNA 及蛋白的表达,结果见图 3。
2.4 MDA 增加 Bax mRNA 及蛋白的表达与对照组相比,MDA 处理组的 Bax mRNA及蛋白表达水平随着浓度增加明显增加,呈浓度依赖性,这表明 MDA 能增加 Bax mRNA 及蛋白的表达,结果见图 4。

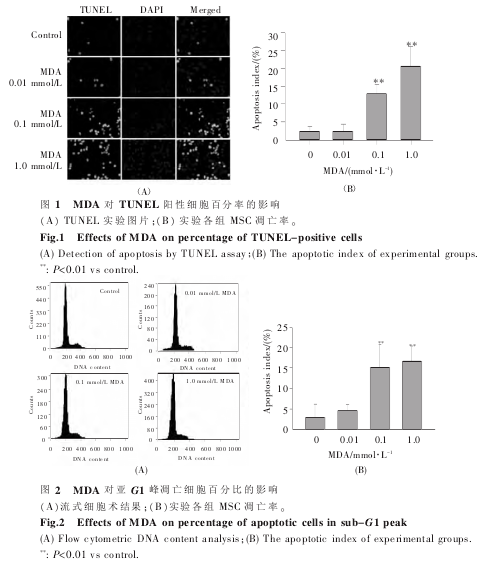
2.5 MDA 对 Bax/Bcl-2 比值的影响如图 5 所示,与对照组相比,MDA 处理能够增加 Bax/Bcl-2 mRNA 表达水平比值;中高浓度1.0、0.1 mmol/L MDA 增加 Bax/Bcl-2 比值的作用更加明显,呈浓度依赖性。
2.6 MDA 对 Caspase-3 mRNA 及 蛋白相对表达水平的影响。
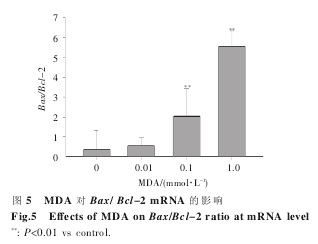
如图 6 所示,与对照组相比,MDA 处理组的Caspase-3 mRNA 及蛋白表达水平随着浓度增加明显增加,呈浓度依赖性,这表明 MDA 能增加Caspase-3 mRNA 及蛋白的表达。
3、讨论
本实验的结果表明,MDA 能够诱导小鼠骨髓MSC 细胞凋亡。Rittie研究发现,丙二醛结合蛋白的影响成纤维细胞的功能。 Long 报道MDA 抑制离体大鼠肝线粒体呼吸功能以及酶的活性,线粒体功能障碍与多种老年性退行性疾病密切相关。用 MDA 处理大鼠海马 CA1 区神经元后,细胞内线粒体发生变形、嵴消失,从而导致空间学习、记忆能力降低。MDA 与多种老年性退行性疾病密切相关。活性羰基类物质丙酮醛(methylglyoxal,MGO)损伤海马神经元细胞导致其认知功能的降低。凋亡调控细胞增殖与更新间的平衡,这种平衡对维持生物体的发育及正常功能结构起着十分重要的作用。因此,MSC 的凋亡与多种器官组织退行性改变密切相关。
凋亡的亚细胞和分子方面的调控已被广泛研究,凋亡级联反应的主要调节因子是 Bcl-2 家族成员,包括促凋亡蛋白和抑凋亡蛋白。脂质过氧化产物 4-羟基壬烯醛(4- hydroxy-nonenal,4-HNE)通过降低 Bcl-2 的表达,增加 Bax 的表达从而诱导 PC12 细胞的凋亡。我们首次报道 MDA 诱导的 MSC 细胞凋亡机制中涉及 Bcl-2 家族成员,Bcl-2 及 Bax 的调节。
天冬氨酸特异性的半胱氨酸蛋白酶(Caspases)家族的激活在哺乳动物细胞凋亡过程中起关键作用,是凋亡的执行者。 Kutuk 等报道:4-HNE通过线粒体释放细胞色素 C,激活 Caspase-3 诱导 3T3 成纤维细胞的凋亡,与多种老年性退行性疾病密切相关。Almeida 等报道 4-HNE 诱导小鼠成骨细胞的凋亡,是老年性骨质疏松症的机制中重要环节。MDA 是否可以直接激活 MSC 细胞Caspases 家族尚未见报道。我们的研究发现,MSC经 MDA 处理后,Caspase-3 表达增强,这一现象提示 Caspase-3 的激活在 MDA 诱导的 MSC 细胞凋亡过程中的起到重要作用。
综上所述, 我们的研究首次发现,丙二醛可诱导小鼠骨髓间充质干细胞的凋亡,其作用机制涉及 Bcl-2、Bax 和 Caspase-3 基因表达水平的变化,这为全面了解 RCS 提供了相关的实验数据。





