
目前,国内外研究多集中于干细胞向神经细胞分化的研究,而对体细胞的研究相对较少。干细胞存在伦理学、免疫排斥以及潜在的致瘤性等问题限制了其在临床上的应用,而具有部分胚胎干细胞特性的人羊膜上皮细胞(human amniotic epithelial cells,HAEC)不存在上述问题,从而为细胞治疗提供了新的选择。
HAEC是一种来源于人胎盘羊膜组织的上皮层体细胞。研究显示HAEC具有部分胚胎干细胞特性,即在体外培养下具有向3个胚层分化的潜能:内胚层(胰腺细胞、肝细胞)、中胚层(心肌细胞)和外胚层(神经细胞、肌细胞、心肌细胞,骨细胞,脂肪细胞,胰腺细胞,肝细胞)。细胞生活的微环境在分子水平决定了细胞的分化方向,因此在维甲酸诱导体外培养的HAEC向神经样细胞分化的过程中,选择最佳维甲酸干预浓度是决定成功与否的关键。本实验通过细胞形态学分析和检测细胞内巢蛋白(nestin)、微管相关蛋白2(MAP-2)、胶质纤维酸性蛋白(GFAP)和转录因子Oct-4表达,探讨维甲酸诱导HAEC在体外分化为神经样细胞的最适浓度,为HAEC在细胞移植中的应用奠定基础。
材料与方法
材料与试剂 羊膜标本由复旦大学附属中山医院妇产科提供,本研究经产妇本人签署知情同意书,并经中山医院伦理委员会同意。DMEM/F12、特级胎牛血清、PBS缓冲液、青霉素-链霉素双抗溶液、0.25%胰蛋白酶+0.02EDTA (GibcoLtd,美国)。Ⅱ型胶原酶、Dnase 酶(Sigma Ltd,美国)。鼠抗人vimentin 单克隆抗体(SR0746,EpitomicsInc,美国)。鼠抗人CK-19抗体(BM0033)、兔抗人Nestin多抗(BA1289)、鼠抗人MAP-2多抗(BM1243)、兔抗人GFAP多抗(BA0056)(武汉博士德生物工程有限公司,中国)。兔抗人Oct-4多抗(MAB4305) (Millipore Ltd,美国)。100、200、300、400筛网(上海瑞谷生物科技有限公司,中国)。
羊膜组织提取和处理HIV、梅毒、乙肝等血清学反应阴性的足月剖宫产后胎盘,胎盘娩出后,无菌条件下2~4 h将羊膜与绒毛膜分离,并将羊膜置于DMEM/F12 培养液内保存。羊膜上皮细胞的原代培养应在羊膜取得后6 h内进行。
原代HAECs 培养将5 cm×5 cm大小的羊膜置于含有双抗(100 U·mL-1青霉素、100 U·mL-1链霉素)的PBS 中反复冲洗 3次。然后放入不加血清的DMEM/F12培养基中漂洗3次。将漂冼后的羊膜用眼科剪剪成数小块;再将组织块反复剪成1 mm×1 mm大小。取10 mL羊膜组织悬液,按1∶4比例加入0.25%的Ⅱ型胶原酶,并置于37℃恒温振荡孵箱内消化2 h后,1 000 r·min-1离心5 min,吸出上清液(含胶原酶消化液)。再加入等体积0.25%胰蛋白酶-0.02%EDTA室温下消化15 min,用含10%胎牛血清的DMEM/F12培养基终止消化。1 000r·min-1离心5 min,去上清,用含10%胎牛血清的DMEM/F12培养基清洗后,将细胞悬液依次通过100、200、300、400 目筛网过滤,细胞计数,然后将细胞以 1 × 107个/mL 密度的 HAECs 悬液 2 mL 接种于 25 mL 培养瓶中,置5%CO2、37℃培养箱内培养。倒置显微镜动态观察细胞形态变化及生长增殖情况。3 d后首次换液,以后根据细胞生长情况,隔天换液,每次换液时去除非贴壁细胞。待3~4 d 后细胞融合长满时,用0.25% 胰蛋白酶消化,按1∶2 或1∶3 比例进行传代,倒置显微镜观察,待细胞铺满瓶底时,重复上述操作。
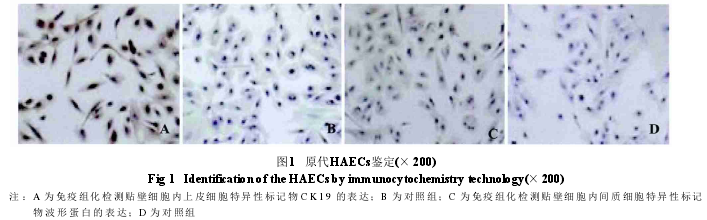
原代HAECs的鉴定取第3代HAECs制作细胞爬片。常温下将细胞爬片用PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,×3次;0.2%TritonX-100 破膜 20 min,PBS 漂洗 3 min,× 3 次;加入正常的山羊血清室温下封闭30 min,PBS漂洗3 min,×3次;加入鼠抗人CK19(1∶100)抗体和鼠抗人vimentin(1∶100)抗体,37℃孵育2 h,PBS漂洗3 min,×3次;加入辣根过氧化酶标记的二抗,37℃孵育30min,PBS洗3min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察并摄像。对照组用PBS代替一抗。
不同浓度维甲酸诱导HAECs向神经样细胞分化 消化收集第3 代HAECs 制成细胞爬片,待细胞生长至60%~70% 融合时(对照组用含 10% 胎牛血清的 DMEM/F12 培养基培养),各维甲酸组去除培养基,加入含不同浓度维甲酸的DMEM/F12诱导液(内含10%胎牛血清)。
实验分组 共分为5组:①对照组,含10%胎牛血清的DMEM/F12培养基处理,不含维甲酸;②1×10-8mol·L-1维甲酸组[含1×10-8mol·L-1维甲酸DMEM/F12培养基(含10%胎牛血清)];③1×10-7mol·L-1维甲酸组[含1 × 10-7mol·L-1维甲酸DMEM/F12培养基(含10%胎牛血清)];④1×10-6mol·L-1维甲酸组[含1×10-6mol·L-1维甲酸的DMEM/F12培养基(含10% 胎牛血清)];⑤1 ×10-5mol·L-1维甲酸组[含1×10-5mol·L-1维甲酸的DMEM/F12 培养基(含 10% 胎牛血清)]。每天换液,换液时去除非贴壁细胞,共诱导7 d。
不同浓度维甲酸诱导HAECs分化后Nestin免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS 漂洗3 min,×3 次;加入正常的山羊血清,室温下封闭30 min,PBS 漂洗 3 min,× 3 次;加入兔抗人 Nestin 抗体(1∶100),37℃孵育2 h,PBS 漂洗3 min,×3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,Nestin标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化后MAP-2免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,×3次;4%多聚甲醛固定10 min,PBS漂洗3 min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS漂洗3 min,×3次;加入正常的山羊血清室温下封闭30 min,PBS 漂洗 3 min,× 3 次;加入兔抗人 MAP-2抗体(1∶100),37℃孵育2 h,PBS漂洗3 min,×3次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,MAP-2标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化后GFAP免疫组化染色
取出细胞爬片。常温下,将细胞爬片PBS漂洗3 min,× 3 次;4% 多聚甲醛固定 10 min,PBS 漂洗 3min,× 3 次;0.2%TritonX-100 破膜 20 min,PBS 漂洗3 min,×3次;加入正常的山羊血清室温下封闭30 min,PBS漂洗3 min,×3次;加入兔抗人GFAP抗体(1∶100),37℃孵育 2 h,PBS 漂洗 3 min,× 3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS漂洗3 min,×3 次;DAB 暗环境下显色;自来水冲洗,苏木精复染 2min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,GFAP标记的神经样阳性细胞呈棕褐色。
不同浓度维甲酸诱导HAECs分化过程中Oct-4免疫组化染色取出细胞爬片。常温下将细胞爬片PBS洗3min,×3次;4% 多聚甲醛固定10 min,PBS洗 3 min,×3 次;0.2%TritonX-100 破膜 20 min,PBS 洗 3 min,×3 次;加入正常的山羊血清室温下封闭 30 min,PBS 洗3 min,× 3 次;加入兔抗人 Oct-4 抗体(1∶100),37℃孵育2h,PBS洗3 min,×3 次;加入辣根过氧化酶标记的二抗,37℃孵育30 min,PBS 洗3 min,×3次;DAB暗环境下显色;自来水冲洗,苏木精复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。倒置显微镜下观察细胞并摄像,Oct-4标记的神经样阳性细胞呈棕褐色。
图像分析 随机取10 个不同视野(×100),以每个视野内阳性细胞数为量化指标,每组视野阳性细胞数量作为该组HAECs 诱导分化为神经样阳性细胞密度代表值,以阳性细胞数/100倍视野表示。
统计学方法 采用SPSS17.0 统计软件进行统计学分析。各组计量资料以 ±s表示。各组间比较采用单因素方差分析,以α=0.05为检验水准,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
结 果
体外培养 HAECs 细胞的生长特性 倒置显微镜下观察细胞在贴壁前轮廓清晰、体积较小、圆形、透亮、折光性较强、富有立体感。接种2~3 d后贴壁,细胞逐渐变大,折光性降低,整个细胞轮廓变暗,完全伸展的细胞形态多样,呈梭形、多角形、眼睛样等,轮廓清晰,胞质丰富,胞核居中,可见1~2个核仁,呈圆形、卵圆形。
接种3 d后,人羊膜上皮细胞进入指数生长期,细胞数量明显增多,呈不规则多角形。接种5~7 d时90%细胞融合成片,形成单层放射状或漩涡状生长,开始进行传代。传代6 h 后即可贴壁,细胞3~4 d融合长满,形成单层放射状或漩涡状单层细胞。传至2~5代,细胞形态、大小、活性均匀一致。传至6代以后少数细胞形态发生变化,呈不规则形,细胞增殖减慢。传至第8代细胞胞质内出现空泡和黑色颗粒,细胞增殖能力减弱,逐渐停滞生长,凋亡并从瓶壁脱落。第3代细胞融合后数量恒定,符合实验要求,取第3代细胞作为实验对象。
体外培养细胞的来源鉴定 上皮细胞标记物CK19标记的贴壁细胞胞质内有大量棕褐色物质,胞核呈蓝紫色(图 1A);间质细胞标记物波形蛋白(vimentin)标记的贴壁细胞胞质内仅有少量棕褐色物质,胞核呈蓝紫色(图1C)。
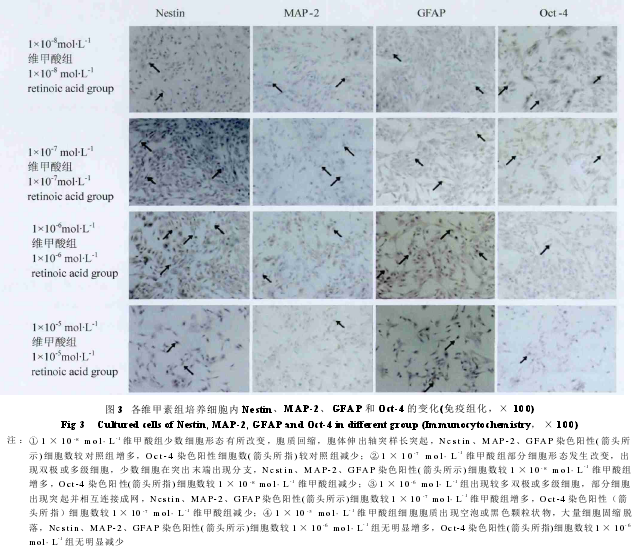
不同浓度维甲酸对HAECs分化作用的影响
1.不同浓度维甲酸组HAECs分化的形态学变化:对照组细胞形态未发生改变;1×10-8mol·L-1维甲酸组少数细胞形态有所改变,胞质回缩,胞体伸出轴突样长突起;1 × 10-7mol·L-1维甲酸组部分细胞形态发生改变,出现双极或多级细胞,少数细胞在突出末端出现分支;1×10-6mol·L-1维甲酸组出现较多双极或多级细胞,部分细胞出现突起并相互连接成网;1×10-5mol·L-1维甲酸组细胞胞质出现空泡或黑色颗粒状物,大量细胞固缩脱落。
2. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的Nestin 阳性细胞(图2,3)表达率:对照组为(12.12±0.37)%,1×10-8mol·L-1维甲酸组为(15.13±0.28)%,1 × 10-7mol·L-1维甲酸组为(17.56±1.15)%,1 ×10-6mol·L-1维甲酸组为(20.98±0.95)%,1×10-5mol·L-1维甲酸组为(19.20±3.12)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.15),其他组均差异有显著统计学意义(P<0.01)。
3. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的MAP-2 表达率(图2,3):对照组为(14.12 ±1.04)%,1× 10-8mol·L-1维甲酸组为(22.81±1.32)%,1×10-7mol·L-1维甲酸组为(24.21±1.65)%,1×10-6mol·L-1维甲酸组为(29.56 ±1.35)%,1×10-5mol·L-1维甲酸组为(24.34±3.85)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.23),其他组均差异有显著统计学意义(P<0.01)。
4. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的 GFAP 表达率(图2,3):对照组为(11.23 ±0.26)%,1 × 10-8mol·L-1维甲酸组为(13.21±0.60)%,1×10-7mol·L-1维甲酸组为(15.63±1.18)%,1×10-6mol·L-1维甲酸组为(22.69±1.62)%,1×10-5mol·L-1维甲酸组为(15.79 ±3.31)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.27),其他组均差异有显著统计学意义(P<0.01)。

5. 免疫组化法检测不同浓度维甲酸组HAECs诱导分化细胞的 Oct-4 表达率(图 2,3):对照组为(25.23 ±3.12)%,1× 10-8mol·L-1维甲酸组为(18.12±1.23)%,1×10-7mol·L-1维甲酸组为(12.65±0.52)%,1×10-6mol·L-1维甲酸组为(10.02±0.28)%,1×10-5mol·L-1维甲酸组为(9.65±2.03)%。不同浓度维甲酸组与对照组比较,均差异有显著统计学意义(P<0.01);不同浓度维甲酸组组间比较,除1×10-6mol·L-1维甲酸组、1×10-5mol·L-1维甲酸组外(P=0.19),其他组均差异有显著统计学意义(P<0.01)。
讨 论
HAECs为人体正常细胞,其能够在体外大量培养且被诱导分化为不同类型的细胞[5],且HAECs还具有低免疫原性、不具致瘤性及无伦理法律问题等优点[4],为治疗神经系统退行性疾病和外伤性神经损伤带来新的契机。但目前维甲酸诱导HAECs 分化的研究仍不十分完善,本研究拟探索不同浓度维甲酸对HAECs的诱导分化作用,从而确定其最适浓度,为HAECs在临床治疗神经系统疾病提供理论基础。
Takashima 等研究发现:新鲜分离的HAECs能够表达α抗胰蛋白酶、CPS-I、CYP2D6、CYP3A4等肝细胞功能基因及 HNF-3γ、HNF-4、C/EBP-α、HNF-1等转录因子,在加入1×10-7mol·L-1地塞米松和0.1 ?mol·L-1胰岛素诱导1周后,上述功能基因随诱导天数增加表达也逐渐增强。此外,还发现诱导后的HAECs能够合成并分泌白蛋白、储备糖原的功能,这正是肝细胞所具有的典型功能。
Miki等研究发现:HAECs加入10 mmol·L-1尼克酰胺悬浮培养14 d后,可检测到胰岛发育、胰岛功能基因,如胰腺十二指肠同源盒(PDX1)、神经源素3(Ngn3)、同源异形盒转录因子6(PDX6)、胰岛素、胰高血糖素的表达,且随着培养基中葡萄糖浓度的升高,胰岛素分泌也增加,证实HAECs可向胰腺样细胞分化。
Miki 等还发现:HAECs在加入1 mmol·L-1抗坏血酸磷酸盐培养14 d 后,可以检测到心肌特异性基因表达,如转录因子Nkx2.5和GATA-4及房、室肌球蛋白轻链2(MLC-2A,MLC-2V)。此外免疫组织化学染色检测到α-辅肌动蛋白和特异性结蛋白等肌系细胞标志物,证实HAECs体外诱导下也可表现出心肌细胞的特性。
多项研究发现[13~16],HAECs表达神经元特异性标记物MAP-2、神经胶质标记物GFAP和神经干细胞标志物Nestin,在碱性成纤维生长因子、神经生长因子、表皮生长因子等多种生长因子和(或)维甲酸诱导下,能够上调Nestin、MAP-2和GFAP表达,具合成释放乙酰胆碱、儿茶酚胺、多巴胺及去甲肾上腺素等多种神经递质的功能,且能合成释放神经营养因子3、神经生长因子、脑源性神经营养因子等多种因子,证实人羊膜上皮细胞可向神经样细胞分化。
本研究采用免疫组化技术证实HAECs在维甲酸诱导下可导致Nestin、MAP-2、GFAP阳性细胞增多,Oct-4阳性细胞表达减少,促使HAECs 向神经样细胞分化;并将HAECs暴露于不同的维甲酸浓度下,根据神经样细胞的阳性比例寻求出维甲酸体外诱导HAECs向神经样细胞分化的最适浓度,结果表明维甲酸最适浓度为1 ×10-6mol·L-1。值得注意的是,在HAECs原代培养中,加入了1×10-5mol·L-1维甲酸诱导后细胞胞质内出现空泡样改变,大量细胞固缩脱落,并可见部分细胞碎片,提示维甲酸具有一定毒性,过高浓度的维甲酸可导致HAECs凋亡。
体外培养HAECs内上皮细胞特异性标记物CK19表达强阳性,证实培养细胞为上皮细胞,但部分细胞仍低表达vimentin,表明经过体外培养可能引起HAECs的去分化,也可能是羊膜组织上发生了上皮-间质转分化。总之,本研究显示HAECs可在维甲酸诱导下转化为神经样细胞,1×10-6mol·L-1维甲酸为最适诱导浓度,证实HAECs具有分化为神经细胞的潜能。本研究为临床上应用细胞治疗神经系统疾病提供新思路。





