199 培养基是 Morgan 等于 1950 年开发的培养基,其广泛应用于各类细胞的培养及相关病毒性疫苗的研发生产。Vero 细胞是世界卫生组织和我国生物制品规程认可的用于疫苗生产的细胞系。与其他细胞基质相比,Vero 细胞来源方便,无外源因子污染,对多种病毒敏感,病毒增殖滴度较高,是很多病毒的理想培养基质,广泛应用于人和动物疫苗的生产。
Vero 细胞的生长状态直接影响相关病毒性疫苗的生产效率和疫苗质量,因此,培养基的筛选显得尤为重要。
本研究使用的改良M199培养基是以Gibco M199培养基为基础,通过调整氨基酸等营养成分的配比而制成的培养基。本实验通过比较改良 M199 培养基和进口 M199 培养基培养 Vero 细胞及狂犬病病毒的效果,以期获得更适应 Vero 细胞高密度培养的培养基。
1 材料与方法
1. 1 细胞及病毒 Vero 细胞及狂犬病病毒 aG 株均由长春生物制品研究所有限责任公司提供。
1. 2 实验动物 SPF 级昆明小鼠,雌性,55 日龄,体重 11 ~ 18 g,由长春生物制品研究所有限责任公司实验动物中心提供,动物许可证号:SCXK(吉)2011-0003。
1. 3 主要试剂 改良 M199 培养基由无锡市美迪生物制品有限公司提供;进口 M199 培养基由国外某公司提供;胰酶购自美国 Gibco 公司;新生牛血清购自武汉三利生物技术有限公司。
1. 4 细胞培养及形态观察 取已长满单层的 Vero细胞,加入 0. 25%胰酶消化,按 1 ∶ 6 传代,以 6 ×104个 / ml 的密度接种于新的 T25 细胞培养瓶中,分别用含 5%新生牛血清的改良 M199 培养基和进口 M199 培养基,置 37 ℃恒温培养箱中静止培养。每隔 24 h 于倒置显微镜下观察细胞的生长状态。
1. 5 细胞计数与活力测定 细胞长成致密单层时,消化计数,共计数 3 次,取平均值;同时采用台盼蓝染色法测定细胞活力。细胞活力(%)= 活细胞数 /(活细胞数 + 死细胞数)×100%1. 6 病毒接种及培养 细胞长成致密单层后,弃去培养液,分别加入含 1%新生牛生血清的改良 M199 培养基和进口 M199 培养基,再分别按 0. 1 MOI 接种狂犬病病毒 aG 株,置 33 ℃恒温孵箱中静止培养。
1. 7 病毒滴度的测定 病毒接种 48 h 后,每隔 12 h采样,每隔 3 d 更换 1 次维持液。按照《中国药典》三部(2010 版)规定,采用小鼠脑内滴定法测定狂犬病病毒滴度。
2 结 果
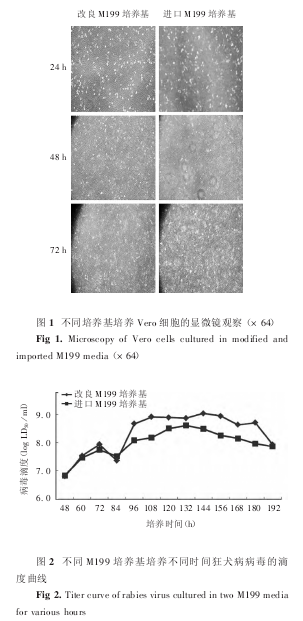
2. 1 不同 M199 培养基培养的 Vero 细胞的形态 倒置显微镜下观察可见,使用改良 M199 培养基培养的Vero 细胞较进口 M199 培养基培养的 Vero 细胞形态更规则,皱缩死细胞也相对较少,见图 1。
2. 2 不同 M199 培养基培养的 Vero 细胞的增殖情况与活力 两种培养基培养 72 h 时,Vero 细胞均已长成致密单层,使用改良 M199 培养基培养的细胞密度平均值(5. 13 × 105个 / ml)高于进口 M199 培养基(4. 02 × 105个 / ml),细胞活力平均值(98. 53%)也高于进口 M199 培养基(96. 24%)。
2. 3 不同 M199 培养基培养的狂犬病病毒的滴度 检测结果显示,使用改良 M199 培养基培养狂犬病病毒,病毒增殖更快,滴度更高,峰值可达 109log LD50/ ml,明显高于使用进口 M199 培养基培养的病毒滴度,见图 2。
3 讨 论
Vero 细胞是由世界卫生组织推荐用于生产人用生物制品的传代细胞系,目前广泛应用于规模化人用疫苗的生产,包括狂犬病疫苗和重组蛋白的生产。为了获得高质量的病毒收获液,首先需获得高密度的细胞。与其他体外培养的哺乳动物细胞一样,Vero 细胞的生长对环境条件的要求较高,因此,选择合适的培养基十分重要。本实验比较了改良 M199 培养基和进口 M199 培养基培养 Vero 细胞及狂犬病病毒的效果,发现改良 M199 培养基培养的Vero 细胞形态更规则,培养 72 h 即可长成致密单层,增殖倍数达 10 倍左右;以其作为维持液培养狂犬病病毒,病毒滴度也明显高于使用进口 M199 培养基。
本实验采用的是 T25 方瓶培养 Vero 细胞以及狂犬病病毒,而实际生产中现均已采用转瓶或生物反应器规模,该改良 M199 培养基能否适用于高密度大规模 Vero 细胞及相关病毒的培养,尚需进一步验证。
参考文献
[1] Kurokawa M,Sato S. Growth and poliovirus production of Verocells on a novel microcarrier with artificial cell adhesive proteinunder serum-free conditions [J]. J Biosci Bioeng,2011,111(5):600-604.
[2] Toriniwa H,Komiya T. Japanese encephalitis virus productionin Vero cell with serum-free medium using a novel oscillatingbioreactor[J]. Biologicals,2007,35(4):221-226.
[3] Genzel Y,Dietzsch C,Rapp E,et al. MDCK and Vero cellsfor influenza virus vaccine production:a one-to-one comparisonup to lab-scale bioreactor cultivation [J]. Appl Microbiol Biote-chnol,2010,88(2):461-475.
[4] Tiwari M,Parida M,Santhosh SR,et al. Assessment of immu-nogenic potential of Vero adapted formalin inactivated vaccinederived from novel ECSA genotype of Chikungunya virus [J].Vaccine,2009,27(18):2513-2522.
[5] Souza MC,Freire MS,Schulze EA,et al. Production of yellowfever virus in microcarrier-based Vero cell cultures [J]. Vac-cine,2009,27(46):6420-6423.
[6] Yasumura Y,Kawakita Y. Vero cells origin,properties andbiochemical application[M]. Chiba:School of Medicine ChibaUniversity Press,1988:2-19.
[7] Reiter M,Mundt W,Grillberger L,et al. Animal protein freemedia for cultivation of cells [P]:US7955833 B2,2008 / 00-09040 Al. 2008-01-10.
[8] Mendonca RZ,Vaz-de-Lima LR,Oliveira MI,et al. Studies onthe efficiency of measles virus antigen production using Verocell culture in a microcarrier system[J]. Braz J Med Biol Res,1994,27(7):1575-1587.
[9] 王佃亮,肖成祖,陈昭烈,等. 微载体高密度培养 Vero 细胞的研究[J]. 生物工程学报,1996,12(2):164-170.
[10] Gao JW,Lu C,Jia WY,et al. Optimization of the in vitroVero cell culture conditions [J]. J Anhui Agri Sci,2012,40(19):10139-10141,10162.(in Chinese)
高建伟,鲁承,贾文影,等. Vero 细胞体外培养条件的优化[J]. 安徽农业科学,2012,40(19):10139-10141,10162