BHK-21细胞(Baby hamster kidney cell)是从叙利亚幼鼠肾组织中分离培养获得的成纤维型贴壁细胞系,该细胞常用于多种病毒的增殖和纯化,如 口 蹄 疫 病 毒 (Foot-and-mouth disease vi-rus,FMDV)、脑心肌炎病毒(Encephalomyocar-ditis virus,EMCV)、呼肠孤病毒(Reovirus)和水疱性口炎病毒(Vesicular stomatitis virus,VSV)等,目前,该细胞广泛应用于口蹄疫疫苗的规模化生产。在疫苗生产过程中需要对细胞的培养条件进行不断地优化来提高细胞密度和病毒产量,而细胞代谢动力学特征研究是细胞培养条件优化最重要的内容之一。该文通过对静置培养条件下BHK-21细胞生长的葡萄糖(Gluc)、乳酸(Lac)、谷氨酰胺(Gln)和氨(NH4+)的代谢进行测定和分析,建立了该细胞对Gluc、Lac、Gln和NH4+等物质的代谢动力学模型,为该细胞高密度培养条件优化提供参考。
1材料与方法
1.1材料
DMEM培养基(Gibco),新生牛血清(兰州民海,使用时按培养液体积的10%添加)和胰蛋白酶(Gibco,使用浓度为0.25%)等。所用细胞为BHK-21细胞,由甘肃省动物细胞工程技术研究中心提供。仪器设备为多参数生化分析仪(Ap-plitech,NOVA400)、细胞计数仪(INNOVATIS,CASY TT)、二氧化碳培养箱(Thermo,3111型)及倒置相差显微镜(Olympus,CKX41型)等。
1.2方法
1.2.1细胞准备
常规法复苏BHK-21细胞,显微镜观察,待80%以 上细胞贴壁后,换液 培养。细胞长成致密单层后按1∶4传代培养,选用复苏后培养第3、4、5代的细胞分别进行生长动力和代谢动力学试验。
1.2.2细胞生长动力学及活力曲线绘制
(1)低密度细胞悬液制备:取复苏后适应培养第3代的BHK-21细胞,用胰酶消化后制成细胞悬液,计数,按有 限 稀 释 法 的 原 则,将 细 胞 悬 液 稀 释 至1.0×104~2.0×104upf·mL-1。(2)接种及培养:将稀释好的细胞悬液接种到24个T25的细胞瓶中,每瓶10mL,置37℃,5% CO2中培养。(3)计数、活力检查及样品收集:从接种培养算起,每隔24h,取3瓶细胞将上清混合均匀,取3mL冷冻留样(用于细胞代谢试验),然后分别消化计数,检查细胞活力,直至细胞密度降低为止。(4)平行试验:同法对第4、5代的细胞进行试验,并计算各培养阶段的细胞密度和活力的平均值及其标准偏差。(5)生长曲线绘制:以培养时间为横坐标,平均细胞密度和细胞活力为纵坐标,绘制细胞的生长曲线和活力变化曲线。(6)计算细胞倍增时间:倍增时间=T/A(式中:A=log2Y/X,其中,Y为细胞峰值前1d计得的数,X为接种细胞数,T为培养时间)。
1.2.3代谢动力学模型
(1)样品检测:将收集的各培养阶段的培养液样品用多参数生化分析仪检测Gluc、Gln、Lac和NH4+的浓度,并计算3个代次 细 胞 各 培 养 阶 段 的 平 均 值 及 其 标 准 偏差。(2)代谢曲线绘制:以培养时间为横坐 标,Gluc、Gln、Lac和NH4+浓度平均值为纵坐标绘图,即得代谢曲线图。(3)细胞指数:生长期比代谢速率计算求得
其中,X1和X2是2个取样点的细胞密度;ΔS是2个取样点被测物浓度的变化值;Δt是子个取样点的时间间隔。
2结果与分析
2.1细胞生长曲线
BHK-21细胞在静置培养条件下生长曲线呈S型,前24h为适应期,24~120h为对数生长期,以后便进入平台期和衰退期,平均最大增殖密度为50.3×104upf·mL-1,倍增时间为21.1h,绘制细胞生长曲线图如图1所示。细胞活力在所绘制的生长曲线内保持较高水平,在培养后期开始下降。连续培养3个代次各阶段的平均细胞密度和活力见表1。
2.2 BHK-21细胞代谢动力学分析
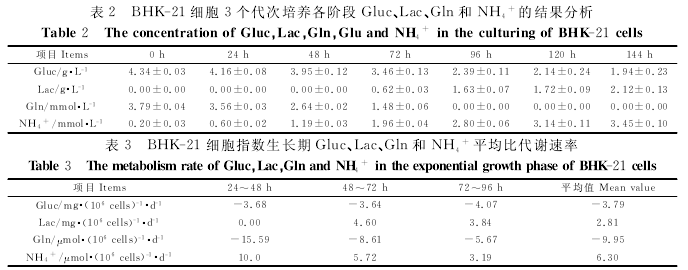
BHK-21细胞在生长过程中要消耗Gluc和Gln,同时代谢要产生废物Lac和NH4+(见表2),在72~96h内消耗Gluc、Gln和生成Lac、NH4+的量最高,在整个对数生长期内Gluc和Gln的比消耗速率为-3.79mg·(106cells)-1·d-1和-9.95μmol·(106cells)-1·d-1,Lac和NH4+的比生 成 速 率 为2.81 mg·(106cells)-1·d-1和6.30μmol·(106cells)-1·d-1(见表3)
3结论与讨论
葡萄糖和谷氨酰胺是细胞培养基中的主要碳源和能源。谷氨酰胺代谢能为动物细胞生长提供30%~65%的能量,大部分的葡萄糖通过糖酵解途径为细胞提供中间代谢物质和能量,最终生成乳酸,只有很少部分进入三羧酸循环(TCA)和磷酸戊糖途径。谷氨酰胺是动物细胞培养中最重要的氨基酸,也是培养基中浓度最高的氨基酸。谷氨酰胺是细胞生物合成中氮的主要来源,核酸中的嘌呤、嘧啶和氨基糖中的氮来自谷氨酰胺。谷氨酰胺也可以作为碳源直接参与细胞大分子物质的合成。
谷氨酰胺的存在可以促进其它氨基酸的运输和利用。在细胞培养中,谷氨酰胺不稳定,容易降解。细胞也会过量利用谷氨酰胺,导致氨的积累。控制培养基中谷氨酰胺的浓度,可以有效降低氨的积累,改善细胞的生长环境。乳酸是在培养过程中动物细胞代谢葡萄糖产生的主要代谢产物之一,对细胞的生长、代谢和产物的合成有着重要的影响。乳酸主要来源于葡萄糖的代谢过程,谷氨酰胺及其它氨基酸的代谢也能产生少量乳酸(此部分乳酸约占乳酸总量的10%左右)。在有氧的条件下,依细胞类型和培养条件的不同,葡萄糖转变成乳酸的量在5%~10%,最大可达70%。乳酸对细胞生长的不良影响主要是改变培养环境的pH和渗透压,间接地影响细胞的生长、代谢和产物的合成。尽管不同的细胞系对乳酸具有不同的耐受能力,但只要维持pH恒定,一般均能耐受较高浓度的乳酸。在pH恒定的情况下,乳酸对细胞生长的影响可能来自2个方面,一是乳酸本身对细胞生理生化的影响;二是因乳酸的添加而导致了培养基渗透压的增加,继而影响细胞生长。
氨主要是由谷氨酰胺等氨基酸脱氨产生的。细胞培养过程中,谷氨酰胺的消耗比其它氨基酸的总和还多,80%~90%的氨都是由谷氨酰胺代谢产生的。与乳酸相比,较低浓度的氨就会对细胞生长产生抑制。氨的积累使细胞内的UDP氨基己糖增加,影响细胞的生长及蛋白质的糖基化过程。氨抑制谷氨酰胺代谢途径,使天冬氨酸和谷氨酸的消耗增加,影响细胞的氨基酸代谢。同时氨浓度的提高改变 了 细胞内 局 部微环境的pH,影响细胞的正常生理功能。氨不仅对细胞的生长具有较强的抑制作用,而且对细胞的生存也具有毒性。当氨的浓度高于3mmol·L-1时,对细胞的生长具有明显的抑制作用。
该研究建立了BHK-21细胞生长及代谢动力学模型,为BHK-21细胞应用于口蹄疫疫苗的生产提供了基本理论依据。
参考文献:
[1] 张春红,黄毓茂.口蹄疫疫苗研究进展[J].畜牧与兽医,2010,42(2):96-99.
[2] 王家敏,平玲,沈武玲,等.MDCK细胞库的建立及其生物学特性 研 究 [J].山 西 农 业 科 学,2012,40(12):1231-1234,1261.
[3] 王家敏,乔自林,冯若飞,等.青海大通马耳缘组织成纤维细胞系的 建 立 及 生 物 学 特 性 研 究 [J].黑 龙 江 畜 牧 兽 医,2012(17):7-9,116.
[4] 令世鑫,关伟军,冯玉萍,等.河曲马睾丸组织成纤维细胞系的建立及生物学特性研究[J].西北农业学报,2012,21(7):10-14.
[5]Cruz H J,Freitas C M,Alves P M,et al.Effects of ammoniaand lactate on growth,metabolism,and productivity of BHKcells[J].Enzyme and Microbial Technology,2000,27:43-52.
[6] 冯磊,吴培培,褚轩,等.Marc-145细胞无血清培养驯化、代谢分析及PRRSV增殖能力比较[J].江苏农业科学,2012,40(7):182-185.
[7] 刘兴茂,刘红,叶玲玲,等.CHO工程细胞无血清悬浮培养的生长代谢特征及动力学模型[J].生物工程学报,2010,26(1):85-92.
[8] 高红亮,丛威,欧阳藩.体外培养的哺乳动物细胞的葡萄糖和谷氨酰胺代谢[J].生物技术通报,2000(2):17-22.
[9]Cruz H J,Ferreira A S,Freitas C M M.Metabolic responsesto different glucose and glutamine levels in baby hamsterkidney cell culture[J].Appl Microbiol Biotechnol,1999,51:579-585.
[10]Cruz H J,Moreira J L,Carrondo M J T.Metabolic shiftsby nutrient manipulation in continuous cultures of BHKcells[J].Biotechnol Bioeng,1999,66:104-113.
[11]田波,武发菊,安芳兰,等.氨和乳酸对悬浮培养的BHK-21细胞生长和胞内酶活性的影响 [J].中 国 畜 牧 兽 医,2011,38(9):37-40.
[12]孙祥明,张元兴.乳酸对重组CHO细胞生长代谢及EPO表达的影响[J].化工学报,2002,53(10):1034-1039.
[13]孙祥明,张元兴.葡萄糖对重组CHO细胞生长代谢及EPO表 达 的 影 响 [J].生 物 工 程 学 报,2001,17(6):698-702.