
肺孢子菌肺炎( Pneumocystis pneumonia,PC) 是各种先天或后天免疫机能低下者常见的并发症和主要的死亡原因之一.复方磺胺甲 唑作为目前预防和治疗 PCP 的主要药物,由于其毒副作用及耐药性问题受到了一定程度限制.因此,寻找更为安全及有效的防治措施成为目前研究 PCP 的一个焦点.
P55 抗原是肺孢子菌细胞壁分子量为 45 ~ 55kD 的组分抗原,它能刺激宿主产生保护性免疫反应[1].Ma 等[2]发现 p55 抗原基因存在多态性并克隆了 p55-v1 ~4 抗原基因,并将 Smulian 等[3]克隆的p55 抗原基因命名为 p55-v0,比较发现 p55-v3 与p55-v0 在结构和染色体位置上均存在差异.本课题组前期已成功克隆出 p55-v3 与 p55-v0 抗原基因,序列 比 对 发 现 p55-v3 和 p55-v0 同 源 性 仅 为20. 9%[4].那么机体感染 PC 过程中,p55-v3 能否刺激宿主产生保护性免疫反应,尚无研究证实.本研究在成功构建 PC DNA 疫苗 pVAX-p55-v3 及pVAX-p55-v0 基础上[5],免疫 SD 大鼠并诱导 PC 感染,比较观察肺重/体重、肺印片包囊计数及组织病理学,从而对 p55-v3 抗原的免疫保护作用提供依据.
1 材料与方法
1. 1 主要试剂、质粒及菌株 质粒抽提试剂盒( 大抽) 购自 Omega 公司.感受态大肠杆菌 DH5α 购自北京 鼎 国 生 物 技 术 有 限 公 司.真 核 表 达 载 体pVAX1 购 自 Invitrogen 公 司. pVAX-p55-v3 及pVAX-p55-v0 由本实验室自制.
1. 2 质粒的抽提 ( 大抽) 挑取 pVAX-p55-v3、pVAX-p55-v0、pVAX1 单菌落,分别接种于 LB / Kna培养基中,按质粒抽提试剂盒( 大抽) 说明书进行抽提,核酸蛋白分析仪测定质粒浓度及纯度.
1. 3 动物免疫 40 只 SD 雌性大鼠,分为 4 组( A组 PBS 对照组、B 组 pVAX1 免疫组、C 组 pVAX-p55-v0 免疫组、D 组 pVAX-p55-v3 免疫组) ,分别肌肉注射 DNA 疫苗100 μg,每15 天免疫1 次,共免疫4 次.末次免疫 15 d 后,按照文献[6]报道建立PCP 动物模型,诱导 PC 感染.
1. 4 疗效考核 实验前后均记录各组大鼠体重.
实验完毕,处死大鼠,取肺分离气管及肺门组织,吸干表面水分后称全肺湿重.将每只大鼠的 4 个肺叶上下横断,印于 5 张载玻片上印片,每张印片编号.空气干燥,甲醇固定,六亚甲基四胺银( GMS) 染色,油镜下顺序观察 100 视野,计数 PC 包囊数,计算每视野包囊均数,再计算每组包囊均数.取左肺上部分小块组织,10%甲醛固定,石蜡包埋,制成切片,经 HE 和 GMS 染色后观察.参照 Kim等[7]提供的方法,按所涉及的肺泡数确定 PC 感染的程度.
1. 5 统计学分析 实验数据用 x-± s 表示,组间数据结果分析采用单因素方差分析,使用 SPSS10. 0 统计学软件进行分析,P <0. 05为统计学差异显著.
2 结果
2. 1 大鼠体重及肺重 /体重的变化 地塞米松注射6 周后,pVAX-p55-v3 及 pVAX-p55-v0 免疫组体重增加,肺重( g) /体重( g) 明显降低( 0. 96 ± 0. 15/0. 83 ± 0. 14 vs 1. 59 ± 0. 32 /1. 68 ± 0. 38) ,P < 0. 05,而 pVAX-p55-v3 组与 pVAX-p55-v0 组无显著性差异( P >0. 05) .
2. 2 肺印 片 包 囊 均 数 比 较 pVAX-p55-v0 及pVAX-p55-v3 免疫组每视野包囊均数明显低于pVAX1 及 PBS 对照组( 0. 95 ± 0. 45、1. 75 ± 0. 98 vs5. 76 ± 1. 42、5. 90 ± 1. 03) ,P < 0. 05.从图 1A ~ C、d 亦可见 pVAX-p55-v0 及 pVAX-p55-v3 免疫组包囊数明显减少.
2. 3 肺组织病理学观察
2. 3. 1 HE 染色 pVAX-p55-v0 及 pVAX-p55-v3 免疫组肺切片( HE 染色) ,肺实变较对照组明显减轻,肺泡腔内渗出减少,见图 1E、F、G、H.
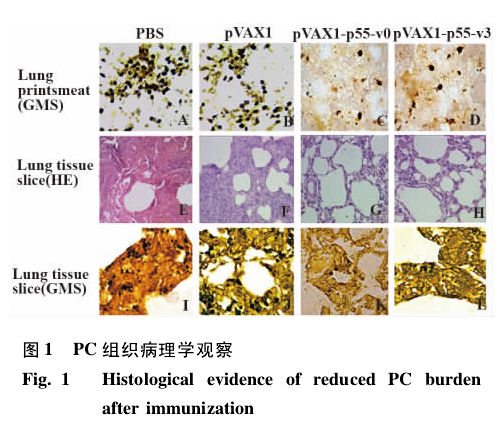
2. 3. 2 GMS 染色 采用 GMS 染色,PBS 及 pVAX1对照组 ( 图 1I、J) 肺切片可见被染成棕黑-黑色的PC 包囊散在或成堆地存在于肺泡腔中或贴在肺泡壁上,肺泡间质中亦可见少量包囊.而实验组包囊数量均明显减少( 图 1K、I) .
3 讨论
P55 是卡氏肺孢子菌细胞壁上的一种组分抗原.Smulian 等[1,3]克隆并鉴定了肺孢子菌 55 kD抗原基因( p55-v0) ,将重组 P55 抗原主动免疫大鼠后能够刺激机体产生体液和细胞免疫反应.Ma等[2]
分别克隆了 p55-v1 ~ v4 基因,比较发现 p55-v3和 p55-v0 基因 3‘端均为高度保守区域,但两者重复区域的氨基酸种类和数目存在差异; p55-v0 包含一个 N-连接糖基化位点和 RGD 连接位点而 p55-v3没有; 染色体杂交发现 p55-v3 位于第 4 染色体而p55-v0 位于第 2 染色体.本课题组前期成功构建pVAX-p55-v3 及 pVAX-p55-v0 DNA 疫苗,进一步免疫 SD 大鼠发现 p55-v0 具有部分免疫保护作用,与Smulian等[1]
及易亮衡等[8]的报道一致.同时亦观察到,与 p55-v0 相似,p55-v3 组虫体负荷明显减少,且 p55-v3 组病理切片可见肺泡间隔水肿明显减轻,炎症细胞减少,提示 p55-v3 同样能提供部分保护作用,这为后续进一步对 p55-v3 免疫保护作用机制研究提供基础,亦为 PCP 的防治提供一种新的方法和手段.
参考文献:
[1] Smulian AG,Sullivan DW,Theus SA. Immunization with recom-binant Pneumocystis carinii p55 antigen provides partial protectionagainst infection: characterization of epitope recognition associatedwith immunization[J]. Microbes and infection / Institut Pasteur,2000,2( 2) : 127-136.
[2] Ma L,Kutty G,Jia Q,et al. Characterization of variants of thegene encoding the p55 antigen in Pneumocystis from rats and mice[J]. J Med Microbio,2003,52( Pt11) : 955-960.
[3] Smulian AG,Theus SA,Denko N,et al. A 55 kDa antigen ofPneumocystis carinii: analysis of the cellular immune response andcharacterization of the gene[J]. Mole Microbiol,1993,7( 5) : 745-753.
[4] 冯燕梅,罗永艾,江 涛. 卡氏肺孢子菌 p55-v0 及 p55-v3 基因 CDS 区的克隆与序列比较[J]. 中国人兽共患病学报,2010,26( 3) : 235-238,242.
[5] 冯燕梅,罗永艾,江 涛,等. 卡氏肺孢子菌 pVAX-p55-v3 及pVAX-p55-v0 真核表达载体的构建及表达鉴定[J]. 中国免疫学杂志,2010,26( 3) : 214-217.
[6] 张 帆,卢思奇,王凤云,等. 卡氏肺孢子虫低死亡率 SD 大鼠动物模型的建立[J]. 中国寄生虫病防治杂志,2005,18( 2) : 99-102,F002.
[7] Kim CK,Foy JM,Cushion MT,et al. Comparison of histologicand quantitative techniques in evaluation of therapy for experimen-tal Pneumocystis carinii pneumonia[J]. Antimicrob Agents Che-mother,1987,31( 2) : 197-201.
[8] 易亮衡,陈金铃,秦永伟,等. 卡氏肺孢子虫 p55 基因片段DNA 疫苗的免疫原性研究[J]. 现代预防医学,2010,37( 13) :2506-2508.





