
类固醇激素是一类由胆固醇衍生而来的具有内分泌干扰效应的物质。环境中类固醇激素的主要来源包括人及脊椎动物的排泄、人工合成含类固醇激素药物的使用以及医院或制药厂废水的排放[1-4].人类来源的类固醇激素主要通过污水处理厂处理后排入水体,动物来源的类固醇激素主要通过粪便排泄进入环境体[5-7].由于这类物质具有较强的生物活性,一旦进入水体就可能对非目标生物正常的内分泌功能产生干扰。有报道表明,长期暴露在低浓度的类固醇激素下会对鱼类的生殖系统产生负面影响并导致雌性特征在雄性鱼中出现[8-9].
类固醇激素在环境介质中残留的准确测定是对其进行风险评价和污染防治的基础。目前类固醇激素的分析有气相色谱法、液相色谱法和酶联免疫分析法等[10-12].由于类固醇激素在环境中的浓度通常较低,通常需要对样品进行富集。目前主要采用的富集方法包括固相萃取(SPE)和固相微萃取法(SPME)[13-14].对于土壤及沉积物等固体样品中类固醇激素的测定还需通过溶剂提取。超声提取(USE),加速溶剂提取(ASE)都有运用[15-16].本文采样丹磺酰衍生化的方法提高类固醇激素的电离效率并结合固相萃取和加速溶剂萃取技术,建立了水体及土壤样品中类固醇激素准确、灵敏的检测方法。
1材料和方法
1.1仪器与试剂
Varian 1200LLC-MS/MS电喷雾(ESI)三重四级杆液相色谱质谱联用仪(Varian公司,美国)。Di-onex ASE200加速溶剂萃取系统(Dionex公司,美国)。Nova Pack C18(150×4.6mm,4μm)色谱柱(Waters公司)。ENVI-18(6mL,500mg)和LC-18(3mL,500mg)固相萃取小柱(Supelco公司)。
标准物质孕酮(progesterone),醋酸美伦孕酮(melengestrol acetate),雌酚酮(estrone),17α-雌二醇(17α-estradiol),17β-雌二醇(17β-estradiol),雌三醇(estriol)和17α乙炔雌二醇(17α-ethinylestra-diol)购于Sigma公司。内标物质氘代17β-雌二醇(17β-estradiol-D3)和氘代雌三醇(estriol-D2)购于C/D/N Isotopes公司。分析纯药品和色谱纯有机溶剂均购于Fisher公司。
1.2样品采集
地表水样品采自天然河道,用1L玻璃瓶保存,回实验室后过0.7μm玻璃纤维滤膜并在4 ℃储藏。表层土壤(0~20cm)样品采自一植物园内,冷冻干燥后过筛(<0.2cm)并在-20℃储藏。
1.3样品前处理
水样 用 固 相 萃 取 方 法 富 集。固 相 萃 取 小 柱(ENVI-18)先后用6mL丙酮和去离子水活化。取过滤后的水样200mL,调节pH值到7,加入40μL浓度为500μg/L的内标后过固相萃取小柱,流速约为10mL/min.随后用含20%丙酮的水溶液清洗。最后用6mL丙酮洗脱。洗脱液用高纯氮气吹干并进行衍生化。
土壤样品用加速溶剂萃取法萃取。取过筛的土壤样品5g,加入50μL浓度为500μg/L的内标,同硅藻土混合后装入11mL萃取管,两头用玻璃纤维滤膜密封。优化的萃取条件为:丙酮,温度60℃,压力1500psi,预 热5 min,加 热5 min,淋 洗 体 积60%,吹扫时间2 min,循环2次。萃取液稀释到200mL,然固相萃取方法进行净化和富集,方法同水样。
1.4衍生化用
100μL碳酸氢钠溶液(0.1mol并用NaOH调节pH值至10.5)溶解氮气吹干的样品,加入100μL丹磺酰氯(1mg/L溶解于丙酮)。震荡混合后置于60℃烘箱内,加热3min.取出样品,氮气吹干并用0.4mL甲醇溶解,转移到2mL样品瓶,储藏于-20℃待分析。
1.5仪器分析
色谱分析条件为:流动相A为0.1%甲酸水溶液,流动相B为乙腈,流量0.3mL/min.洗脱梯度为:0~5 min,流动相B由40%升至73%,5~25min,升至78%,25~27min升至100%,保持5min后降到40%并平衡6min.定量采用内标标准曲线法。
质谱为正离子模式,干燥气体温度300℃,屏蔽电压150V,针电压6 000 V,碰撞气体压力2.0mTorr.其他参数设置见表1.

2结果与讨论
2.1固相萃取过程优化
水体中类固醇激素的提取,我们比较了两种反相固相萃取小柱(ENVI-18和LC-18)的效率。反相吸附剂能够从水体中吸附非极性的物质而对极性物质的吸附能力较弱。本文所研究的目标物质均为弱酸(pKa>10),水体的pH值可能会影响固相萃取对目标物质吸附的效率。因此,我们对比了pH值为3和7时两种反相固相萃取小柱的回收率。结果显示两种固相萃取小柱在pH值为3和7时均能获得>80%的回收率(图1)。两种小柱和不同pH值的萃取效率无显著性差异。结果表明所研究类固醇激素极性较弱,即使在中性条件下仍以分子形式存在。考虑到酸性条件会增加水体中酸性物质的吸附,从而增加样品中基质含量[17],因此选取pH值为7作为固相萃取条件。此外,LC-18小柱在萃取过程中较易堵塞,从而降低流速,所以选择ENVI-18小柱进行进一步研究。


2.2溶液清洗优化
在用LC-MS/MS分析时,化合物的电离效率极易受到样品中基质的影响[18].为了减小基质效应,我们试图用一定比例的丙酮水溶液清洗固相萃取小柱。结果显示当丙酮含量不超过20%时不会对目标物质的回收率产生显著影响(图2)。因此,选择用含20%丙酮的水溶液清洗固相萃取小柱来净化样品。

2.3加速溶剂萃取优化
土壤中类固醇激素的分析需要先将目标物质从土壤中萃取出来。加速溶剂萃取技术是利用高温高压条件提高萃取效率。本文研究了不同溶剂和温度对萃取回收率的影响。结果表明丙酮比甲醇具有更好的萃取效率(图3)。高温条件通常可以提高萃取效率,但目标物质的回收率在100 ℃的回收率反而低于60℃。这可能是因为高温时,更多基质被引入样品,增加了基质的影响,也可能是在高温条件下,目标物质发生降解。根据结果,选择丙酮为萃取溶剂,60℃为萃取温度进行试验。
2.4衍生化过程优化
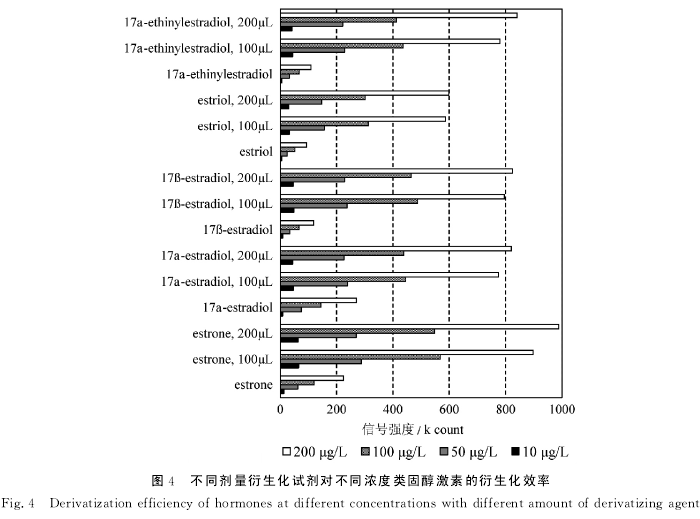
所选类固醇激素极性较弱,导致这些物质在ESI LC-MS/MS分析过程中电离效率较低从而影响到检测的灵敏度[19].通过丹磺酰衍生化反应引入极性基团可以大大提高电离效率从而提高检测的灵敏度。孕酮和醋酸美伦孕酮不具有活性基团,不发生反应。其他类固醇激素中的活性羟基中的氢被丹磺酰基取代。本文研究了衍生化试剂的用量以及类固醇激素的浓度对衍生化效果的影响。结果表明衍生化使得类固醇激素在仪器上的响应提高5~10倍(图4)。当类固醇激素的浓度低于100μg/L时,100μL衍生化试剂的效果略好于200μL衍生化试剂的效果。但当类固醇激素的浓度达到200μg/L时,200μL衍生化试剂的效果较好。这可能是因为在较低浓度时,100μL和200μL衍生化试剂均能到达较高的衍生化效率,但200μL衍生化试剂会引入 更多的杂质从而影响信号的强度。但在高浓度时,100μL衍生化试剂的衍生化效率可能不完全。考虑到环境中类固醇激素的残留浓度通常在ng/L量级,浓缩后也在几个到几十个μg/L量级,因此选取100μL衍生化试剂进行衍生化。
2.5线性关系和方法检出限
将标准品逐级稀释配置成浓度为1,5,10,50,100,200,500μg/L的溶液。在优化的条件下进行测定。通过对测得结果进行线性拟合,相关系数(r2)优于0.998(表2)。说明在所测浓度范围内,仪器相应与浓度呈线性关系。方法检出限为能产生3倍信噪比(s/n=3)的最小样品浓度。水体和土壤中目标物质的方法检出限分别为0.02~0.6ng/L和0.01~0.18ng/g(表2)。
2.6准确度和精密度
按照优化试验条件,将已知浓度的类固醇激素标准溶液加入200mL地表水样品中,进行加标回收率试验,试验重复三次。数据见表2,水体中平均回收率为77% ~97%,相对标准偏差为1.0%~6.0%.土壤中平均回收率为62%~119%,相对标准偏差(RSD)为0.8%~15.5%.试验数据表明该方法准确度与精密度均较好。与以发表的类固醇激素分析方法相比[19-20],本方法具有较高的分析灵敏度。
2.7空白和环境样品分析
环境水样采自武汉市区及周边的地表水体。土壤样品采自接受畜禽粪便改良的农田表层土。用去离子水和来自植物园的表层土做空白。按本方法分析。空白中未检测出目标物质。地表水样品中除醋酸美伦孕酮和17α-乙炔雌二醇外均被检出,总类固醇激素的浓度范围为5.8~42.5ng/L.土壤中检出17α-雌二醇,17β-雌二醇和雌酚酮,其浓度范围为0.2~2.8ng/g.
3结论
建立了水体及土壤中类固醇激素的液相色谱质谱分析方法。通过丹磺酰氯衍生化大大提高了分析方法的灵敏度。样品前处理过程的优化使得该方法具有较高的准确度和精密度。该方法适用于环境水体及土壤中类固醇激素残留的分析。

参考文献
[1]Richardson S D,Ternes T A.Water analysis:emerging contaminants and current issues[J].Analytical Chemistry,2005,77(12):3 807-3 838.
[2]Ying G G,Kookana R S,Ru Y J.Occurrence and fate of hormone steroids in the environment[J].Environment Interna-tional,2002,28(6):545-551.
[3]Servos M R,Bennie D T,Burnison B K,et al.Distribution of estrogens,17β-estradiol and estrone,in Canadian munici-pal wastewater treatment plants[J].Science of the Total Environment,2005,336(1-3):155-170.
[4]Chang H,Wan Y,Hu J.Determination and source apportionment of five classes of steroid hormones in urban rivers[J].Environmental Science and Technology,2009,43(20):7 691-7 698.
[5]Gabet-Giraud V,Miège C,Choubert J M,et al.Occurrence and removal of estrogens and beta blockers by variousprocesses in wastewater treatment plants[J].Science of the Total Environment,2010,408(19):4 257-4 269.
[6]Kolodziej E P,Harter T,Sedlak D L.Dairy wastewater,aquaculture and spawning fish as sources of steroid hormonesin the aquatic environment[J].Environmental Science and Technology,2004,38(23):6 377-6 384.





