
钾是人体内含量较高的元素之一,比钠的含量高两倍,钾参与细胞内糖和蛋白质代谢,维持神经肌肉的正常功能[1]; 有助于保持神经健康、心跳规律正常,并协助肌肉的正常收缩,预防中风[2].
如果钾代谢紊乱引起的高钾血症或低钾血症,得不到及时治疗,会导致全身各器官系统发生相应功能障碍,严重可致人死亡[3].钾也是植物生长所必须的矿质元素,能提高植株对氮的利用与吸收,促进植株茎秆健壮,增强植株的抗逆能力[4].钾元素含量测定的方法有很多,如重量法、火焰光度法、干化学法、比浊法[5]、离子选择电极法等,而离子选择电极法具有较高选择性和敏感性,测定时不受试液颜色、浊度等的影响,特别适于水质连续自动监测和现场分析。本实验采用浓度直读法测定钾含量,不用作图换算,方法更简便、迅速,有较大的推广应用价值。
1 实验部分
1. 1 仪器与试剂
PXSJ - 226 型离子计、PHSJ - 4ApH 计、217 -01 型参比电极、PK - 1 - 01 型钾离子电极等; 氯化钾、三乙醇胺、高氯酸、硝酸铵、过氧化氢; 新鲜的香蕉、草莓、橘子、菠萝四种水果; 所用水均为二次蒸馏水。
1. 2 方法
1. 2. 1 试验溶液的配制
钾标准溶液: 配成 1 mol/L 的钾标准储备溶液,再逐级稀释成 10- 1、10- 2、10- 3、10- 4、10- 5、10- 6、10- 7mol / L 的钾标准液; 饱和 Ba(OH)2溶液。
总离子调节缓冲溶液①: 取盐酸 10 mL,加入酚红指示剂 1 滴,用三乙醇胺(TEA) 调节溶液变微红(约 20 mL) ,用水稀释定容至 250 mL 容量瓶,测定pH = 7. 86.
总离子调节缓冲溶液②: 取硝酸 10 mL,加酚红指示剂 1 滴,用三乙醇胺 (TEA) 调制溶液变微红 (约 15. 5 mL) ,用水稀释,定容至 250 mL,测定 pH =7. 79.
总离子调节缓冲溶液③: 取高氯酸 10 mL,加酚红指示剂 1 滴,用三乙醇胺 (TEA) 调制溶液变微红 (约 18 mL) ,用水稀释,定容至 250 mL,测定 pH =7. 23.
1. 2. 2 试样的处理
本实验采用湿法消解,经试验比较筛选出硝酸- 过氧化氢消解体系最佳配比及最佳处理条件。
香蕉试样: 取新鲜香蕉3. 48 g 加入1 mol/L 硝酸9 mL 和3 mL 30%过氧化氢,加入适量水,常温下搅拌,26 h 后,在 60 ℃ 加热搅拌,2 h 后溶液澄清透明,冷却到室温,用饱和氢氧化钡调节 pH值 6. 0 ~9. 0,转移到 100 mL 容量瓶,用水定容。
草莓试样: 取新鲜草莓4. 73 g 加入1 mol/L 硝酸 10 mL 和 3 mL 30% 过氧化氢,加入适量水,常温下搅拌,16 h 后,在 50 ℃ 加热搅拌,1 h 后溶液澄清透明,冷却到室温,用饱和氢氧化钡调节pH6. 0 ~ 9. 0,转移到 100 mL 容量瓶,定容。
橘子试样: 取新鲜橘汁 3 mL 加入 1 mol/L 硝酸5 mL 和2 mL 30%过氧化氢,加入适量水,常温下搅拌,8 ~10 h 后溶液澄清透明,用饱和氢氧化钡调节 pH 值 6. 0 ~ 9. 0,转移到 100 mL 容量瓶,定容。
菠萝试样: 取新鲜菠萝3. 14 g 加入1 mol/L 硝酸7 mL 和3 mL 30%过氧化氢,加入适量水,常温下搅拌,22 h 后,在 60 ℃加热搅拌,2 ~4 h 后溶液澄清透明,冷却到室温,用饱和氢氧化钡调节pH 值 6. 0 ~ 9. 0,转移到 100 mL 容量瓶,定容。
1. 2. 3 试样测量方法
量取 30. 00 mL 配制好的待测溶液于小烧杯中加水至 50. 00 mL,加入总离子调节缓冲溶液 (TI-SAB) 5 mL,磁力搅拌 30 s,待其电位值稳定后直接读取溶液浓度数值。
2 实验结果与讨论
2. 1 最佳总离子强度调节缓冲溶液 (TISAB) 的选择
三种总离子强度调节缓冲溶液 (TISAB) 的比较为了比较三种总离子强度调节缓冲溶液 (TIS-AB) 的能斯特线性关系,取一系列浓度的钾标液(10- 1~ 10- 7mol / L) 各 50. 00 mL 于小烧杯中,分别加入不同种类的总离子强度调节缓冲溶液 5 mL,搅拌 30 s,由低到高依次测其电位值,待稳定后进行记录。实验结果见表 1.
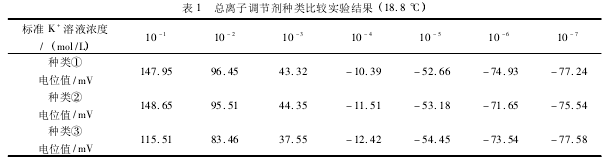
由结果得出,用总离子调节缓冲溶液①,数据更符合能斯特线性关系,用总离子调节缓冲溶液③,线性 关 系 最 差,原 因 是 ClO4-与 K+生 成KClO4,而 KClO4在水溶液中溶解度较低,使溶液中钾含量降低。故实验皆采用总离子调节缓冲溶液①。
2. 2 最佳总离子强度调节缓冲溶液 (TISAB) 用量的选择
取浓度 10- 1~ 10- 7mol / L 的 K+标准溶液各50. 00 mL 于小烧杯中,分别加入总离子调节缓冲溶液 5 mL 与 10 mL,磁力搅拌 30 s,由低到高顺序测其电位值,稳定后进行记录,实验结果见表2.
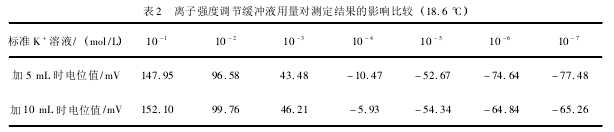
实验表明: 加入 5 mL 总离子调节缓冲溶液, 数据更符合能斯特线性关系,故实验应选用加入 5mL 总离子调节缓冲溶液。
2. 3 K+离子选择电极适宜的酸度
取 7 份10- 3mol / L K+标准溶液各50. 00 mL 于小烧杯中,各加入总离子调节缓冲溶液 5 mL,用0. 1 mol / L 盐酸与饱和氢氧化钡溶液调节溶液 pH值为 5. 0 ~11. 0,搅拌 30 s,电位值稳定后,直接读取溶液浓度,实验结果见图 1.
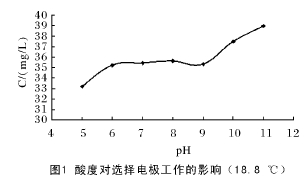
由图可见在 pH 为 6. 0 ~ 9. 0 时,所得实验数值比较稳定,所以 pH6. 0 ~9. 0 为 K+离子选择电极的最佳适用范围,本文中测量均在 pH 6. 0 ~9. 0 范围内进行。
2. 4 K+离子选择电极的工作曲线
取 10- 1~ 10- 7mol / L K+标准溶液50. 00 mL 于小烧杯中,加入离子强度调节缓冲溶液 5 mL,磁力搅拌 30 s,由低浓度到高浓度顺序测其电位值,待电位值稳定后,记录电位值与浓度值,绘制 mV~ lgC 的标准曲线图,实验结果见图 2.

根据图 2 得出: 当被测离子浓度降低到一定程度时,离子选择性电极的电极电位的变化越来越小,开始渐渐偏离能斯特方程,直至无电位变化为止。
浓度为 10- 6、10- 7mol / L 的 K+标准溶液,其电位值分别为 -74. 93 mV 和 -77. 24 mV,在标准曲线上有较大偏差,弃掉。在 10- 1~ 10- 5mol / L 范围内钾离子选择电极线性比较较好,以 10- 1~ 10- 5mol / L 的标准溶液的数据绘制标准曲线。经回归分析,标准曲线的方程为 y = 52. 497x -38. 163,相关系数 R2= 0. 998 6.根据国际纯粹与应用化学联合会的推荐,计算得出检测限为 0. 216 mg/L.
2. 5 干扰离子选择性系数测定
理想的钾离子选择电极应该只与 K+离子产生电位响应,但事实上,待测液中的其他共存离子也能影响电极的膜电位,特别是干扰离子浓度较高时。
水果试样中存在的其他离子,在浓度高的条件下也会对实验测量结果产生影响,试样或试剂中对钾离子选择电极有干扰的离子主要有 NH4+、Na+、Ca2 +、Ba2 +,对这些干扰离子选择性系数进行了测定。
取10- 2mol / L K+标准溶液和10- 2mol / L NH4+溶液各 50. 00 mL 于小烧杯中,分别加入总离子强度调节缓冲溶液 5 mL,搅拌 30 s,待电位值稳定后记录数据。根据公式 [6],可计算 NH4+对 K+选择电极的选择系数。同上方法可依次测出 Na+、Ca2 +、Ba2 +的离子选择性系数,结果见表 3.
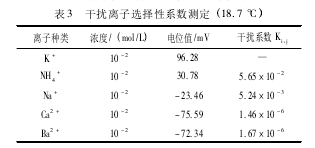
由实验数据可知,NH4+、Na+、Ca2 +、Ba2 +对钾电极测定的总体上影响都很小,但相比较而言NH4+、Na+对钾电极的干扰略大,分别为 5. 65 ×10- 2与 5. 24 × 10- 3,在浓度大时会对实验数据测定有一定的影响,因此本实验中要严格试剂使用,以免引入 NH4+、Na+等干扰离子,影响实验结果。
2. 6 电极响应时间与稳定时间
电极响应时间指将电极插入到试液后达到稳定的电位所需的时间。取 10- 2mol / L K+标准溶液50. 00 mL 于小烧杯中,加入总离子强度调节缓冲溶液 5 mL,搅拌 30 s 后,在电极进入试液时开始计时,并记录电位值,结果见表 4.
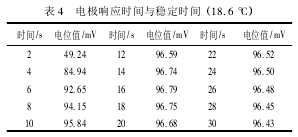
同上方法可测出 10- 5、10- 4、10- 3mol / L K+标准溶液中电极响应时间与稳定时间。由实验数据分析,钾离子选择电极在 K+浓度 10- 2~ 10- 4mol /L 时电极 响应时间不超过 18 s,K+浓度在 10- 5mol /L 时电极响应时间不超过 30 s.对其稳定时间测定,在电极响应后,2 min 内电位值能基本保持稳定 (数值变化≤ ±2 mV) .总体看来使用离子选择电极检测待测离子浓度,响应时间短、稳定性好。
2. 7 浓度直读法与标准曲线法比较
取 10- 1、10- 2、10- 3、10- 4、10- 5mol / L 的钾标准溶液各 50. 00 mL 于小烧杯中,加入离子强度调节缓冲溶液 5 mL,搅拌 30 s,浓度由低到高顺序进行测量,电位稳定后分别使用标准曲线法、浓度直读法测定溶液浓度,结果见表 5.
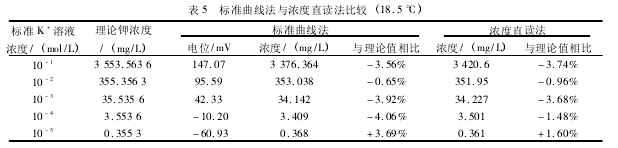
实验发现,浓度直读法与标准曲线法相比精确度相似,大约 -4. 06% ~3. 69%,但浓度直读法不用换算更加简便、快捷,并可以避免由于在电位值读取过程中的人为误差。
2. 8 样品测量分析
量取 30. 00 mL 配置好的待测溶液于小烧杯中加水至 50. 00 mL,加入总离子调节缓冲溶液 (TI-SAB) 5 mL,磁力搅拌 30 s,待其电位值稳定后直接读取溶液浓度,测试结果见表 6.
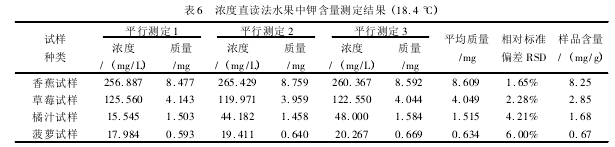
在水果试样测量过程中随钾离子含量的增加,所测数据的相对标准偏差逐渐减小,准确度相应提高。
2. 9 回收率测定
称取草莓试样 0. 942 2 g 分别于1、2、3、4 号烧杯中,同 1. 2. 2. 试样的处理中草莓法相同操作,加入总离子调节缓冲溶液 (TISAB) 5 mL,搅拌 30s,待电位值稳定后,读取浓度。再向 1、2、3、4烧杯中分别加入适量氯化钾固体,磁力搅拌 30 s后,待电位值稳定后,直接读取待测离子浓度,测试结果见表 7.

由实验可知,浓度直读法测量钾含量的回收率为 94. 59% ~100. 7%,回收率高,准确度好。
3 结论
钾离子选择电极干扰小,选择性好,钾离子选择电极在 K+浓度 1 ×10- 2~ 1 × 10- 4mol / L 时电极响应时间不超过 18 s,K+浓度在1 ×10- 5mol / L 时电极响应时间不超过 30 s,响应时间快,稳定性好。浓度直读法精确度与标准曲线法相近,且浓度直读法比标准曲线法更加简便、快捷,可以避免在电位值读取过程中的人为误差,准确度高,回收率为 94. 59% ~100. 7%,是测定钾较为理想的方法。
参考文献:
[1] 乔国强,姜旭华。 酶法和离子选择电极检测血清钾的比对分析 [J]. 检验医学与临床,2012,9 (7) : 859- 860.
[2] 蔡楷钰,刘秀贞,张晓芝,等。 潮州江东萝卜干营养成分分析及亚硝酸盐的含量检测 [J]. 江西化工,2010 (4) : 29.
[3] 金有余,郑铁生。 临床生化检验 [M]. 南京: 海洋出版社,1993 : 203 -204.
[4] 陆景陵。 植物营养学 [M]. 北京: 中国农业大学出版社,1994: 37 -43.





