
肿瘤干细胞是存活在肿瘤中的极少量的一类细胞,目前已从乳腺癌、脑瘤、前列腺癌、肺癌、肝癌、结直肠癌、皮肤癌等多种恶性肿瘤中成功分离出了肿瘤干细胞,它与癌症的耐药和复发密切相关.随着对肿瘤干细胞的深入研究,人们越来越重视杀死肿瘤干细胞对肿瘤治愈的重要性.在肿瘤干细胞中发现了 Notch 的异常表达和扩增,表明 Notch 信号通路在肿瘤中发挥着重要的作用,为人们以后开发针对 Notch为靶点的新的抗癌药物提供了理论基础,有望研发具有不耐药和不易复发的抗肿瘤药物.
1 肿瘤干细胞和干细胞
2001 年正式提出肿瘤干细胞( CSC / TSC) 的概念,该理论认为肿瘤中只有很小一部分细胞具有引起肿瘤发生、维持、增殖和保持异质性的能力[1].早在 20 世纪 70 年代,研究者发现小鼠腹水中的骨癌细胞只有 1% ~4%可以克隆,推测这些细胞可能就是骨髓瘤干细胞.现有的肿瘤治疗方案认为所有的肿瘤细胞都能无限增殖,尽可能杀死所有肿瘤细胞达到治疗效果,但预后都很差,大部分肿瘤都会复发,根据肿瘤干细胞假说,传统的方法并没有杀死所有的肿瘤干细胞,故仍有复发的潜能,近年来肿瘤干细胞学说越来越受到关注,很多学者开始支持癌症的治疗应该主要针对肿瘤干细胞,肿瘤对放射治疗与化疗药物治疗不敏感的原因可能是肿瘤干细胞的存在[2-4],所以肿瘤治疗的焦点是杀伤肿瘤干细胞[3-7],认为杀死肿瘤干细胞后,肿瘤的增殖及复发能力会大大降低[8-9].
干细胞是体内具有定向分化能力和分裂能力的细胞,肿瘤干细胞和干细胞有很多相似之处,如两者都有端粒酶高表达性,能无限增殖,这是与一般细胞最明显的区别.但干细胞与肿瘤干细胞有本质的区别,干细胞根据反馈机制自我更新、增殖和分化有序; 而肿瘤干细胞的增殖分化无序、失控,不能分化成为成熟细胞,且增殖很不稳定,肿瘤干细胞在复制的过程中发生错误后不能像干细胞那样自身会纠正错误的发生.相反,所有的错误都会累计,因此肿瘤干细胞的存在可能是肿瘤恶变的原因.由于一般已经分化的细胞转变成肿瘤细胞,需要多次突变,才能无限增殖,而干细胞已经具有这种能力,故干细胞的突变很容易积累,干细胞发生基因突变后很可能会成为肿瘤干细胞.在人类干细胞的恶性转化实验中发现,端粒酶活性和附加基因突变是正常干细胞恶性转化的 2 个重要条件[1].
由于肿瘤干细胞与干细胞十分相似,对肿瘤干细胞具有杀伤作用的治疗手段可能会影响到正常的干细胞.如果采用的治疗手段不合适,有可能引发严重的副作用.研究发现,一些与肿瘤相关的信号调节通路同时调节正常干细胞,如 Notch,Hedgehog,Wnt 信号通路,但这些通路在肿瘤干细胞中表达异常,如 Notch 在许多肿瘤干细胞中过度表达[10],因此 Notch 信号通路可作为癌症治疗的新通道.研究发现,目前作用于 Notch 信号通路的药物大多数都呈剂量依赖性,而肿瘤干细胞上的 Notch 信号通路由于失调而异常高表达,充分研究量化差异,调整剂量以活动最佳疗效而无毒性,实现特异性针对肿瘤干细胞的目的.
2 Notch 信号通路
2. 1 Notch 信号通路结构
Notch 信号通路包括 Notch 受体,Notch 配体,CSL 及DNA 结合蛋白调节分子.哺乳动物中有 4 个同源 Notch 受体和 5 个同源配体.
Notch 受体是一种单通道跨膜蛋白,从海胆到人类,进化上都具有高度保守性.所有的同源 Notch 受体均由胞外区( NEC) 、跨膜区( NTM) 和胞内区( NICD/ICN) 组成.胞外区有 29 ~36 个表皮生长因子样重复序列,主要功能是和配体结合并启动 Notch; 跨膜区( NTM) 启动 Notch 信号通路[10],经由突变型早老素( presenilin) 蛋白等水解作用,生成胞内区ICN 和一个短的跨膜片段; 胞内区( NICD) 主要包含 5 个部分,包含 1 个 N 端 RAM 结构域、6 个锚蛋白样重复序列、2 个核定位信号、1 个转录激活区及 1 个 PEST 结构域,胞内区负责将 Notch 信号转到细胞核内.
Notch 同源配体具有数量不同的表皮生长因子样重复序列,同源配体有 2 类: Delta 样配体,分别为 Dll-1、Dll-3、Dll-4; Serrate 样配体,分别为 Jagged-1 和 Jagged-2[10].保守的 N端为 Notch 受体结合和活化所必需的 DSL 基序.
2. 2 Notch 信号通路作用机制
Notch 信号通路的激活需要经过三步酶切过程.首先在细胞内,内质网内合成的受体蛋白单链前体分子在高尔基体内被 furin-like 蛋白酶酶切,酶切形成 ECN 和 NTM 2 个片段,两者以 Ca2 +依赖性的非共价键形成二聚体形式,转运至细胞表面形成成熟 Notch 受体,与 Notch 配体结合后,被 ADAM 金属蛋白酶家族的 ADAM 10/Kuz 或 ADAM 17/TACE 切割为2 个片段,释放部分胞外片段,粘连在细胞壁上剩余的部分( NTM) 被早老素依赖性的 γ-分泌酶水解,形成可溶性 NICD并转移至核内.进入细胞核后与转录因子 CSL 结合,形成NICD / CSL 转录激活复合体,激活 HERP、HES、HEY 等转录抑制因子家族的靶基因,从而发挥作用( 图 1) .
Notch 信号通路信号传导还通过其他途径发挥作用,调节 Notch 靶基因转录编码 HES 和 HE 等碱性螺旋-环-螺旋( bHLH) 家族转录因子,这些转录因子诱导下游基因表达,从而促进细胞增殖和抑制细胞分化.相邻细胞可以通过 Notch受体与配体结合后传递信号,以扩大并固化细胞间的分子差异,决定细胞的命运,这也是干细胞发育成不同器官和形态的重要调控途径.
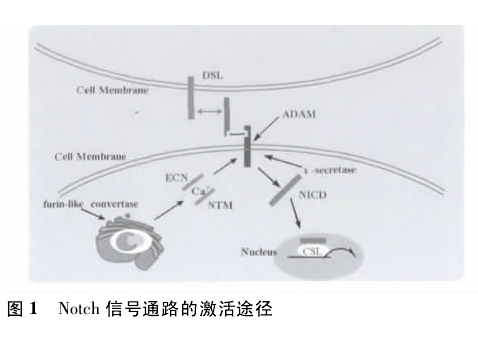
3 Notch 信号通路与肿瘤干细胞
肿瘤干细胞是癌组织中数量较少的能自我更新、具有分化潜能的一类细胞,这类细胞具有干细胞特征,推测这类细胞能导致癌症的复发和对抗癌症的放射治疗.干细胞的失调可能是造成肿瘤早期形成的主要原因之一.目前已知有许多路径可以调控干细胞的自我更新[10],其中包含 Notch 路径.Notch 在肿瘤中的作用最近已经受到高度重视,它在控制细胞发育的分子通路中扮演着重要的角色,表达异常时导致肿瘤的发生.激活 Notch 通路促进肿瘤增殖、转移,而阻断该通道可使肿瘤干细胞凋亡,对药物的敏感性增加,Notch 信号通路上的基因可以成为潜在的癌症治疗靶点[11].
3. 1 Notch 与脑瘤干细胞多形性胶质
母细胞瘤是成人脑瘤中最具有侵袭性的一类,预后极差,死亡率高,且易复发.研究者应用分离正常神经干细胞的方法自人脑肿瘤中鉴定出细胞表面标志为CD133+的具备明显增殖、自我更新及多向分化能力的肿瘤干细胞,仅需 100 个该细胞就能癌症移植成功[12],证明多形性胶质母细胞瘤的复发主要与肿瘤细胞的亚型-胶质母细胞瘤干细胞( GSLCs) 密切相关,这类细胞在肿瘤的发展、侵袭和耐药性起关键作用[2].在恶性脑瘤中的 GSLCs 中,Notch信号通路发挥了重要作用,Notch 受体和配体及调控基因,包括 Hes 和 Hes 相关蛋白家族,在多形性胶质母细胞瘤都有过度表达.已经证明 Notch 信号通路过度表达促进肿瘤增长,而阻断 Notch 信号通路则抑制肿瘤的增殖[13].因此,Notch信号通路是治疗脑肿瘤的很有前景的途径,特别是对多形性胶质母细胞瘤.Arsenic trioxide ( ATO) 是 FAD 批准的治疗急性早幼粒细胞性白血病的药物,它能透过血脑屏障,在脑中的分布浓度高,能杀死肿瘤细胞而对正常胶质细胞无杀伤作用,最新研究发现,ATO 可以通过抑制 Notch 信号通路,强烈抑制肿瘤细胞的增殖和复发[5,13],ATO 可能成为治疗脑瘤的很有前景的药物.
3. 2 Notch 与乳腺癌干细胞
从人的乳腺癌组织或胸水转移癌细胞中分离出表面标志物为 CD44+/ CD24-/ low 的乳腺癌干细胞能形成与原肿瘤类似的瘤灶,即使只有 200 个,也能形成移植瘤[14],而非干细胞型乳腺癌细胞不能形成移植瘤灶.有证据表明[15],CSCs 在乳房癌的发生、发展、转移和耐药性中发挥了重要作用.研究表明[16],这些肿瘤干细胞可能是从正常乳腺干/祖细胞或上皮-间充质细胞转换成的乳腺上皮细胞发展而来.
乳腺癌干细胞的特征为干细胞相关信号通路被激活,特定的干细胞标志物过表达,如 CD44,EpCAM 和 ALDH1.由于肿瘤干细胞对化疗有高度对抗性,研发针对 CSCs 的药物对乳腺癌患者是必须的.Patrawala 等[17]采用 RT-PCR 发现从MCF-7 乳腺癌细胞系中分离出的肿瘤干细胞表达更高水平的 Notch-1,这些结果提示,Notch 信号可能参与调节乳腺癌干细胞的自我更新.在乳腺肿瘤干细胞和非干细胞型乳腺癌细胞之间保持着一个平衡,有迹象表明,非干细胞型癌细胞可以转化为肿瘤干细胞,所以对于乳腺癌的治疗应结合以CSCs 为靶点和常规的以大部分肿瘤细胞为靶点的化疗法,以避免肿瘤干细胞的再生[13].
3. 3 Notch 与肺癌干细胞
研究发现,表面标志物为 CD133+/ CD34+/ CD117+的肺癌干细胞存在于多种类型的肺癌中,包括小细胞肺癌和非小细胞肺癌,而正常肺组织几乎没有表达.CD133+肺癌干细胞可以分化为与肺癌表型一致的子代细胞,它具有很强的致癌性,104 个细胞就可以致癌[18].CD133+肺癌干细胞具有耐药性,对传统的肺癌化疗药物( 顺铂、足叶乙苷、紫杉醇、吉西他滨) 都有不同程度的耐药性.肺癌干细胞高表达 Notch信号通道,在体外可分化成肿瘤干细胞和肿瘤细胞[19].在异种移植实验中发现,高表达 Notch 信号通道的肺肿瘤干细胞对化疗有对抗性,而使用 γ-分泌酶抑制剂时,Notch 信号通路的下游信号表达下降,肿瘤细胞停止繁殖.对一组肺癌患者的调查中,发现临床预后不良与 Notch 活性高( 反映在Notch 配体的高表达或者负反馈信号降低) 密切相关[4].
3. 4 Notch 与造血系统肿瘤干细胞
目前研究较为深入的肿瘤干细胞是白血病干细胞( LSC) ,白血病是公认的白血病干细胞引起的恶性肿瘤.
1994 年首次通过特异质细胞表面标志 CD34+/ CD38-分离出了人急性粒细胞 LSC[20],发现 LSC 具有无限的自我更新、维持其恶性显性的作用,证实了造血系统肿瘤干细胞的存在.目前已报道的 LSC 细胞表型特征有 CD34+、CD38-、CD71-、HLA-DR-、CD90-、CD117-、CD123+、CD96+、CLL-1+等.Mark 等[21]发现 LSC 中的 Notch 信号通路过度活化,激活 Notch 信号通路引起造血细胞和 T 细胞祖细胞的增殖,激活沉默的干细胞,它们在 Cre 重组酶诱导产生的造血干细胞得到了同样的结果,在该条件性转基因模型中,发现 Notch信号通路高度活化.
3. 5 Notch 与肝癌干细胞
肝癌是全球五大癌症之一,预后很差.研究者分别在 8种肝癌细胞系中进行了 CD90+比较,发现绝大多数细胞系不表达 CD90+,很少量的表达 CD90+的肝癌细胞为肝肿瘤干细胞.已经成功的从肝癌细胞中分离出特异质表面标志CD90 / CD133 的肝肿瘤干细胞( HCCs)[22],越来越多的证据表明肝癌中存在肝癌干细胞[23-24].Notch 信号通路在肝肿瘤干细胞的自我更新和分化中扮演着重要的角色,在肝癌组织中 Notch3 和 Notch 配体 Jagged 都有高表达[25].但有文献[26-27]报道,Notch1 对肝肿瘤的抑制起着重要的作用,在体内和体外 Notch1 过度表达抑制肿瘤的增殖和诱导肿瘤细胞的死亡,这也为开发针对以 Notch 为靶点的药物必须考虑其亚型做出了警示.
3. 6 Notch 与前列腺癌干细胞
前列腺癌是男性中最高发的癌症,在美国死亡率位居第二,严重影响人们的健康[28].在前列腺癌中发现只有表面有特异质标志 α2β1hi/ CD133+CD44-的细胞具有自我更新能力[29],这些细胞具有很强的繁殖能力,只要 100 个就能在小鼠体内形成特异质移植瘤,其特性与干细胞相似推测是前列腺干细胞[30],它们与前列腺癌的耐药性和复发密切相关.
据报道[6],Notch 信号通路在前列腺癌的增殖中起着重要的作用,在体外和体内模型实验中发现,化疗后存活的前列腺癌细胞中的一类亚型表面缺乏分化信号,且 Notch 信号通路过度表达[31],尤其是 Notch 3 受体和靶基因 Hes 4 和 Hes6[32],实验发现 SiRNA 下调 Notch1 诱导前列腺癌细胞凋亡,抑制肿瘤细胞的迁移和侵袭,Notch1 下调或失活可能是治疗前列腺癌一种有效的方法[7].
3. 7 Notch 与胰腺癌干细胞
胰腺癌是一种高致死性癌症,治愈率极低且术后极易复发.研究发现,由于胰腺癌细胞中存在表面标志物为 CD44/CD24 / EDA 的少量亚型,具有极高的致癌性,至少是普通癌细胞的 100 倍,这些细胞具有干细胞自我更新的能力,能分化增殖,证明是胰腺癌干细胞[33].Notch 信号通道在胰腺癌的发生和发展中过度表达,Notch 1 诱导胰腺癌细胞的增殖、克隆和迁移[34],在小鼠胰腺癌中敲除 Notch2 时,小鼠的存活率显著增高[35].
据报道,Notch 信号通道在子宫肌瘤,结肠癌,肾癌急性髓细胞霍奇金淋巴病等也有异常表达或激活[36].
4 作用于 Notch 信号通路的阻断剂
Notch 信号通路被认为是治疗肿瘤的一个潜在靶点,在多种器官中 Notch 信号通路高表达促进细胞增殖,而低表达促进分化,在细胞 G0/ G1通过阻断 Notch 信号通路杀死分化的肿瘤细胞和 CSCs,或促进 CSCs 的分化,使肿瘤干细胞不能无限增殖,抑制肿瘤形成.
目前 Notch 信号通路抑制剂主要包括 2 种类型,一种是选择性的,一种是非选择性的.其中选择性阻断剂以生物制剂为主,包括应用反义 RNA、干扰 RNA 和单克隆抗体,暂时还没有作用于受体的小分子选择性抑制剂的报道.而非选择性抑制剂包括配体封闭剂、γ-分泌抑制剂和一些天然产物.
选择性抑制剂特异性强,副作用小,不易产生耐药性.相比之下,非选择性抑制剂的毒性更高,但由于肿瘤细胞表达不止一种 Notch 受体,故非选择性抑制剂在某种情况下可能更有临床价值.
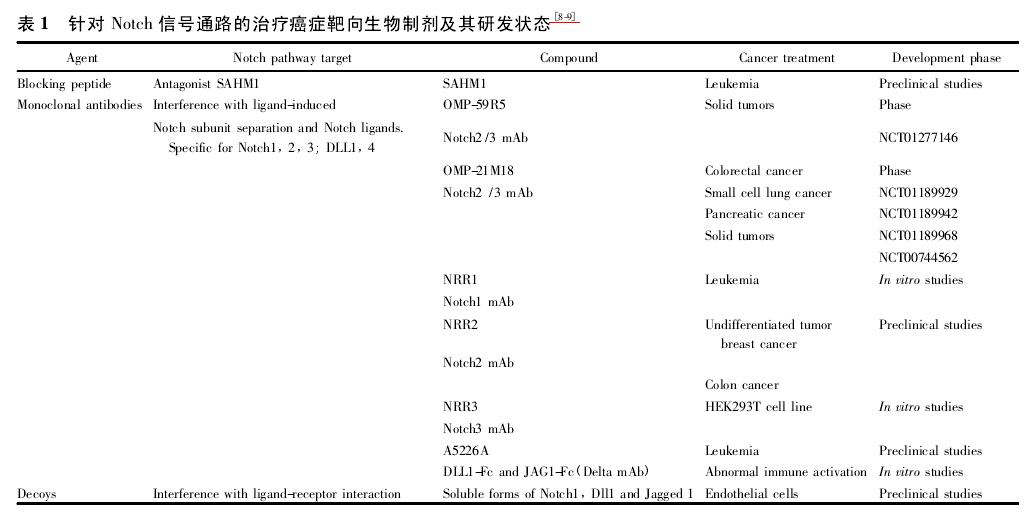
4. 1 针对 Notch 信号通路的治疗癌症靶向生物制剂.
4. 1. 1 封闭肽 哈佛大学的科学家设计了由烃类组成的肽SAHM1,很有希望成为 Notch 拮抗剂,该分子在小鼠模型中有效抑制白血病的发展.研究人员对转染白血病的小鼠腹腔每日 1 次注射 SAHM1 ( 35 mg·kg- 1) 或每日 2 次量SAHM1( 30 mg·kg- 1) ,发现 5 d 以后,未进行治疗的小鼠的病情渐进性发展,每日治疗 1 次的小鼠病情发展相对减慢,而 1 d 2 次量的小鼠肿瘤发展大大降低,证明了该多肽对肿瘤治疗呈剂量依赖性.为证明 SAHM1 治疗肿瘤是通过抑制过度表达的 Notch 信号通路,研究者通过观察基因 Hey1,Hes1,Myc,Dtx1 等,发现这些基因在注射 SAHM1 的小鼠体内肿瘤细胞中有明显下降,基因谱还证明了 SAHM1 能抑制Notch 的转录程序,这些实验都证明了在小鼠体内 SAHM1 治疗白血病是直接通过 Notch 通路发挥作用[37].
4. 1. 2 单克隆抗体 目前正在研发针对阻断 Notch1、2、3 的单克隆抗体,有 2 类正在开发,一类是针对胞外区,阻断 AD-AM 蛋白酶的裂解,另一类是干扰配体诱导的 Notch 亚基和Notch 配体结合.主要的化合物有 Notch2 /3 单抗 ( OMP-59RS,奥康制药开发) ,用于治疗实体癌; Notch1 单抗( NRR1,Genentech and Exelixis 公司开发) ,用于治疗乳腺癌,结肠癌,白血病[38-39]; Notch2 单抗( NRR2,Genentech and Exelixis 公司开发) ,用 于 治 疗 乳 腺 癌,结 肠 癌 等[39]; Notch3 单 抗( NRR3,Genentech 公司) .通过体内和体外实验发现人源性单抗 OMP-59R5 能有效的阻断 Notch2 和 Notch3 信号通道,目前被开发成转移或复发实体癌患者化疗临床前给药;某些单抗通过阻断受体-配体复合物水解来阻断 Notch3 信号通路[40].Notch 配体的封闭抗体也正在开发中,OMP-21M18( DLL4 单抗,奥康制药开发) 用于治疗大肠癌,小细胞肺癌,胰腺癌和实体癌等[41]; DLL1-Fc 和 JZG1-Fc( Delta 单抗) 体内研究发现对自身免疫性脑脊髓炎有效; 最近发现一种新型的单克隆抗体 A5622A 能细胞外竞争性阻断 Notch 的启动而具有抗癌作用[42].
4. 1. 3 Decoys Decoys 是一种细胞外 Notch 水溶性配体,可与内源性配体竞争性结合 Notch 受体,从而阻断 Notch 信号通路,它也作为泛酶抑制剂降低 Notcch2 和 Dll1、Dll4、Jag-ged1 的活性,抑制肿瘤的生成和增殖.另一种非经典的Notch 配体是 EGFL7,它与 Notch 的 4 种受体结合,抑制神经干细胞更新[43]和降低原发性内皮细胞中的 Notch 活性[44].
Decoy 因为在实体癌的生物分布比单抗好,可能成为很有吸引力的候选药物.目前针对 Notch 信号通路的治疗癌症靶向生物制剂及其研发状态,见表 1.
4. 2 γ-分泌酶抑制剂.
γ-分泌酶( γ-secretase) 是复杂的高相对分子质量的多亚基复合体,能水解多种 I 型跨膜蛋白,是 Notch 信号通路中的关键酶.γ-分泌酶水解 Notch 受体变构体,直接释放出具有活性的 NICD,从而发挥作用.
过去人们对 γ-分泌酶抑制剂( gamma secretase inhibitor,GSI) 的研究主要是集中在阿尔茨海默病的治疗.近年来,人们逐渐发现 GSI 对多种恶性肿瘤具有明显的抗肿瘤作用.GSI 可特异性的抑制 γ-分泌酶的活性,减少 NICD 的释放,从而抑制 Notch 通路的活化[7].研究表明,GSI 对一些 Notch表达异常的肿瘤具有明显的抗肿瘤作用,如黑色素瘤、卡波氏肉瘤、髓母细胞瘤及大肠癌等[45-46].然而,由于缺乏以Notch 为底物的 γ-分泌酶高通量筛选实验,限制了专门针对Notch 信号通路的 GSI 的识别和开发.
DAPT( LY-374973) 是新型 GSI[47],目前临床上主要用于阿尔茨海默病,但研究发现它在抗肿瘤方面有潜在作用,DAPT 能抑制胶质瘤干细胞的生长和增殖.DAPT 降低多形性胶质母细胞瘤干细胞的数量和功能,连续对细胞表面表达CD133 + 的胶质瘤干细胞给予5 dDAPT,与对照组相比,肿瘤干细胞的数目显著降低,CD133+肿瘤干细胞下降了 84%,并且观察发现下降率相对稳定( 48% ~ 53%)[48].Ke 等[49]评价了联合化疗对 DAPT 抑制多种胶质肿瘤干细胞( T3359,T4105 和 T4302T4302CD133+) 的影响,证明辐射后使用Notch 抑制剂能显著提高 GSI 对肿瘤干细胞的抑制作用.此外研究 DAPT 对其他肿瘤干细胞的作用,发现使用 DAPT 在48 h 内就可以抑制小鼠骨髓瘤细胞和人体骨髓瘤细胞 Notch信号通路,在小鼠体内实验中观察到,使用 DAPT 的骨髓癌诱导小鼠模型的体内未发现骨髓瘤[50].DAPT 还可以在不影响正常细胞的情况下,抑制非小细胞肺肿瘤干细胞的增殖和迁移[51].DAPT 特异性强,在有效治疗范围内不引起毒副作用,因而是一个具有应用前景抗肿瘤药物.
默克公司开发的选择性 GSI MRK-0752 已经进入一期临床,在对阿尔茨海默病临床试验中发现其不良反应是抑制 Notch 复合体水解[52-53],这对开发针对肿瘤干细胞的药物提供了很好的思路.研究发现,MRK-0751 可以通过抑制 Notch 信号通道减少小鼠乳腺癌干细胞,这在对晚期乳腺癌患者细胞的研究中得到了进一步证实[54].在人类非小细胞性肺癌中,Notch3 信号通路在肿瘤干细胞中高度表达,抑制 Notch 信号通路是一个潜在的非小细胞肺癌的治疗策略.
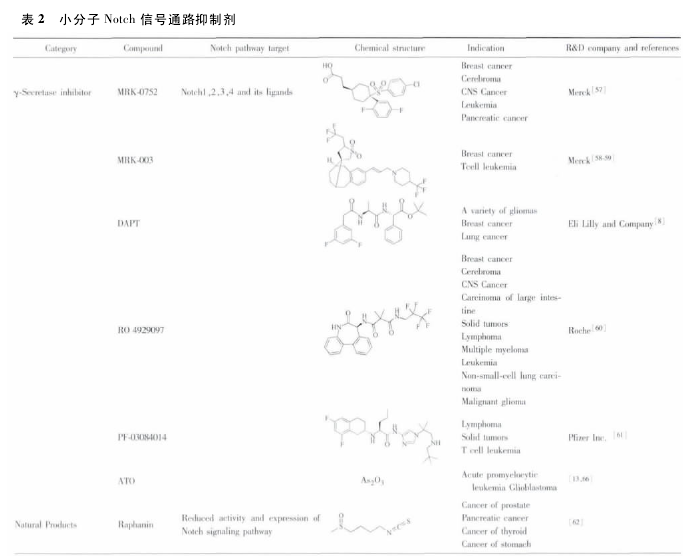
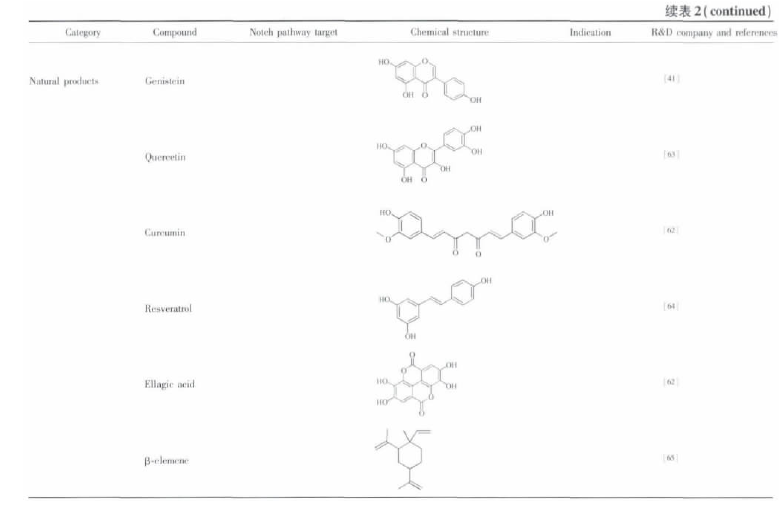
MRK003 在体外能抑制肿瘤细胞的增殖和克隆,研究人员在抑制 Notch 信号通路时使用 MRK-003 作用于 3 种非小细胞肺癌细胞株 ( NCI-H1299,NCI-H1435,NCI-A529) ,用qRT-PCR 法测 Hes1 来评价 Notch 通道的阻断作用,3 类细胞株都呈现出剂量依赖性抑制 Hes1 的表达,结果证实了MRK-003 能有效的抑制 Notch 信号通路的表达; 另外,由于γ-分泌酶能作用于包括 Notch 信号通路的多个受体,为了评估 MRK-003 影响增殖是否通过抑制 Notch 信号通路,研究人员以保持 NICD3 固定活性的肺癌细胞株为对照组,给予MRK-003 后检测发现,MRK-003 只能抑制未处理肺癌细胞的增殖,而对对照组无影响,证明了 MRK-003 在体外通过抑制Notch 信号通路抑制肺癌细胞的增殖[55].目前还发现在转染胰腺导管腺癌的 KPC 小鼠模型中,联合应用 MRK003 和吉西他滨( 商品名为“健泽”) ,通过杀死肿瘤血管内皮细胞和Notch 信号通路抑制肿瘤干细胞双重靶向治疗,引发使胰腺癌细胞死亡,达到治疗肿瘤的目的[56].另外还发现一些天然产物的抗癌途径也是通过 Notch信号通路而发挥作用[13,34,52-66].笔者对小分子 Notch 信号通路抑制剂进行了总结( 表 2) .
5 展 望.
近年来肿瘤干细胞学说受到越来越多人的关注,肿瘤干细胞理论为根治癌症开辟了新的治疗途径.现在新的肿瘤治疗研究开始以特异肿瘤干细胞为主要目标,目前发现Notch 信号通道的过度表达是肿瘤干细胞与干细胞的区别之一,随着关于 Notch 通道抑制剂对肿瘤干细胞作用的深入研究及其 Notch 信号通路亚型的功能差异,人们对两者的关系也有了更多的了解,为开发以 Notch 信号通道为靶点的抗肿瘤药物提供了理论基础,通过高通量筛选实验、化学信息学、化学基因组学及计算机辅助药物设计等方法,开发专门针对Notch 信号通路的抑制剂,有望研发出针对肿瘤干细胞的治疗药物.
参考:
[1] PATHAK S. Organ and tissue-specific stem cells and carcinogen-esis[J]. Int Institute Anticancer Res,2002,22( 3) : 1353-1356.
[2] NDUOM E K,HADJIPANAYIS C G,VAN MEIR E G. Glioblas-toma cancer stem-like cells: Implications for pathogenesis andtreatment [J]. Cancer J,2012,18( 1) : 100-106.
[3] DITTMER,JURGEN R,ACHIM. Cancer stem cells in breastcancer[J]. Histology and Histopathology,2013,28 ( 7 ) : 827-838.
[4] HASSAN K A,WANG L,KORKAYA H,et al. Notch pathwayactivity identifies cells with cancer stem cell-like properties andcorrelates with worse survival in lung adenocarcinoma[J]. ClinCancer Res,2013,19( 8) : 1972-1980.
[5] WU J N,JI Z Y,LIU H L,et al. Arsenic trioxide depletes canc-er stem-like cells and inhibits repopulation of neurosphere derivedfrom glioblastoma by downregulation of Notch pathway [J]. Toxi-col Lett,2013,220( 1) : 61-69.
[6] WANG Z W,SHADAN A,SANJEEV,et al. Activated K-Rasand INK4a / Arf deficiency promote aggressiveness of pancreaticcancer by induction of EMT consistent with cancer stem cell phe-notype[J]. J Cellular Physiol,2009,228( 3) : 556-562.
[7] WANG Z W,LI Y W,SANJEEY B. Down-regulation of Notch-1and Jagged-1 inhibits prostate cancer cell growth,migration andinvasion,and induces apoptosis via inactivation of Akt,mTOR,and NF-kB signaling pathways[J]. J Cell Biochem,2011,112( 1) : 78-88.
[8] INGRID E,LUCIO M. Notch inhibitors for cancer treatment[J].Pharmacol Ther,2013,139( 2) : 95-110.
[9] CASPER G,MARK E. F. Therapeutic approaches to modulatingNotch signaling: Current challenges and future prospects[J].Seminars in Cell & Developmental Biology,2012,23 ( 4 ) : 465-472.
[10] SELL S. Cancer and stem cell signaling: A guide to preventiveand therapeutic strategies for cancer stem ceils[J]. Stem CellBev,2007,3( 1) : 1-6.
[11] NEFEDOVA Y,SULLIVAN D M,BOLICK S C,et al. Inhibi-tion of Notch signaling induces apoptosis of myeloma cells and en-hances sensitivity to chemotherapy[J]. Blood,2008,111 ( 4 ) :2220-2229.
[12] CHU L,HUANG Q,ZHANG Q B,et al. Effect of ABCG2 ondrug resistance gene of brain tumor stem cells[J]. Chin Pharm J( 中国药学杂志) ,2009,44( 10) : 754-758.
[13] CHIU H W,HO Y S,WANG Y J. Arsenic trioxide induces auto-phagy and apoptosis in human glioma cells in vitro and in vivothrough downregulation of surviving[J]. J Mol Med,2011,89( 9) : 927-941





