摘 要: 目的介绍Hippo通路在颅面部器官发育相关领域中的最新进展。方法广泛查阅近年来国内外关于Hippo通路各组分在调节颅面器官发育中的作用的相关研究,对相关功能及机制进行总结。结果 Hippo信号通路是由一系列进化保守的蛋白构成激酶级联反应,通过对细胞的增殖,凋亡及分化等多种事件的调节来参与颅面部器官发育。结论脊椎动物颅面部器官的发育需要一系列复杂有序的信号分子共同协调参与。Hippo通路在颅面发育中具有重要作用,有望为探索颅面畸形新的治疗靶点提供帮助。
关键词: Hippo通路; 颅面器官; 发育; 颅神经脊细胞;
Abstract: Objective:To review the recent progress of Hippo pathway in craniofacial organ development.Methods:The related published literature concerning the role of Hippo pathway in regulating craniofacial organ development extensively reviewed summarized.Results:Hippo signaling is an evolutionarily conserved pathway that controls the morphogenesis in craniofacial organ by modulating cell proliferation,apoptosis,and differentiation.And any dysregulation of the molecules could lead to craniofacial malformation,causing a heavy burden on the family and the society Conclusion:Hippo pathway plays an important role in craniofacial development,and is expected to provide some help for exploring potential molecular therapeutic targets.
Keyword: Hippo signaling pathway; Craniofacial organ; Development; Cranial neuro crest cell;
脊椎动物颅面器官结构复杂,其形态的发生包括骨、软骨、牙齿及其他结缔组织等多种不同细胞类型的发育。每一步骤都需要众多基因精确地协同表达,形成复杂而有序的信号网络,决定最终颅面结构的生长模式。近年来,细胞及动物模型的体内外研究对于颅面部发育的基因基础起到了极大的推进作用。其中Wnt/β-catenin通路,成纤维细胞生长因子(Fibroblastic Growth Factor,FGF)通路,骨形态形成蛋白(Bone Morphogenetic Protein,Bmp)通路和转化生长因子(Transforming Growth Factor,TGF)通路的信号分子以及Hox基因等通过时间、空间和组织特异性的表达调节细胞的迁移、增殖、分化、和中胚层及颅神经脊细胞的转换,驱动着面部突起的形成和生长,对早期颅面器官的外形及结构形成奠定了基础[1,2,3,4]。Hippo信号通路参与调控细胞命运决定、增殖和凋亡等重大的细胞事件,在调节组织器官生长发育、再生,维持内环境稳态及疾病发生等方面也都具有重要作用[5]。目前,Hippo通路已被证实在心脏、肺、肝脏、肠道、肾脏等机体多个组织器官的发育过程中具有重要的作用[6,7],但其在颅面器官形成过程中的功能还远处于未知状态。本文主要通过介绍Hippo通路在颅神经脊细胞发育中的作用来阐述其在颅面部器官发育中的作用。

1、 Hippo信号通路的组分与功能
1995年,Hippo通路的第一个核心成员Wts蛋白在果蝇体内进行基因筛查鉴定生长抑制剂时被发现。随后的研究逐渐确定了Hippo通路的核心组分,包括Set20家族蛋白激酶 Hippo(Hpo),包含WW区域的支架蛋白Salvador(Sav),胞核Dbf2相关家族蛋白激酶Warts(Wts),以及作为肿瘤抑制因子的接头蛋白Mob(Mats),共同形成激酶级联反应[8,9]。各物种之间的Hippo通路在进化和功能上都相对保守,哺乳动物体内与Hpo、Sav、Wts、Mats、Yki同源的蛋白分别是MST1/2(mammalian Sterile 20-like kinases1/2)、SAV l(Salvador 1)、LATS 1/2(1arge tumor suppressor 1/2)、MOB 1A/B(MOB kinase acticator1 A/B)、YAP(Yes associate protein)/TAZ(transcriptional coactivator with PDZ-binding motif)[8,9](图1)。
图1 A:果蝇体内的Hippo通路;B:哺乳动物体内的Hippo通路
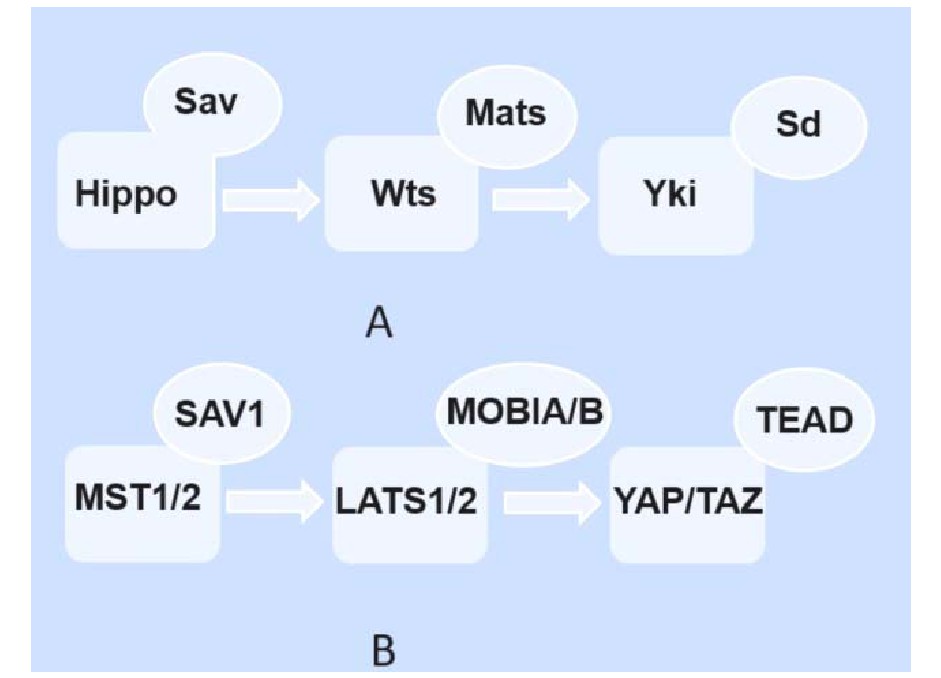
Hippo信号通路被激活时,MST1/2在SAV1的协助下磷酸化下游LATS1/2和MOB1A/B复合物并加强其相互作用,磷酸化的LATS1/2被激活,进一步磷酸化转录共激活因子YAP/TAZ,干扰其细胞核定位,被14-3-3蛋白募集滞留胞质被泛素化降解,抑制其促增殖及抗凋亡的活性。当Hippo信号通路转导被阻断时,YAP/TAZ不被磷酸化而处于激活状态,进入细胞核内。但作为转录辅激活因子,YAP和TAZ没有与DNA结合的结构域,而需通过与TEAD1-4(TEA domain family member 1-4)、RUNX2(runt-related transcription factor 2)、MyoD(myoblast determination protein 1)等转录因子的结合,来进一步促进下游靶基因例如编码结缔组织生长因子(connective tissue growth factor,CTGF)、细胞周期蛋白E(cyclin E)的表达,启动YAP/TAZ介导的促增殖和抗程序性细胞死亡等机体复杂的生物学事件,发挥Hippo通路的生物学功能。
在哺乳动物体内,细胞的增殖、凋亡和死亡均是由多个信号通路调控的结果,各信号通路相互作用,形成一个极其复杂的信号通路网,共同维持机体正常的生命活动。近年来研究发现Hippo通路在调控颅面部器官发育的信号网中也起着重要的作用。
2、 Hippo通路在颅面部器官发育中的作用
脊椎动物胚胎阶段颅面部结构是由腹侧鳃弓的突起发育而来,形成复杂的颅面部突起等组织器官。鳃弓结构主要由源自中胚层的间充质干细胞和颅神经脊细胞构成,周围被外胚层和内胚层细胞覆盖。鳃弓不同类型的细胞的精心排列及相互作用,特别是颅神经脊细胞的发育对颅面部结构形态发生具有深远影响[10,11]。颅神经脊细胞是起源于背侧神经管的一组可迁移的,多潜能的细胞群。这些细胞在闭合的神经管腹侧轴旁中胚层体节化的同时离开其背部表面,沿着特定的路径从神经管开始迁移。小鼠胚胎8.5天到10.5天,颅神经脊细胞即沿着特定的路径进行定向迁移定位于额鼻突和鳃弓,最终分化为神经元细胞、胶质细胞、软骨细胞、骨细胞和平滑肌细胞等多种类型的细胞和组织,衍生成为颅面部大多数骨骼和结缔组织[12]。调控神经脊细胞增殖、迁移、分化的一系列基因和信号通路在颅面部各种突起的形成中都起着至关重要的作用,人类许多颅面部先天性畸形与颅神经脊细胞发育异常有关。神经嵴细胞形成、增殖、迁移和分化的缺陷被认为是导致颅面畸形的原因,颅面畸形占所有先天性出生缺陷的三分之一。
Wang等[13]利用Cre重组酶生成Yap和Taz的条件性复合突变体以检测其在小鼠颅神经脊细胞中的作用,并且研究不同阶段的胚胎来分析小鼠颅神经脊细胞来源的结构的形态发生情况。结果显示Yap和Taz 复合突变或Yap敲除Taz单倍剂量不足的小鼠在胚胎10.5天出现死亡并表现出鳃弓血管扩张,前脑和下颌区域出血等颅脑严重的不足,HE染色显示出这些区域均出现了紊乱、疏松的间质,致使血管发育障碍。而Taz敲除Yap单倍剂量不足的小鼠直到胚胎后期虽能存活,但会发展成脑积水,表现为脑脊液过度蓄积以及脑内容积异常增加。这也表明了YAP和TAZ的功能虽有重合但不完全相同,且二者对早期正常颅脑和下颌的血管发育至关重要。磷酸组蛋白H3免疫组化染色和末端脱氧核苷酸转移酶介导的dUTP缺口末端标记结果发现Yap和Taz 复合突变的小鼠体内增殖细胞的占比明显减少,而凋亡细胞明显增加。为了进一步验证上述现象的机制,作者在O9-1细胞系中利用siRNA介导的敲除技术进行了体外实验。结果表明Yap和Taz敲除的细胞系中增殖细胞占比降低,而Lats1/2基因敲除的细胞系中增殖细胞占比明显升高,说明颅脑中控制颅面发育的YAP/TAZ是Hippo通路的一部分。该实验还研究了Fox基因与Yap/Taz的关系,Fox基因在胚胎发育和多种生物过程有关。免疫组化及免疫荧光的结果均显示Foxc1在基因突变的小鼠胚胎及O9-1细胞系中均表达减少。Western blot显示Foxc1的表达下降与Yap/Taz的表达减少有关。并利用抗YAP抗体通过染色质免疫沉淀(ChIP)PCR证实了在胚胎面部形态发生过程中,Foxc1是YAP-TEAD复合物的直接下游基因。
Sun等[12]在研究出生后颅面器官生长模式时利用小鼠模型发现FOXO6的表达局限于颅面前部器官。FoxO6基因功能缺失的小鼠在发育后期出现颅面部生长加快,前额,鼻骨及嗅觉系统,上下颌骨显着增大,而头颅以下部分和野生型相近。而这些变化主要是影响胚胎后期颅面器官前后轴的发育并且依靠Hippo通路引起的。基因序列分析表明突变体中Hippo通路存在缺陷。在体外进行CHO和LS-16细胞系研究时发现FoxO6的表达可引起Lats1的表达升高,且二者具有剂量相关性。染色质免疫沉淀分析显示FoxO6可直接结合到Lats1基因5′端调控区的结合位点,直接激活Lats1启动子。出生后,FoxO6在颅面部器官特异表达,通过激活Lats1来增加Hippo信号通路的激活和YAP的磷酸化,从而调节细胞增殖的程度。
胚胎时期腭板内侧边缘上皮的上皮-间质转化参与腭突的正常融合过程,是腭形成过程中的关键因素。任何干扰上皮-间质转化正常进行的因素都可能导致腭裂的形成[14]。Shu等[15]对高浓度维甲酸引起腭裂的小鼠第14.5天的胚胎腭部组织进行了全基因组mRNA表达分析。基因GO分析及KEGG分析显示LEF1和SMAD3基因可能与小鼠腭裂表型有关,且LEF1和SMAD3通过Hippo通路来抑制内侧边缘上皮的上皮-间质转化过程,在一定程度上促进了维甲酸诱导的腭板融合障碍。
牙齿是典型的外胚层的附属器结构,其形态发生经历了复杂连续的过程,包括细胞的迁移、增殖和分化,组织形态发生、组织矿化和牙萌出。这一系列阶段均是口腔上皮细胞和颅神经脊来源的间充质细胞间的有序的信号网络相互诱导共同实现的[16]。 Yap和Taz在小鼠牙齿发育过程中具有时空调控性[17]。Zhang等[17]研究磨牙发育过程中的基因表达水平时发现早在胚胎第14.5天和第16.5天的口腔上皮细胞和间充质中即可探测到Yap和Taz的表达,其后两者的表达水平随磨牙发育进程出现波动。Kwon等[18]发现在牙齿发育帽状期和钟状期之间,Yap对于抑制初级釉结和形成次级釉结的形态至关重要。胚胎第14.5天的Yap过表达及Yap条件性敲除的小鼠牙胚Hoxa1和Hoxc13的表达均有明显的变化,所以Hoxa1和Hoxc13被认为是YAP在口腔和牙源性上皮组织的下游靶基因。染色质免疫沉淀分析结果显示YAP调节Hoxa1和Hoxc13的过程是由TEAD转录因子介导的[19]。Li等[20]发现αE-catenin通过调节YAP/TAZ的表达来控制釉结的形成。条件性敲除切牙牙胚上皮αE-catenin的编码基因可引起釉结区域的细胞核中的YAP富集,导致釉结形成缺陷。而YAP和TAZ的联合缺失可挽救αE-catenin缺失所引起的釉结缺陷表型。Sun等在研究FoxO6在颅面器官发育中的作用时发现FoxO6纯合突变的小鼠切牙颈环和间质区域中的Lats1表达下降,成釉质细胞和成牙质细胞均表现出结构缺陷。而通过对Lats1基因5′调控区的序列分析显示,在Lats1上游有FoxO6的结合位点,内源性的FoxO6与这一结合位点直接结合来活化Lats1的表达,调控Hippo通路,以抑制切牙颈环干细胞的增殖[12。
3 、Hippo通路与颅面部器官发育畸形的关系
人类Van Maldergem 综合征由编码原钙粘蛋白家族的成员DCHS1或FAT4的基因突变引起,是一种罕见的以神经元迁移异常,生长迟缓,智力发育障碍,颅面畸形以及四肢及骨骼发育不良为特点的常染色体隐性疾病[21,22]。颅面部畸形主要表现为眶距过宽、内眦赘皮、上睑下垂、低鼻、上唇倒置、下唇外翻、小耳畸形。小鼠胚胎Dchs1或Fat4的基因突变导致胚胎神经上皮前体细胞分化减少,并以一种依赖YAP的方式使前体细胞在新皮层神经元层以下异位积累,类似于人类Van Maldergem综合征的表型[23]。同时,这些缺陷的表型通过敲低Hippo通路的转录辅激活因子Yap来纠正,表明Dchs1和Fat4通过调节Yap的表达来调控哺乳动物神经发育。Williamson等[24]在研究患有眼组织缺损疾病的两个家系基因情况时发现两个家庭都有YAP的杂合无义突变。
4、 小结
在过去的几年中,学者们利用多种体内外模型对Hippo通路在颅面器官发育中的作用及机制做了许多具体的研究。初步证实Hippo通路对于颅面部器官发育,特别是对神经脊细胞的命运决定的调控有着至关重要的作用。Hippo通路的相关基因中断或被干扰都将会造成颅面部组织形态发育障碍,导致器官畸形的发生。而目前有关Hippo通路在颅面器官形态发生过程的具体机制以及同其他信号的相互作用的研究还处于探索阶段,寻找新的防治靶点的研究仍需进一步开展。希望本文可以为以后的研究提供总结性的参考价值。
参考文献
[1] Yin X,Li J,Salmon B,et al.Wnt Signaling and Its Contribution to Craniofacial Tissue Homeostasis[J].Journal of Dental Research,2015,94(11):1487-1494.
[2] Lei R,Zhang K,Liu K,et al.Transferrin receptor facilitates TGF-beta and BMP signaling activation to control craniofacial morphogenesis[J].Cell Death & Disease,2016,7(6):e2282.
[3] Parker HJ,Pushel I,Krumlauf R.Coupling the roles of Hox genes to regulatory networks patterning cranial neural crest[J].Developmental Biology,2018,444 Suppl 1:S67-S78.
[4] 黄鑫,于晓波,蒋海越,等.FGF信号通路与颅面部发育研究现状和进展[J].中国优生与遗传杂志,2016,12(24):3-7.
[5] 吉新彦.哺乳动物Hippo信号通路分子机制研究进展[J].遗传,2017,7(39):546-567.
[6] Fu V,Plouffe SW,Guan KL.The Hippo pathway in organ development,homeostasis,and regeneration[J].Current Opinion in Cell Biology,2018,49:99-107.
[7] 李楠.Hippo-YAP信号通路与多种疾病的研究进展[J].中国继续医学教育,2016,20():50-51.
[8] Meng Z,Moroishi T,Guan KL.Mechanisms of Hippo pathway regulation[J].Genes & Development,2016,30(1):1-17.
[9] Yu FX,Zhao B,Guan KL.Hippo Pathway in Organ Size Control,Tissue Homeostasis,and Cancer[J].Cell,2015,163(4):811-828.
[10]Cordero DR,Brugmann S,Chu Y,et al.Cranial neural crest cells on the move:their roles in craniofacial development [J].American Journal of Medical Genetics Part A,2011,155a(2):270-279.
[11]王长琛,于晓波,潘博,等.Foxi蛋白对第1-2鳃弓衍生物的发育调节[J].中国优生与遗传杂志,2016,24(12):8-9.
[12]Sun Z,da Fontoura CSG,Moreno M,et al.FoxO6 regulates Hippo signaling and growth of the craniofacial complex[J].PLoS Genetics,2018,14(10):e1007675.
[13]Wang J,Xiao Y,Hsu CW,et al.Yap and Taz play a crucial role in neural crest-derived craniofacial development[J].Development(Cambridge,England).2016,143(3):504-515.
[14]Nakajima A,C FS,Gulka AOD,Hanai JI.TGF-beta Signaling and the Epithelial-Mesenchymal Transition during Palatal Fusion[J].Int J Mol Sci,2018,19(11).
[15]Shu X,Shu S,Cheng H.Genome-wide mRNA-Seq profiling reveals that lef1 and smad3 regulate epithelial-mesenchymal transition through the hippo signaling pathway during palatal fusion[J].Genetic Testing and Molecular Biomarkers,2019,23(3):197-203.
[16]Li CH,Li CZ.The role of Hippo signaling in tooth development[J].Journal of the Formosan Medical Association=Taiwan yi zhi,2016,115(5):295-297.
[17]Zhang B,Sun BY,Ji YW,et al.Expression and localization of Yap and Taz during development of the mandibular first molar in rats[J].Biotechnic &histochemistry:official publication of the Biological Stain Commission,2017,92(3):212-221.
[18]Kwon HJ,Li L,Jung HS.Hippo pathway/Yap regulates primary enamel knot and dental cusp patterning in tooth morphogenesis[J].Cell and Tissue Research,2015,362(2):447-451.
[19]Liu M,Zhao S,Lin Q,Wang XP.YAP regulates the expression of Hoxa1 and Hoxc13 in mouse and human oral and skin epithelial tissues[J].Molecular and Cellular Biology,2015,35(8):1449-1461.
[20]Li CY,Hu J,Lu H,et al.alphaE-catenin inhibits YAP/TAZ activity to regulate signalling centre formation during tooth development[J].Nature Communications,2016,7:12133.
[21]Sotos J,Miller K,Corsmeier D,et al.A patient with van Maldergem syndrome with endocrine abnormalities,hypogonadotropic hypogonadism,and breast aplasia/ hypoplasia[J].International Journal of Pediatric Endocrinology,2017,2017:12.
[22]Ivanovski I,Akbaroghli S,Pollazzon M,et al.Van Maldergem syndrome and Hennekam syndrome:Further delineation of allelic phenotypes[J].American Journal of Medical Genetics Part A,2018,176(5):1166-1174.
[23]Cappello S,Gray MJ,Badouel C,et al.Mutations in genes encoding the cadherin receptor-ligand pair DCHS1 and FAT4 disrupt cerebral cortical development[J].Nature Genetics,2013,45(11):1300-1308.
[24]Williamson KA,Rainger J,Floyd JA,et al.Heterozygous loss-of-function mutations in YAP1 cause both isolated and syndromic optic fissure closure defects[J].American Journal of Human Genetics,2014,94(2):295-302.





