摘 要: 英国生物银行依靠其运作框架,在发展国家精准医疗、生物医药中发挥了重要作用。近年来,中国涉及人类遗传资源的生物技术研发活动出现了一系列新情况、新问题。针对人类遗传资源库的实践、伦理和法律困境,借鉴英国生物银行,提出了构建中国国家级人类遗传资源库的设想,并从建立第三方储存服务的运行机制,推行科研与临床协作制度,完善人类遗传资源伦理治理体系,强化多方监管合力,加强行政法规制五个方面展开论述。
关键词: 人类遗传资源; 英国生物银行; 生物样本库; 伦理原则; 法律保障;
Abstract: The UK Biobank has played an important role in the development of national precision medicine and biomedicine through its operational framework. In recent years, a series of new situations and problems have emerged in the study and development of biotechnology which involving human genetic resources in China. In view of the practical, ethical and legal dilemma of the human genetic resource bank, this paper proposed the idea of constructing a national human genetic resource bank in China by referring to the UK Biobank, it also discusses from the following five aspects: the establishment of the operation mechanism of third-party storage service, the implementation of scientific study and clinical cooperation system, the improvement of the ethical governance system of human genetic resources, the strengthening of multi-party supervision and administrative laws and regulations.
Keyword: Human Genetic Resource; UK Biobank; Biological Sample Bank; Ethical Principle; Legal Protection;
英国生物银行(UK Biobank)由英国医学研究理事会(the UK Medical Research Council)和维康信托基金会(Wellcome Trust)于1999年提出,2003年建立,并注册为一家慈善公司,是一个储存有海量生物样本与数据的人类遗传资源库,用于研究疾病的预防、诊断与治疗方式[1]。

1 、英国生物银行的运作框架
1.1、 实践运行
英国生物银行作为第三方储存服务的创新模式,与资源志愿者、研究开发者密切联系。一方面,公众志愿响应生物银行的招募并向其提供血液、唾液、尿液、骨骼等人类遗传资源;另一方面,储存在内的样本与数据可以被开放共享,世界范围内的卫生研究者都可以经过申请、审核而取得。
英国生物银行由位于曼彻斯特大学校园内的协调中心集中管理,下设6个区域合作中心,共同组成了一个包含有23家研究单位的网络,各单位分别招募志愿者、收集初始数据和样本。生物银行的协调中心全面负责项目交付,包括数据管理、质量保证、财务管理以及数据和生物样本的正式保管;董事会对英国生物银行全面指导与管控;首席执行官负责项目的日常运作;科学委员会就科研项目的方向和目标向董事会提供咨询[2]。伦理与治理委员会是由医学研究理事会和维康信托基金会成立的、独立于生物银行的组织,它公开监测和报告生物银行的项目是否符合伦理和治理框架,并就招聘、访问等事项提供建议。(见图1[3])
图1 英国生物银行的实践运行框架
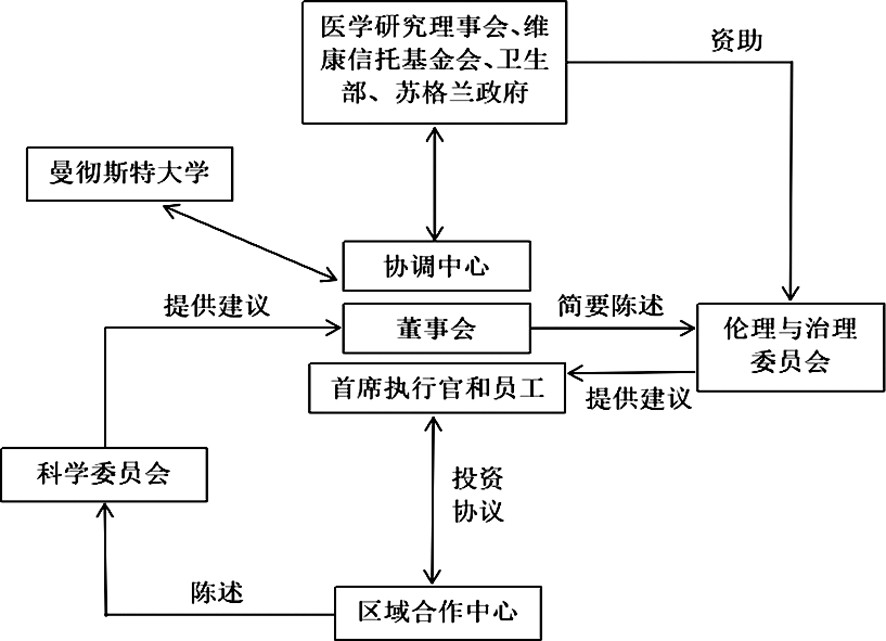
从英国生物银行的功能来看,每个中心都采集了大量的基线数据,包括志愿者的家族史、生活方式、居住环境等通过问卷获取的数据,血压、心率、骨密度、磁共振图像等通过物理测量得来的数据,血液、唾液、尿液等初始生物样本[3],不同的区域中心之间、生物银行与全球的研究机构之间都可以进行资源共享。只要研究机构的项目经过科学与伦理审查,被认可符合公众利益与法律伦理,申请者即可从生物银行获得资源,但申请者需向生物银行承诺反馈他们的研发方法、派生数据、样本分析结果等详细信息,以便纳入该银行的数据库内,使其他获得批准的研究机构可以使用这些数据[4]。从治理手段来看,一方面,英国生物银行实现了标准化管理,对各中心研究项目的审查标准、采集和保藏生物样本的技术标准、志愿者权利保护的程度标准、数据开放获取的准入标准等都进行了整合;另一方面,伦理与治理委员会对生物银行进行监督,并有权在必要时公开生物银行的不当行为。
1.2 、伦理原则
英国生物银行在采集人类遗传资源的过程中始终以资源志愿者为中心,坚持自主、补偿、保密的原则;在处理研究机构的资源申请时也始终注重公平、安全与惠益分享。伦理原则对生物银行的实际工作具有指导作用,在促进生物医学研发层面作用显着。为保证有效贯彻上述伦理原则,英国生物银行采取了以下措施。
第一,坚持自主原则,尊重志愿者的自我决定和知情同意权利。志愿者除了在初始访问阶段会被告知资源提供行为的意义与风险外,在利用其遗传资源进行后续研究的过程中,也可以通过英国生物银行的网站或年度简报了解参与的项目进展,并且他们在访问结束后会收到一份基础的健康反馈,被鼓励就超出正常范围的结果寻求医学建议。此外,志愿者在参与的任何阶段都有权撤回知情同意,经过生物银行的评估,最终会形成一份以保护志愿者权利为核心的撤回方案。
第二,坚持补偿原则,生物银行对于因提供资源而产生的合理费用(例如,差旅费、停车费),会按志愿者的要求予以报销,确保志愿者不因自身的善意行为而承担费用。
第三,坚持保密原则,生物银行将人类遗传资源匿名化存储,并对可识别性的个人信息限制访问,只有少部分工作人员掌握有识别这些信息的密钥。研究机构申请遗传资源时,申请者必须签署《标准材料传输协议》(Standard Material Transfer Agreement),用来确保样本与数据安全、承诺不试图识别任何资源提供者、保证在审批范围内使用,一旦涉及需要再次联系志愿者的研究项目,也将会受到更加严格的审查。
第四,坚持公平原则,研究机构享有平等获得资源的权利,英国生物银行具有透明的准入政策,无论是学术、政府、慈善、商业领域的研发机构,还是来自国内或国外的组织,每个申请者都适用一致的审查标准,且研究机构可以对英国生物银行作出的拒绝提供资源的决定进行诉讼。
第五,坚持安全原则,生物银行严格遵守英国生物安全战略,在准入、保藏、共享的三个环节中构建了人类遗传资源的保护体系,致力于阻断资源流失、避免生物安全威胁。一是由人体组织管理局(the Human Tissue Authority)向生物银行颁发许可证,并对其采集、保藏、利用人体组织的行为制定标准;二是生物银行以保证样本质量为原则制定了《样品处理和储存协议》(a Sample Handling and Storage Protocol),就如何、何时处理生物样本,如何存储以确保样本的长期完整等内容进行了明文规范;三是所有的资源申请均须由生物银行董事会的访问小组委员会(the Access Sub-Committee)以项目可行性和生物安全战略为依据,就遗传资源的对外提供作出审批。
第六,坚持惠益分享原则,对于运用生物银行提供的样本或数据进行研发而产生的知识产权,生物银行不主张任何权利,该权利由研究人员和/或其所属的研究机构所有,除非有证据证明该知识产权不合理地限制了健康研究与卫生保健的可及性。但运用生物银行的资源所产生的新的数据应给予生物银行非独占许可的授权,且可以作出分许可,允许接受该银行许可的其他研究者进行开放访问与资源获取[5]。
1.3 、立法保障
英国生物银行专业领域的法律规制促进了该机构的有序运行。英国先后于2004年、2007年出台的《人体组织法》《人体组织(人体应用质量和安全)条例》为医疗、科研、器官捐赠等活动中涉及采集、保藏、利用人类遗传资源材料的行为提供了法律依据,从立法层面指导了生物银行的科学运作。其中,《人体组织法》分为三个部分,它围绕着同意和监管制度来管辖一系列与人类遗传材料有关的事项,其核心规定有:①获取、储存、使用人体组织的知情同意规则,尤其强调对死者和不具备完全行为能力人的应用;②开展相关研究活动的监督与管理,通过成立人体组织管理局来批准发放许可证,确保资源足以被安全高效地使用,杜绝商业交易的行为;③其他细节化的单项规定,例如公共权力间的协作事项、年度报告制度、生物样本的保藏行为等。此外,《通用数据保护条例》(General Data Protection Regulation)是英国生物银行数据处理的合法依据,它指出生物银行有权采集、储存个人的健康信息,并有权为公共利益的需要访问个人的临床健康数据[6],保障了英国国家医疗服务体系(NHS)的信息系统能够与生物银行的数据库相联系,为随访公民的健康信息、跟踪探究不同因素对健康状况的影响、促进研究成果的临床应用提供了有效手段。
针对生物银行的特征,英国采用了专门规范模式。《英国生物样本库伦理和监管框架》(UKBiobank Ethics and Governance Framework)从资源志愿者、研究开发者、社会三方面对生物样本库作了细致规范:①与志愿者的关系,包括招募、知情同意、隐私三项制度;②与研发者的关系,涉及生物样本与数据的管理、获取、共享;③与社会的关系,明确了不同主体的职责,细化了伦理监管与知识产权的内容。
2 、我国人类遗传资源库的现实困境
2.1、 缺乏统一的标准化管理
我国目前尚没有专门用来采集、保藏人类遗传资源的机构,而实行以现实需求为基础、“谁研究谁采集谁保藏”的机制。因此,科研院所、高等院校、医疗机构、企业各自相对独立地对人类遗传资源进行采集、保藏、利用与对外提供,没有统一的标准。即使近两年我国已创建了上海、华南、山东、江苏四个区域中心,使得各自地区内的数家研究机构标准化整合,但仍然未形成国家层面上的统一标准,在全国其他没有设立区域中心的地方,各单位的标准更是参差不齐。
2.2、 资源共享困难
我国创建了区域中心、项目样本管理组织、行业联盟、企业商业化虚拟生物库这四种共享模式[7],为促进各研究机构对人类遗传资源进行共享提供了平台,却也存在多方面的限制。一是共享范围有限,区域中心的地域性、项目样本管理组织的专门性、行业联盟与商业化虚拟生物库的资本性决定了生物样本或数据难以在全国范围内被广泛提供;二是我国对于人类遗传资源的采集、保藏、利用、对外提供都在国家的行政审批范围内,即使要实现简单的信息共享,也需要经过一系列行政程序;三是涉及人类遗传资源的知识产权分配机制不完备,主要的问题在于:运用共享平台的资源而产生的研究项目成果,其知识产权如何分配?研究机构需要让渡一部分知识产权给共享平台或是平台内为其提供资源的其他机构吗?
2.3 、临床与科研的衔接度不高
除医疗机构外,我国其他形式的人类遗传资源库都不具备对临床数据的可及性,而人类遗传资源研究与临床医学数据是分不开的。在研究项目审批阶段,临床数据有利于筛选出临床中的常见病或重大疾病,并掌握当前的疾病预防与诊疗手段,用于判断研究项目是否具有必要性、需求性,是否符合医学伦理;在研究项目开展阶段,临床健康信息能够用于探索疾病发生发展的规律、发现个别基因的医学特征、了解不同因素对身体健康的影响;在研发成果运用阶段,新型药物、有效性的治疗方法、精准的医疗诊断仪器等人类遗传资源的研发成果在临床应用中是否具备实用性与安全性,也需要通过临床健康数据来验证。
2.4 、伦理治理框架不完善
关于知情同意原则,一方面,人类遗传资源库的告知义务范围面临挑战,资源库在采集或使用资源时若发现提供者有疾病症状,是否能去主动干涉个人的健康状态,将该健康威胁因素予以告知;另一方面,资源提供者的实时退出机制不完备,如在决定退出后个人的样本与数据应如何处理、行为能力变化是否会影响资源提供者作出撤回同意的效力。
关于保护隐私原则,我国对于资源提供者的隐私保护主要是依靠各研究机构来采取行动,科学技术行政部门只负责对这些保密措施进行书面审查。且隐私保护措施大多注重使提供者的信息不被第三方知悉,缺少对人类遗传资源库本身的保密规范。
关于惠益分享原则,在我国,由人类遗传资源衍生的知识产权成果由研究机构享有,遗传资源提供者不仅没有被分配到任何利益,并且在消费研究成果时还需要交付费用,带来了利益分配不平等的现象。
2.5、 生物安全监管难度大
人类遗传资源的使用攸关国家生物安全和战略安全。近年来,人类遗传资源的境外流失、非法利用现象持续存在,我国人类遗传资源库的生物安全监管制度亟须加强。尤其是在互联网技术不断发展的背景下,人类遗传资源数据的流失成了威胁我国生物安全的重大因素。而利用网络,遗传资源数据可以随时随地被非法对外提供,科学技术行政部门要想对人类遗传资源库进行实时监管很难做到。同时,人类遗传资源数据传输速度快,且易删除、易丢失、易修改,遇到向境外非法提供的情形还会关系到一些涉外因素,导致监管部门会陷入调查取证难、无法确定证据真实性与合法性的难题。
2.6、 立法保障体系不全面
《人类遗传资源管理条例》是规范我国人类遗传资源的主要法规,关于人类遗传资源的审批、处罚、伦理等内容则散在于《行政许可法》《行政处罚法》《海关法》《科技进步法》《专利法实施细则》《涉及人的生物医学研究伦理审查办法》等法律文件中。
随着《人类遗传资源管理条例》的发布,采集、保藏、利用、对外提供人类遗传资源的行为有了法律规制,但仍无法满足当前的法律需要。首先,人类遗传资源的审批制度不详细。条例虽然阐述了何种项目需要审批、审批需要提交哪些材料,但没有规定科学技术行政部门作出审批的确切标准,且条例缺乏伦理审查的内容,关于知情同意、隐私、惠益分享的条款原则化,实践中研究机构大多依靠自身的伦理审查委员会作出约束,法律层面的伦理风险防范不够。其次,关于人类遗传资源信息保护的制度不足。条例侧重于对人类遗传材料的监管,而由遗传材料产生的数据、图像等信息资料具有较高的可传输性与价值性,与其受到的保护力度不匹配。最后,缺少对生物样本库的规范。我国的生物样本库形式多样,带来了管理标准不统一、行为与伦理要求不一致等问题。
3 、对构建我国人类遗传资源库的启示
《人类遗传资源管理条例》中明确提出,国家应加快标准化、规范化的人类遗传资源保藏基础平台和人类遗传资源大数据建设,为开展相关研究开发活动提供支撑,而建立国家级人类遗传资源库可以有效解决上述多种弊端,也贴合新的法律要求[8]。
3.1 、建立第三方储存服务的运行机制
建立国家级的人类遗传资源库可以参考英国生物银行的运行机制,以我国已有的四个区域中心为基础,在全国其他地方成立新的区域中心,并统一由一个国家级的人类遗传资源库集中管理,从而形成内部组织关系。在外部,依靠政府支持来建设完备的软硬件设施(信息网络系统、标准化存储条件、数据分析与计算技术、法律法规细则等),提供专家技术评审与监管。最终,国家级人类遗传资源库能够将采集管理遗传材料、促进研究开发等职能相整合,成为连接资源提供者与研究机构的第三方平台。资源库站在中立的角度对遗传材料的采集进行可行性与损益比分析,进而以资源提供者为中心做出资源采集方案。同时,研究机构的工作需以向资源库申请遗传资源为前提,在科学与伦理的实质审查后,资源库再作出是否提供资源的决定,并可以对研究机构提供技术咨询服务、开展技术评估或约定信息的共享与二次交换(见图2)。
图2 国家级人类遗传资源库的内外部组织关系

上述建立国家级人类遗传资源库的方案具有可行性。首先,四个区域中心的成立给建库提供了现实基础,既有利于促成“从地方到国家”的内部组织结构,又与当前人类遗传资源库的主流发展模式相契合。其次,国家级的人类遗传资源库吸收了研究机构原先的采集与保藏行为,降低了研究者的经济与工作负担,使其能够在面临同等资源可及性的情形下,将更多的精力投入研究开发当中。最后,科学技术行政部门对研究项目的部分审查权也下放给了国家级的人类遗传资源库,可以依靠资源库的多学科知识、技术条件等优势提供更加专业的、灵活的审批程序与项目监督。
3.2、 推行科研与临床协作制度
搭建国家级人类遗传资源库与医院信息系统间的联系具备必要性,且两者的协作是一个持续的过程。各区域中心在刚开始接触遗传资源提供者时,通过访问该地区内的医院信息系统来评估提供者的遗传材料是否具有被采集的条件,从而确保采集行为的需求性与遗传材料的价值性。在保藏、使用人类遗传资源时,资源库可以从医院信息系统中收集健康相关数据,跟踪提供者的健康动态,挖掘对研究人类遗传资源有意义的信息。在人类遗传资源的研究成果被运用于临床时,资源库能够根据医院信息系统中的数据,了解该成果的临床实用性,并及时发现转化医学中的难题。
3.3 、完善人类遗传资源伦理治理体系
应细化人类遗传资源库的知情同意规则,保障资源提供者的自我决定权。第一,制定科学、无风险的退出机制,完善人类遗传资源的后续处置方式,并在资源提供者决定退出研究项目时,对其予以书面告知。第二,若资源提供者在项目研究过程中死亡或丧失行为能力,对本人或其法定代理人提出退出的行为效力需要进行规范,可以借鉴英国,以尊重无行为能力或已故者的意愿为原则,与资源提供方共同讨论退出方案,并对该方案进行书面确认。第三,探讨告知义务的确切范围,例如是否可以将个人健康信息纳入告知范围内,对于此,英国生物银行没有忽视那些威胁志愿者健康的信息,而是规定可以在以下三个阶段向他们提供测量数据或观察结果:首次访问时(如血压)、样本储存前的初始阶段(如白细胞计数)、研究结果产生的较晚阶段(如遗传研究)。第四,人类遗传资源的研发越来越需要资源提供者的临床数据,但电子病历等信息涉及提供者的隐私,当科研与临床建立有效衔接时,应考虑将查阅临床数据纳入提供者的知情同意范围内。
应加强人类遗传资源库的隐私保护,确保资源提供者个人信息的安全性。目前,我国主要采用网络安全技术、信息匿名化等手段,除此之外,还可以通过设置密钥来限制内部人员去访问这些可识别信息,或与员工签署保密协议、开展员工信息安全培训,从而做好内部保密工作。在对外提供人类遗传资源时,应将保密承诺作为前提,只有在另一方承诺不试图识别任何资源提供者、保证在审批范围内使用的前提下才能允许实现数据共享[9]。
应以合理补偿和健康维护为原则,推动资源提供者分享研究项目的利益。一方面,因资源提供行为而产生的合理费用应按提供者的要求予以报销补偿;另一方面,可以通过为提供者安排免费体检、适当减免医疗费用、优先享受研发成果等措施,回馈给提供者一些医疗资源,推动形成公平、互利的惠益分享方案。
3.4、 强化多方监管合力
人类遗传资源库关系到我国的国家生物安全,应加强政府、群众、行业三方的协作,形成监管合力。首先,政府监管需要科学技术行政部门加强对人类遗传资源库的监督检查,落实研究项目的定期报告与跟踪审查制度,并增强网络监管力度,严厉阻断遗传资源数据的非法传输途径。其次,可以借鉴英国生物银行在资源提供者中成立参与者小组,代表提供者就资源库的各项行为发表意见,畅通群众监管途径。最后,通过制定采集、保藏、分享生物样本与数据的明确要求,利用行业标准监管人类遗传资源库的有效运行。
3.5 、加强行政法规制度
要推动人类遗传资源库的立法保障,可以通过制定《人类遗传资源管理条例实施细则》对配套的行政条款进行解释或补充。一是丰富条例中涉及行政许可的法律规定,包括公布人类遗传资源研究项目的审批标准、推动书面审批与实质审查相结合等内容。二是畅通对行政许可的法律救济途径,保证研究机构对项目不予批准的复议或诉讼权利。三是加大关于人类遗传资源的行政处罚力度,贯彻个人责任制,除了对违反条例的单位予以严厉处罚,对单位的法定代表人或主要责任人员的行政追责也应在实践中得到落实,并完善行政责任与刑事责任之间的有效衔接。与此同时,我国也可以针对人类遗传资源库的特征,从立法层面规制资源库的具体运作办法,形成关于人类遗传资源库的专门性行政法规。
4 、结论
随着人类遗传资源的研发活动快速增长,我国人类遗传资源库在实践运行、伦理治理、法律保障中面临着诸多问题,而英国生物银行的运作框架值得我国加以借鉴。基于此,构建我国国家级人类遗传资源库具有现实需要,与之配套的实践、监管、伦理、法律方案也应在现有基础上进一步跟进与完善,从而对我们探索疾病发生发展的机制、促进公众健康、营造更好的国家医疗环境具有重要意义。
参考文献
[1] Sudlow C,Gallacher J,Allen N,et al.UK Biobank:An Open Access Resource for Identifying the Causes of a Wide Range of Complex Diseases of Middle and Old Age[J].PLOS Medicine,2015,12(3):e1001779.
[2] Ollier W,Sprosen T,Peakman T.UK Biobank:from concept to reality[J].Pharmacogenomics,2005,6(6):639-646.
[3] Allen N,Sudlow C,Downey P,et al.UK Biobank:Current status and what it means for epidemiology[J].Health Policy and Technology,2012,1(3):123-126.
[4] Conroy M,Sellors J,Effingham M,et al.The advantages of UK Biobank’s open access strategy for health research[J].Journal of Internal Medicine,2019,286:389-397.
[5] 伍春艳,焦洪涛,范建得.生物银行运作中的知识产权问题探析[J].知识产权,2015(3):63-69.
[6] 杨渊,秦奕,池慧,等.人类遗传资源数据共享管理研究及对中国的启示[J].中国医学科学院学报,2019,41(3):396-401.
[7] 侯聪聪,赵伟,白晨.人类遗传资源样本信息共享中提供方之间的博弈分析[J].中国科技资源导刊,2018,50(4):71-77,109.
[8] 潘子奇,陈小鸥,李苏宁,等.我国人类遗传资源样本库建设现状及建议[J].医学信息学杂志,2018,39(9):50-53.
[9] Hansson M G.Building on Relationships of Trust in Biobank Research[J].Journal of Medical Ethics,2005,31(7):415-418.





