
梨 Pyrus 是世界范围栽培的主要果树树种之一。 2012 年中国梨的栽种面积为 108.55 万 hm2, 梨产量达到了 1 579 万 t[1], 为世界上梨产量最高、 面积最大的国家。 梨为落叶乔木, 树体较大, 而且结果周期较长, 因此, 梨的新品种选育不仅需要的时间长, 而且土地及劳动力投入耗费大。 目前, 中国梨品种选育方式主要包括杂交育种、 芽变选种、 实生选种、 辐射育种等[2]。 以上梨品种培育方法中除了辐射育种, 其他育种方式的效率都较低, 难以满足育种和生产实践的需求。 此外, 由于梨自身产生突变的效率比较低, 难以获得类似模式植物的突变体材料用于重要性状的内在机制研究, 因此, 开展梨突变体的创制具有重要的实践和科学意义, 是十分重要的研究工作。 甲基磺酸乙酯(EMS)是目前应用最为广泛, 效果最佳的化学诱变剂之一, 其诱变后代的突变频率高, EMS 处理玉米 Zea mays 花粉, 突变频率高达 78%[3], 且多为显性突变[4], 易于突变体的筛选。 EMS 已成功应用于水稻 Oryza sativa, 油菜 Brassi-ca napus 等 10 多种植物诱导突变体[5-15], 但在梨上的应用还未见报道。 为了探索适宜梨的突变体诱导技术体系, 本研究采用不同体积分数的 EMS 溶液处理杜梨 Pyrus betulaefolia 种子, 通过对种子萌发、 遗传位点变异率鉴定, 以及幼苗生长发育状态等检测, 筛选最适宜的 EMS 诱变处理体积分数, 以期获得梨的突变体, 为梨新品种的选育以及特异性状分子基础研究提供资源和种质材料。
1 材料与方法
1.1 材料
供试材料为杜梨种子, 采集于南京农业大学国家梨工程研究中心江浦实验基地。 EMS 药剂由美国Sigma 公司生产。
1.2 诱变材料的准备
使用砂藏法层积 2 000 粒杜梨种子, 温度为 4 ℃, 湿度为 60%, 层积时间为 40 d, 在发现种子有80%左右尖端露白时即可使用 EMS 药剂进行处理 。 处理前先用蒸馏水将河沙洗净 , 再用蒸馏水浸泡24 h。
1.3 EMS 处理
将杜梨种子随机分成 10 组, 200 粒·组-1, 放入锥形瓶中。 使用 0.1 mol·L-1, pH 7.0 的磷酸缓冲液配置 EMS 溶液, 各组 EMS 的体积分数依次为 0 (ck), 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%,0.8%和 0.9%。 将配置好的 EMS 溶液分别加入各组, 将锥形瓶口封住, 摇匀, 处理 24 h 后使用硫代硫酸钠清洗种子 15 min, 再用双蒸水清洗 15 min, 将种子晾干后, 播种, 种子出芽时统计出芽率。
1.4 基因组 DNA 的提取
随机选取梨苗 20 株·组-1, 于春季采集幼嫩叶片, 液氮速冻后保存于-70 ℃。 使用改良的十六烷基三甲基溴化铵(CTAB)法提取 DNA[16], 在 10.0 g·kg-1琼脂糖凝胶上进行电泳检测 DNA 质量, 使用 Nan-odrop 超微量分光光度计调整质量浓度至 50 mg·L-1, DNA 样品保存于-20 ℃。
1.5 SRAP 标记检测遗传变异频率
从通用的相关序列扩增多态性(sequence-related amplified polymorphism, SRAP)引物中筛选出多态性较好, 条带较为清晰的 10 对引物[16], 并对它们进行编号(表 1), 检测 EMS 处理后杜梨幼苗的遗传变异频率, 并进行重复验证。 聚合酶链式反应(PCR)体系(25.0 μL): 10×PCR 缓冲液(Mg2+) 2.0 μL, 2.5mmol·L-1dNTP 1.6 μL, 各引物 0.6 μL, 50~100 ng DNA 模板, Taq 酶 1.0×16.67 nkat(药剂购于 TakaRa公司)。 PCR 扩增所用程序: 94 ℃预变性 4 min, 94 ℃, 1 min, 35 ℃, 1 min, 72 ℃, 1 min, 5 个循环, 94 ℃变性 1 min, 55 ℃退火 1 min, 72 ℃ 1 min, 34 个循环后 72 ℃延伸 8 min, 应用 SensoquestLabcycle PCR 仪器进行扩增。
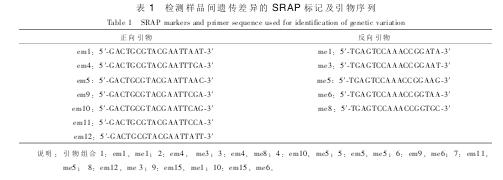
取 PCR 产物 1.5 uL 点样于质量浓度为 0.8%的非变性聚丙烯酰胺凝胶中电泳分离, 以恒定功率 80W, 电泳 2.5 h, 染色液染色 15 min, 显色液显色 15 min 后拍照记录。 观察电泳图谱, 将各对引物变异位点处有条带的记为 “0”, 无条带的记为 “1”, 将数据录入 Excel 表格中, 计算变异条带总数和变异平均值。
1.6 幼苗的田间生长情况调查统计
幼苗定植田间后, 定期管理幼苗, 分别于 2012 年 12 月和 2013 年 12 月, 测量所有梨苗的植株高度和节间长度, 计算各组植株高度均值和平均节间长度, 并进行差异显着性分析。
2 结果与分析
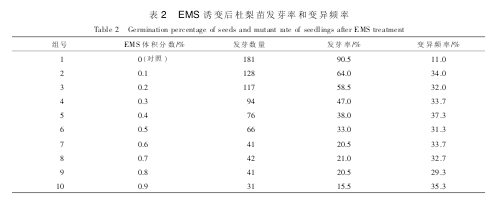
2.1 不同体积分数 EMS 处理对杜梨种子发芽率的影响
统计各组 EMS 处理后杜梨幼苗发芽率, 结果显示: 不同体积分数 EMS 处理降低了梨苗的发芽率。
各组中, 发芽率最高的组为对照组, 其发芽率为 90.5%; 发芽率最低的组为第 10 组(体积分数为 0.9%EMS), 发芽率仅为 15.5%。 从表 2 中可以看出: 在 EMS 体积分数为 0.1%~0.6%时, 随着体积分数升高,发芽率逐渐降低; 而在 EMS 体积分数为 0.7%和 0.8%时, 发芽率趋于平稳; 半致死剂量出现在 EMS 体积分数为 0.3%处理组样品, 该组出芽率为 47.0%; 临界致死剂量出现在 EMS 体积分数为 0.4%处理组样品, 该组出芽率为 38.0%。
2.2 SRAP 标记鉴定杜梨幼苗的 DNA 变异
利用筛选的 10 对 SRAP 标记通用引物对不同处理组的样本 DNA 进行鉴定, 统计各组幼苗的变异频率。 结果表明: 10 对引物总共检测到 15 个变异位点, 平均每对 1.5 个, 变异位点多出现在 100~500 bp扩增大小区间。 数据统计结果显示, EMS 的体积分数为 0.4%时, 变异频率最高, 为 37.3%(表 2)。 可见, EMS 处理梨种子使其产生了可鉴定的序列位点突变。 如图 1 所示: 为引物 em10-me5 检测对照组与0.4% EMS 处理组随机选取的 20 株幼苗的遗传突变扩增图谱, 可见 0.4%EMS 处理组在 100~250 bp 间产生了突变位点。 通过引物扩增的重复试验, 可以确定检测到的变异位点是稳定可靠的。
2.3 诱变植株的田间生长测量与分析
不同体积分数 EMS 处理后的幼苗定植田间后, 定期管理幼苗, 测量杜梨苗第 1 年和第 2 年停止生长时的植株高度和节间长度, 并计算各组植株高度均值的差异显着性以及平均节间长度(表 3)。 统计结果显示: 杜梨苗第 1 年和第 2 年停止生长时, 植物高度均值最高的组都为对照组, 其高度分别为 81.9cm 和 175.5 cm; 植物高度均值最低组则发生了变化, 第 1 年停止生长时最低组为第 4 组, EMS 体积分数为 0.3%, 其高度为 44.5 cm, 而第 2 年时, 最低组为第 8 组, EMS 体积分数为 0.7%, 其高度为 92.0cm; 杜梨苗第 1 年和第 2 年停止生长时, 各组株高均与对照组差异极显着(P<0.01), 可见 EMS 处理梨种子后都在一定程度上影响了梨苗的生长。 平均节间长度数据的统计结果显示: 杜梨连续 2 a 停止生长时, 对照组的节间长度都是最长的, 分别为 1.97 cm 和 3.10 cm。 第 1 年停止生长时最短组为第 6 组

EMS 体积分数为 0.5%, 其长度为 1.68 cm。 第 2 年时, 最短组为第 5 组, EMS 体积分数为 0.4%, 其长度为 2.56 cm; 第 1 年停止生长时, EMS 处理各组的梨苗节间长度差异不显着; 第 2 年停止生长时, 对照组与第 2, 4, 5, 7, 8, 9 组差异极显着(P<0.01)。
2.4 EMS 处理促进杜梨种子突变的最佳体积分数
诱变育种中一般采用植株半致死剂量或临界剂量作为诱变的最佳体积分数[17]。 杜梨苗的半致死剂量出现在第 4 组, EMS 处理体积分数为 0.3%; 临界剂量出现在第 5 组, EMS 体积分数为 0.4%。 经过SRAP 分子标记检测, 变异频率最高的组为第 5 组, EMS 处理体积分数正好为临界剂量。 在表型数据上, 虽然第 4 组的梨苗高度低于第 5 组, 但 2 组之间的差异并不显着; 而在节间长度方面, 2 组的长度较为接近。 因此, 综合以上数据分析, 确定 EMS 处理促进杜梨种子突变的最佳体积分数为 0.4%。
3 讨论
3.1 EMS 诱变植物产生不同类型的突变
EMS 是一种良好的化学诱变剂, Klmark于 1953 年最早报告了 EMS 对突变诱导的有效性。 其后 EMS被广泛应用于植物中, 其产生的突变类型较多。 例如抗逆类型突变, Zhou 等[5]使用 EMS 诱变水稻, 获得了抗盐性的突变植株; 品质和产量类型突变, Fang 等[8]使用 EMS 诱变花生 Arachis hypogaea, 获得高油酸突变体; 形态特征类型的突变, 这类突变是 EMS 诱变后突变最多的类型, 而且大致上都是以矮化为主, EMS 在许多植物[6-14]上都产生了不同程度的矮化突变体。 本实验中, 使用不同体积分数的 EMS 诱变杜梨种子后, 不仅产生了可检测的遗传变异, 各处理组在株高上显着低于对照组, 形态上发生了变化, 但要确定这些变异是否为可遗传的稳定变异, 还有待于进一步试验研究。
3.2 EMS 诱变植物的最佳体积分数
不同体积分数 EMS 诱变植物产生突变体效率不同。 Fang 等[8]使用 10.0 g·kg-1的 EMS 处理原本油酸含量 44.2%的花生品种, 得到了油酸含量超过 60%的突变体。 而 Zhou 等[5]使用体积分数为 0.5%的 EMS处理水稻种子, 获得了抗盐性较好的突变体。 我们使用不同体积分数的 EMS 处理杜梨种子, 结合分子和生理指标的鉴定, 获得了促进杜梨突变的最适宜 EMS 体积分数为 0.4%。 由此可见, EMS 处理在不同物种的最佳使用体积分数是有差异的, 需要针对不同物种进行优化和筛选。
3.3 EMS 诱变的分子标记鉴定
EMS 是一种烷化剂, 能够诱发基因突变, 多为点突变[4], 使用 DNA 分子标记的方法可以快速有效地鉴定出突变位点。 胡建斌等[18]使用 SRAP 分子标记技术检测到了 EMS 诱变黄瓜 Cucumis sativus 的变异位点。 殷冬梅等[19]使用随机扩增多态性 DNA(RAPD)分子标记技术检测到了 EMS 诱变花生的突变位点。 相比于其他分子标记, SRAP 分子标记的特点: 操作较为简单, 只涉及到 PCR 扩增; 引物片段较长, 重复性较好; 使用通用引物, 正反向引物可以随机组合; 检测结果中共显性标记占标记位点的比例较高[20-21], 在基因组中分布较为均匀, 更适用于检测农艺性状的差异[22]。 本试验中, 使用的 10 对通用SRAP 引物共检测到了 15 个突变位点, 检测效率较高, 可对筛选适宜的 EMS 体积分数提供可靠的数据支持。
3.4 EMS 矮化分子育种中起到重要作用
EMS 在农作物与蔬菜花卉中的应用较广 , 已构建了很多突变体库 。 由于木本植物生长周期较长,获得稳定遗传的时间较长, 所以在果树上的应用研究还比较少。 本研究中, 我们首次使用不同体积分数的 EMS 药剂诱变杜梨种子, 通过分子和生理数据的鉴定与分析, 得到了最佳的诱变处理体积分数, 其种子繁殖当代植株在形态上表现出了一定的变异特征, 相比于传统的杂交育种和自然突变体筛选, 化学诱变的效率更高。 本研究结果将为今后快速获得梨突变体提供可靠的理论基础和依据。
参考文献:
[1] 中华人民共和国农业部. 中国农业年鉴 2012[M]. 沈阳: 辽宁教育出版社, 2012: 214 - 215.
[2] 柴明良, 沈德绪. 中国梨育种的回顾和展望[J]. 果树学报, 2003, 20(5): 379 - 383.





