
1引言
过渡金属和重金属离子在环境科学、生命科学和化学中具有重要的作用[1],寻找能够简便地用于检测重金属和过渡金属离子的受体分子是一直以来人们关注的问题。Zn是人体所需的第二大过渡金属元素,大量地存在于人脑组织中,在新陈代谢中Zn与基因转录、酶的控制、细胞凋亡和神经元传输密切相关[2].在细胞中Zn的失调会引起婴儿腹泻、老年痴呆症、脑缺血和癫痫[3].另外,Cu作为人体所需的第三大过渡元素,在机体的基本生理过程中发挥着重要的作用[4],Cu含量不足会导致生长和新陈代谢紊乱[5];然而,当机体内Cu过量时,会产生毒性,引起神经变性疾病,使细胞受损和坏死,导致脏器功能损伤[6].因此,设计合成用于专一识别、检测Zn2+和Cu2+的受体分子具有重要的应用价值。
腙类化合物是希夫碱的一种,分子中含有-CH?N-NH-结构单元,使其具有抗病毒、抗肿瘤、抗癌、抗氧化、杀菌和消炎等生物活性[7],在有机合成、生物学、医药、农药、超分子化学、金属共价有机骨架、动态组合化学、染料和空穴传输等领域有广泛的应用[8].另外,腙类化合物还可以用作分析试剂、油墨、颜料和荧光材料[9].由于其独特的化学结构,强的配位能力、多样化的配位形式、良好的亲脂性[10],能与生物体细胞中的多种金属离子形成稳定的配合物[11-14],且能提供广泛的光谱应用[15],因此在分析测试和光化学领域有重要的应用。基于此,本文设计合成了8-羟基-2-喹啉甲醛-4-硝基苯腙(1),并采用紫外-可见光谱法初步研究了在二甲亚砜-甲醇混合溶剂中苯腙1对13种金属离子的光谱敏感性和识别机制。
2实验
2.1主要仪器与试剂
Micro型元素分析仪(德国Vario公司);AdvanceⅢ500型核磁共振仪(瑞士Bruker公司);U-2900型紫外-可见分光光度计(日本Hitachi公司);XT5型显微熔点测定仪(北京市科仪电光仪器厂).8-羟基喹哪啶(98%,百灵威药品),乙酸酐、二氧化硒、无水乙醇、二氧六环、二甲亚砜均为天津化学试剂研究所的分析纯试剂;4-硝基苯肼、LiCl、KCl、MgCl2、CaCl2、MnCl2、CdCl2、CoCl2、NiCl2、CuCl2、ZnCl2、HgCl2、FeCl2、FeCl3均为国药集团化学试剂有限公司的分析纯产品;色谱甲醇由天津光复精细化工研究所生产。
2.2合成
2.2.12-甲酰基-8-羟基喹啉的合成
制备2-甲基-8-乙酰氧基喹啉:在50mL烧瓶中加入8-羟基喹哪啶5.2g(0.03mol)、乙酸酐16mL,加热回流3h,反应结束冷却后,滴加10%的氢氧化钠溶液调pH值至中性,出现大量黄绿色沉淀,抽滤,干燥,得到产物5g,m.p.62.8~64.2℃。本文产物未加进一步提纯用于下一步反应。
制备2-甲酰基-8-乙酰氧基喹啉:将二氧六环60mL、二氧化硒1.66g(0.015mol)加入到250mL三口烧瓶中,取上步产物2-甲基-8-乙酰氧基喹啉2.5g(0.012mol)溶解在15mL二氧六环中,将其缓慢滴加到烧瓶中,温度控制在50~55℃,滴加完毕后将温度升高至75~80℃,继续反应2h.反应液冷却后抽滤,滤液旋蒸,待剩余少量二氧六环时,将其倒入70mL蒸馏水中,得到淡黄色固体沉淀,抽滤,干燥,用正庚烷重结晶,得橙黄色晶体1.6g,产率66%,m.p.96.3~97.3℃.
计算2-甲酰基-8-乙酰氧基喹啉(C12H9O3N)的元素含量:C66.973%,H4.215%,N6.508%;元素分析结果为C66.95%,H4.196%,N6.49%.制备2-甲酰基-8-羟基喹啉:将1.6g(0.008mol)2-甲酰基-8-乙酰氧基喹啉溶于装有25mL甲苯的250mL三口烧瓶中,冰水浴中磁力搅拌下滴加氢氧化钾(2.24g,0.04mol)的水溶液160mL.15min内滴完后,室温下继续反应0.5h.用分液漏斗分液,收集下层溶液,用20%乙酸水溶液调pH值至中性,有大量淡黄色固体生成,抽滤,干燥,用蒸馏水重结晶得到淡黄色晶体0.9g,产率65%,m.p.94.5~95.1℃。
计算2-甲酰基-8-羟基喹啉(C10H7O2N)的元素含量:C69.359%,H4.074%,N8.088%;元素分析结果为C69.45%,H3.960%,N7.99%.1HNMR(500MHz,TMS,CDCl3)δ:10.23(s,1H,CHO);8.32(d,J=8.5Hz,1H,QL-3-H);8.15(s,1H,OH);8.06(d,J=8.5Hz,1H,QL-4-H);7.63(t,J=8.0Hz,1H,QL-6-H);7.43(d,J=8.5Hz,1H,QL-7-H);7.28(d,J=8.0Hz,1H,QL-5-H).
2.2.28-羟基-2-喹啉甲醛-4-硝基苯腙(1)的合成在50mL单口烧瓶中加入89mg4-硝基苯肼和10mL去水乙醇,搅拌15min后加入溶有100mg2-甲酰基-8-羟基喹啉的5mL无水乙醇溶液,室温下继续搅拌3h.将反应混合物抽滤得到橙黄色固体,干燥后用二氧六环重结晶得到黄色结晶86mg,产率48%,m.p.264.9~266.5℃.
计算喹啉苯腙1(C16H12O3N4)的元素含量:C62.335%,H3.923%,N18.173%,元素分析结果为C62.26%,H4.013%,N18.06%.1HNMR(500MHz,TMS,DMSO-d6)δ:11.72(s,1H,NHNC);9.76(s,1H,OH);8.31(d,J=8.5Hz,1H,QL-3-H);8.24(s,1H,NCH-QL);8.17~8.21(m,3H,2Ar-H,QL-4-H);7.39~7.45(m,2H,QL-6-H,QL-7-H);7.31(d,J=8.5Hz,2H,2Ar-H);7.11~7.12(m,1H,QL-5-H).
2.3光谱测定基于溶解性和光谱灵敏度,确定采用体积比为1∶9的二甲亚砜-甲醇溶剂作为本文中全部光谱测定的溶剂;配制浓度由高到低递变的系列苯腙1溶液,测试其在紫外-可见光谱上被检测的最低极限浓度为8×10-6mol/L.用5mL容量瓶配制含有相同浓度的苯腙1且分别含不同金属离子的系列溶液用于光谱测定以考察其识别性质;为保证实验的一致性,配制的系列溶液均在相同的配制条件、环境及平衡时间内完成,并在相同的光谱条件下进行测试。竞争实验:在苯腙1及可识别的金属离子共存下的溶液中加入其它金属离子,分别测试每种竞争离子对苯腙1识别体系光谱的影响。
3结果与讨论
3.1苯腙1对金属离子的识别及竞争实验实验测定了含有相同浓度苯腙1且分别含有浓度为8×10-4mol/L的13种不同金属离子的紫外-可见光谱(图2).图2中c1=8×10-6mol/L,cn+M/c1=100.从图2可以看出,在V(二甲亚砜)/V(甲醇)=1∶9的混合溶剂中,苯腙1在413nm处有吸收,溶液颜色为黄色。当分别加入Li+、K+、Mg2+、Ca2+、Cd2+、Mn2+、Ni2+、Co2+、Hg2+、Fe2+和Fe3+时,苯腙1溶液的颜色未发生变化,而且相应光谱图中显示的吸收峰位和强度也均未有明显的改变;但是当加入Cu2+或Zn2+后,苯腙1溶液的颜色分别变为橙色和红色,其光谱在413nm处的吸收峰强度有不同程度的降低,同时Cu2+的加入使苯腙1在485nm处产生了新的吸收峰,而Zn2+的加入使其在508nm处产生吸收峰。由此说明,合成的喹啉苯腙1对Cu2+和Zn2+有特殊的识别能力。
为了进一步考察其它离子存在时对苯腙1检测Cu2+和Zn2+的光谱信号的干扰情况,特别设计了竞争实验[16-17],图3用柱状图给出了竞争干扰实验的光谱测定结果。
由图3可见,当苯腙1溶液中加入Cu2+或Zn2+后,其紫外-可见光谱在485nm处的吸收强度均有显著的增强,而在加入Cu2+的体系中再分别添加其它金属离子时(包括Zn2+),其485nm处的吸收峰强度基本保持不变,这说明其它金属离子不干扰苯腙1对Cu2+的识别。所以苯腙1可以作为检测Cu2+的优良传感器。在苯腙1-Zn2+的体系中分别添加其它金属离子时,其紫外-可见光谱在508nm处的吸收强度除Cu2+外与未添加时基本一致。添加Cu2+后,苯腙1仍然显示485nm处的吸收峰,说明Cu2+有较强的竞争优势,也表明苯腙1对Zn2+识别作用受Cu2+的干扰而不受其它金属离子的干扰。
3.2识别机理的探讨为了进一步探讨苯腙1对Cu2+和Zn2+的识别机理,分别测定了固定苯腙1浓度逐渐增加Cu2+或Zn2+浓度时溶液的紫外-可见光谱,所测结果由图4(a)和图5(a)给出。图4中c1=8.0855×10-6mol/L,cCu2+/c1(a→j):0,0.03,0.08,0.15,0.3,0.5,0.8,1.3,3.0和4.0;图5中c1=8.0855×10-6mol/L,cZn2+/c1(a→n):0,5,8,15,20,25,35,50,75,82,100,120,165和200.苯腙1与Cu2+或Zn2+键合的化学计量比及稳定常数采用Benesi-Hildebrand方程[18-19]拟合计算获得。
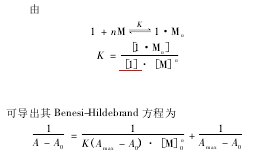

A0为苯腙1的吸收强度,A为加入金属离子后苯腙1的吸收强度,Amax为加入过量金属离子后苯腙1的最大吸收强度,K为稳定常数,[M]0为金属离子的总浓度。
从图4(a)和图5(a)可以看出,随着Cu2+或Zn2+浓度的增大,苯腙1在413nm处的吸收峰逐渐降低,并产生微弱的红移,加入Cu2+使苯腙1在485nm处产生新的吸收峰并且其吸收强度在逐渐增大,444nm处出现了等吸收点,表明苯腙1与Cu2+形成了较稳定的配合物;Zn2+的加入使苯腙1在508nm处的吸收峰逐渐升高,在452nm处出现了等吸收点,同样表明了其键合物的形成。从加入Cu2+和Zn2+的相对数量上可以看出,Cu2+对苯腙1的光谱影响灵敏度较高。苯腙1对Cu2+具有较低的检出限,而对Zn2+的检出限较高。
图4(a)和图5(a)显示,在混合溶剂中,苯腙1在413nm处存在特征吸收峰,该吸收峰可被指认为苯腙1分子整体的共轭π-π*跃迁吸收[20].当苯腙1与Cu2+或Zn2+键合后,会产生一种与从配体到金属离子的电荷转移(L→M2+)相偶联的QL-C?N-基团的共轭π-π*跃迁[21],键合的结果使分子结构的刚性增加,有利于形成更大的共轭结构,因而使苯腙1在加入Cu2+或Zn2+后在更长波长处产生吸收。通过图4(a)和图5(a)获得的光谱滴定数据,利用Benesi-Hilde-brand方程线性拟合苯腙1与Cu2+和Zn2+键合的化学计量比及稳定常数的结果分别由图4(b)和图5(b)给出,拟合结果显示,苯腙1与Cu2+和Zn2+键合的化学计量比分别为1∶1和1∶2,其稳定常数(lgK)分别为5.7和6.9,两种金属离子分别与苯腙1键合后的余价可能被溶剂分子或Cl-所饱和。
4结论
在二甲亚砜-甲醇混合溶剂中,用紫外-可见光谱法考察了8-羟基-2-喹啉甲醛-4-硝基苯腙对13种金属离子的识别性能,结果显示,该喹啉苯腙仅对Cu2+和Zn2+有识别能力,Cu2+和Zn2+的加入能使苯腙1的溶液由黄色分别转变为橙色和红色,其光谱反映出苯腙1在413nm处的吸收峰强度降低,分别在485和508nm处产生新的吸收峰。通过光谱滴定数据采用Benesi-Hildebrand方程线性拟合得到苯腙1与Cu2+和Zn2+键合的化学计量比分别为1∶1和1∶2.干扰实验证明,采用光谱法利用苯腙1检测体系中Zn2+时不会受到除Cu2+以外的其它金属离子的影响,检测Cu2+时不受其它金属离子的干扰,具有较高的选择性和较低的检出限。由此表明合成的喹啉苯腙1是一种较为理想的Cu2+和Zn2+化学传感器。





