摘 要: 以CH<sub>2</sub>ClCH<sub>2</sub>Cl作溶剂, (E) -1, 4-二芳基烯炔在FeBr<sub>3</sub>催化下, 可以顺利发生分子内环化反应, 得到 (E) -3-苯乙烯基异香豆素 (2a~2c) , 产率42%~60%, 其产物结构经<sup>1 </sup>H NMR、<sup>13 </sup>C NMR和GC-MS表征。
关键词: 溴化铁; 1, 4-二芳基烯炔; 酯环化; (E) -3-苯乙烯基异香豆素;
Abstract: FeBr<sub>3</sub>-catalyzed intramolecular cyclization reactions of (E) -1, 4-diarylenynes were carried out smoothly so as to produce 3-styrylisocoumarins in 42%~60%yields using CH<sub>2</sub>ClCH<sub>2</sub>Cl as solvent.The chemical structures were characterized by <sup>1 </sup>H NMR, <sup>13 </sup>C NMR and GC-MS.
Keyword: ferric (Ⅲ) bromide; 1, 4-diarylenynes; cyclization; 3-styrylisocoumarins;
(E) -3-苯乙烯基异香豆素 (学名:3-苯乙烯基-1 H-异色烯-1-酮) 广泛分布于自然界中, 是许多具有生理活性的化合物和药物的基本骨架, 也是一些天然产物的基本结构, 其合成受到化学专家们的关注[1,2,3,4,5]。目前, 合成 (E) -3-苯乙烯基异香豆素的方法有二类。一类是通过邻苯二甲酸与苯基丙烯酸酯或苯基丙烯酰氯衍生物的环化缩合反应, 但反应需要200℃的高温[6,7], 条件非常苛刻。另一类方法就是过渡金属钯催化[ (4-苯基丁-1, 3-二烯-2-基) 氧基]硅烷与邻溴苯甲酸甲酯环化合成 (E) -3-苯乙烯基异香豆素[8], 这一方法的化学产率虽高, 但钯等都是贵金属, 价格昂贵。我们[9]曾报道了溴化铁作为催化剂可以有效合成异香豆素。本文在溴化铁催化下合成了 (E) -3-苯乙烯基异香豆素 (2a~2c) 。
1 实验部分
1.1 仪器及试剂
Bruker DPX-400型500MHz核磁共振仪 (内标为TMS, 溶剂为CDCl3) ;SHIMADAZU GC-MSQP2010联用仪;Kofler型熔点仪 (温度未经校正) 。
试剂均为分析纯, 市售。
1.2 合成
1.2.1 (E) -2- (4-苯基丁-3-苯-1-炔小基) 苯甲酸甲酯 (1a) 的合成
在圆底烧瓶中, 依次加入邻碘苯甲酸2.48g (10mmol) 、甲醇 (10mL) 、浓硫酸 (1mL) 混合, 回流3h直到底物反应完时停止反应[通过薄层色谱 (TLC) 板和气质联用分析]。然后反应混合物通过水洗, 饱和NaHCO3溶液洗涤, 乙醚萃取蒸发得到粗产品, 粗产品通过柱层析法[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =15∶1]分离得到邻碘苯甲酸甲酯2.23g, 产率85%[9]。
在干燥的反应器中, 依次加入邻碘苯甲酸甲酯2.23g (8.5 mmol) , 三甲基硅乙炔1.00g (10.2mmol) , 二氯二 (三苯基膦) 钯[Pd (PPh3) 2Cl2, 0.030g (0.5mol%) ], 碘化亚铜[CuI, 0.016g (1mol%) ], 三乙胺30mL混合, 氩气保护后, 在室温下搅拌, 利用TLC板和GC-MS监测反应至反应完全;用短硅胶柱进行粗过滤, 饱和食盐水洗涤, 乙醚萃取 (20mL×3) , 无水硫酸镁干燥, 减压蒸干得粗产品;最后用硅胶层析柱[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =10∶1]提纯分离得到2-三甲基硅乙炔基苯甲酸甲酯1.58g, 产率80%[10]。

在干燥的圆底烧瓶中, 依次加入2-三甲基硅乙炔基苯甲酸甲酯1.58g (6.8mmol) , 二氯甲烷20mL, 甲醇20mL和20mL 1mol/L的KOH溶液, 在室温下搅拌20h, 利用TLC板和GC-MS监测反应至反应完全;用短硅胶柱进行粗过滤, 水洗涤, 乙醚萃取3次, 无水硫酸镁干燥, 减压蒸干得粗产品;最后用硅胶层析柱[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =10∶1]提纯分离得到2-乙炔基苯甲酸甲酯0.925g, 产率85%[10]。
在干燥的反应器中, 依次加入2-乙炔基苯甲酸甲酯0.925g (5.78mmol) , 1, 2-二氯乙烯5.549g (57.8mmol) , Pd (PPh3) 2Cl2 0.405g (10 mol) , CuI 0.110g (10mol) , 吡啶0.913g (2equiv.) 乙醚15mL混合, 在室温下搅拌, 利用TLC板和GC-MS监测反应至反应完全;用短硅胶柱进行粗过滤[乙醚洗涤 (10mL×3) ], 减压蒸干得粗产品;最后用硅胶层析柱[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =10∶1]提纯分离得到 (E) -2- (4-氯丁-3-烯-1-炔基) 苯甲酸甲酯1.078g, 产率85%。
在干燥的三口瓶中, 依次加入 (E) -2- (4-氯丁-3-烯-1-炔基) 苯甲酸甲酯0.220g (1mmol) , 苯硼酸0.183g (1.5mmol) , Pd (PPh3) 40.058g (5mol) , K2CO30.276g (2equiv.) , 甲苯 (10mL) 和甲醇 (5mL) 混合后, 加热回流搅拌, 利用薄层层析法 (TLC) 板和气相色谱-质谱联用仪 (GC-MS) 监测反应至反应完全;用短硅胶柱进行粗过滤[乙醚洗涤 (10mL×3) ], 减压蒸干得到粗产品;最后用硅胶层析柱[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =10∶1]提纯分离得到 (E) -2- (4-苯基丁-3-烯-1-炔-1-基) 苯甲酸甲酯 (1a) , 0.210g, 产率80%[10]。
1.2.2 (E) -3-苯乙烯基异香豆素 (2a~2c) 的合成
在干燥的Schlenk管中, 依次加入 (E) -2- (4-苯基丁-3-苯-1-炔小基) 苯甲酸甲酯 (1a) 0.078 6g (0.3 mmol) 、FeBr30.045 g (0.15 mmol) 和CH2ClCH2Cl 4mL, 氩气保护后, 在80℃下搅拌, 利用 (TLC) 板和气相色谱-质谱联用仪 (GC-MS) 监测反应至反应完全.用短硅胶柱进行粗过滤[乙醚洗涤 (5mL×3) ], 减压蒸干得粗产品;最后用硅胶层析柱[洗脱剂:V (正已烷) ∶V (乙酸乙酯) =4∶1]提纯得到目标产物 (E) -3-苯乙烯基-1 H-异色烯-1-酮 (2a) [8]。白色固体, 产率54%。m.p.119~121℃;1 H NMR (400MHz, CDCl3) δ:8.32 (d, J=7.9Hz, 1H) , 7.71 (t, J=8.9Hz, 1H) , 7.60~7.29 (m, 8H) , 6.73 (d, J=16 Hz, 1H) , 6.49 (s, 1H) ;13C NMR (100MHz, CDCl3) δ:162.1, 152.6, 137.6, 135.8, 134.8, 132.9, 129.8, 128.8, 128.1, 127.1, 127.0, 125.7, 120.8, 119.4, 105.7;IRν:1 720cm-1;GC-MS (EI, 70eV) m/z (%) :271 (M+, 100) 。
按照 (2a) 类似的方法合成 (E) -3- (4-甲氧基苯乙烯基) -1 H-异色烯-1-酮 (2b) :黄色固体, 产率60%。m.p.143~145℃;1 H NMR (400 MHz, CDCl3) δ:8.25 (d, J=10.4Hz, 1H) , 7.65 (t, J=10.0 Hz, 1H) , 7.46~7.36 (m, 5H) , 6.90 (d, J=11.6 Hz, 2H) , 6.55 (d, J=21.2 Hz, 1H) , 6.38 (s, 1H) , 3.83 (s, 3H) ;13C NMR (125MHz, CDCl3) δ:162.2, 160.3, 153.0, 137.8, 134.8, 132.6, 129.8, 128.6, 127.7, 125.6, 124.8, 120.7, 117.2, 114.3, 104.8, 55.4;IRν:1 722cm-1。Anal.calcd for C18H14O3:C 77.68, H 5.07, found C 77.53, H 5.01。
按照 (2a) 类似的方法合成 (E) -3- (2-甲氧基苯乙烯基) -1 H-异色烯-1-酮 (2c) :黄色固体, 产率42%。m.p.129~131℃;1 H NMR (400 MHz, CDCl3) δ:8.30 (d, J=10.4 Hz, 1H) , 7.81~7.66 (m, 2H) , 7.56~7.40 (m, 3H) , 7.34~7.26 (m, 1H) , 7.02~6.91 (m, 2H) , 6.84 (d, J=21.6Hz, 1H) , 6.47 (s, 1H) , 3.93 (s, 3H) ;13C NMR (100 MHz, CDCl3) δ:162.2, 157.8, 153.3, 137.8, 134.7, 129.9, 129.8, 128.5, 127.8, 127.8, 125.7, 124.9, 120.7, 120.3, 120.2, 111.1, 105.4, 55.4;IRν:1 890, 1 483cm-1。Anal.calcd for C18H14O3:C 77.68, H5.07, found C 77.52, H 5.00。
2 结果与讨论
2.1 反应条件优化
以 (E) -2- (4-苯基丁-3-烯-1-炔-1-基) 苯甲酸甲酯的环化反应为模板, 分别研究了反应温度和催化剂溴化铁用量对反应的影响, 结果如表1和表2所示。
表1 反应温度对反应的影响a Table 1 Influence of temperature on the reaction
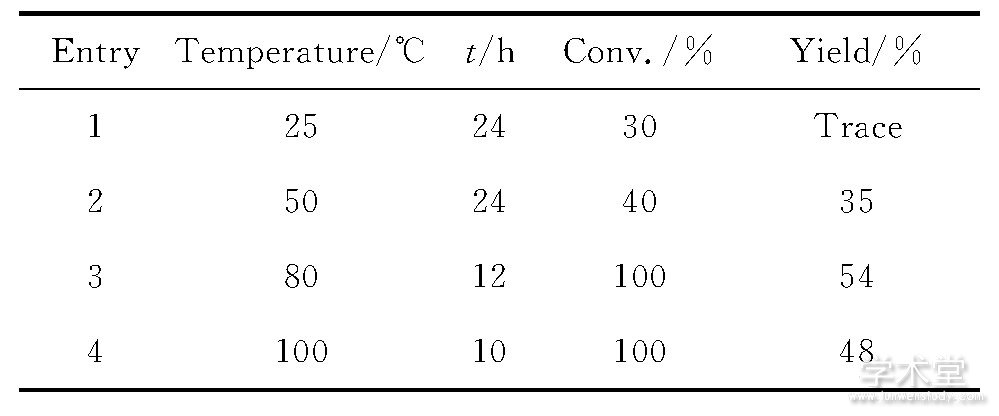
aReaction conditions:1a (0.3mmol) , FeBr3 (0.15mmol) in 1, 2-dichloroethane (DCE) under argon atmosphere.
表2 催化剂用量对反应的影响a Table 2 Influence of catalytic amount on the reaction
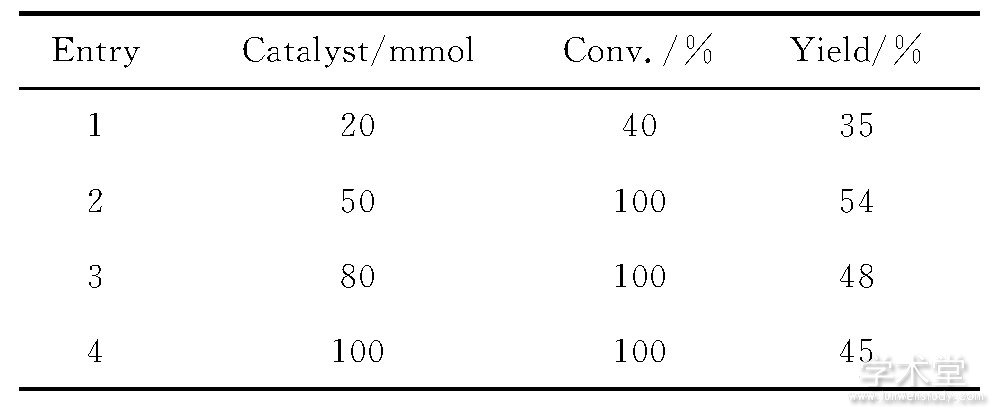
aReaction conditions:1a (0.3mmol) in DCE at 80℃temperature under argon atmosphere for 12h.
从表1中可以看出, 在相同用量溴化铁和溶剂条件下, 温度太低, 不但反应转化率低而且产率也不高 (表1, Entries 1~2) ;但是, 当反应温度太高, 反应的化学选择性却降低 (表1, Entry 4) 。通过对反应温度的考察, 发现该反应的最佳反应温度为80℃ (表1, Entry 3) 。
在温度为80℃下, 考察了催化剂溴化铁用量对反应的影响 (表2) 。实验结果表明, 催化剂溴化铁的用量对该反应的转化率与产率都有很大的影响。从表2中可以看出, 催化剂溴化铁用量太少, 反应转化率与产率都很低 (表2, Entry 1) ;但是催化剂溴化铁用量太多, 则产率大大降低。
通过对上述反应条件的考察, 合成化合物2a的最佳反应条件为:反应温度80℃, 催化剂溴化铁用量0.50mmol。
2.2 取代基对环化反应的影响
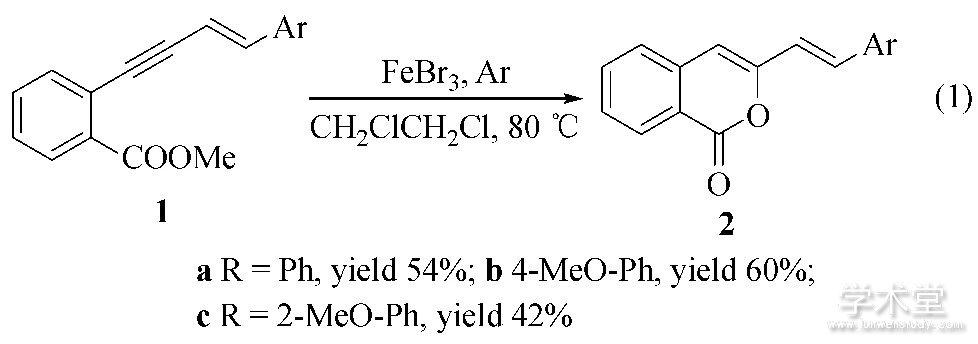
在优化的反应条件下, 研究了一系列的邻位苯乙烯乙炔基苯环上的取代基对环化反应的影响 (Eq.1) 。实验结果表明, 在50mmol的FeBr3催化下, 分子内环化反应都能顺利进行, 高立体选择性得到目标产物。炔烃末端所连苯环上接有对位甲氧基的反应产率 (60%) 比接有邻位甲氧基的反应产率 (42%) 高, 这可能是由于位阻效应的影响;但接有对位氰基的底物, 反应几乎不进行, 这说明吸电子基团不有利于亲核加成反应的进行。
3 结论
以CH2ClCH2Cl作溶剂, (E) -1, 4-二芳基烯炔在FeBr3催化下, 可以顺利发生分子内环化反应得到 (E) -3-苯乙烯基异香豆素 (2a~2c) , 产率42%~60%。该方法条件简单、催化剂溴化铁价廉易得、不需要加入配体、反应选择性好。
参考文献:
[1]Iinuma M, Tosa H, Tanaka T, et al.Chemical Constituents in the Genus Achlys[J].J Nat Prod, 1993, 56 (9) :1 638-1 641.
[2]Saeed A, Rafique H, Ashraf Z.Synthesis and Antibacterial Evaluation of Typharin Analog:6, 8-Dihydroxy-7-methyl-3-styryl-3, 4-dihydroisocoumarin[J].J Asian Nat Prod Res, 2013, 15 (2) :130-135.
[3]Wang L, Wang S.Synthesis of Isocoumarins via Palladium Catalyzed Reactions of Methy 2- (2′, 2′-Dibromovinyl) benzoates[J].Tetrahedron Lett, 1998, 39 (42) :7 625-7 628.
[4]Shi Y, Roth K E, Ramgren S D, et al.Catalyzed Catalysis Using Carbophilic Lewis Acidic Gold and Lewis Basic Palladium:Synthesis of Substituted Butenolides and Isocoumarins[J].J Am Chem Soc, 2009, 131 (50) :18 022-18 023.
[5]Wang L L, Zhang X J, Jiang Y W, et al.An Efficient Synthesis of Isocoumarins via a Cul Catalyzed Cascade Reaction Process[J].Sci China Ser B:Chem, 2009, 52 (10) :1 616-1 621 (in Chinese) . (王蕾蕾, 张晓菁, 蒋咏文, 等.经由铜催化的串联反应高效合成异香豆素[J].中国科学:B辑, 2009, 52 (10) :1 616-1 621.)
[6]Saeed A, Mahesar P A.Total Synthesis of Achlisocoumarins I-II from Achlys Triphylla[J].Tetrahedron, 2014, 70 (7) :1 401-1 407.
[7]Saeed A, Rama N H, Arfan M.An Efficient Synthesis of 3, 5-Dimethoxyhomophthalic Acid, a Key Intermediate for Synthesis of Natural Isocoumarins[J].J Heterocycl Chem, 2003, 40 (3) :519-522.
[8]Kale A P, Pawar G G, Kapur M.Regioselectivity Switch Achieved in the Palladium Catalyzedα-Arylation of Enones by Employing the Modified KuwajimaUrabe Conditions[J].Org Lett, 2012, 14 (7) :1 808-1 811
[9]Tang J S, Zheng M.Catalytic Synthesis of Isocoumarins by FeBr3[J].Chin J Synth Chem, 2011, 19 (2) :258-260 (in Chinese) . (唐建生, 郑敏.溴化铁催化合成异香豆素[J].合成化学, 2011, 19 (2) :258-260.)
[10]Zhao G K, Yuan L Z, Rouder D, et al.A Convenient Metal-Free Synthesis of (E) -3-Styrylisocoumarins Through Annulation of (E) -1, 4-Diarylenynes[J].Synthesis, 2016, 48 (19) :3 382-3 392





