
随着全球气候变迁、干旱发生频繁,水分短缺已成为抑制植物光合作用的主要环境因子之一[1,2],有研究表明当植物受到水分胁迫时,气孔因素( 气孔关闭引起 CO2供应受阻) 、非气孔因素( 叶肉细胞光合活性下降) 以及气孔与非气孔共同因素导致植物的净光合速率下降[3 -5],也有研究表明严重水分胁迫可导致叶绿体光合机构的破坏[6],PSⅡ放氧复合物的损伤,PSⅡ捕光色素蛋白复合物各组成成分的变化,光合CO2同化效率降低及叶绿素荧光变化[7,8],因此植物叶片的光合荧光特性可以在一定程度上反映植物对干旱逆境的响应.水分( 尤其是土壤水分) 对植物的生长、蒸腾、光合等生理过程具有明显的影响[1,9],而植物光合生理过程对土壤有限缺水有一定的适应性和抵抗性,植物的光合生理活动并非在土壤水分充足时最活跃,而是在适度的水分亏缺范围之内最活跃[10,11].近几年来,不同土壤水分条件下植物的生理生态特性的研究在国内日益受到重视,植物对干旱逆境的响应与适应已成为研究热点之一[1,12].
清香木( Pistacia weinmannifolia) 为漆树科、黄连木属,常绿灌木或小乔木,偶数羽状复叶互生,有小叶4 - 9 对,长圆形或倒卵状长圆形; 自然树形美,寿命长,目前未发现" 倒叶" 和病虫害现象,是理想的盆景树种,亦是优秀的绿化树种.清香木在云南干热河谷分布广泛[13],该地气候炎热干燥,降雨稀少,土壤干旱贫瘠,是我国造林极端困难的少数地区之一[14].前人对清香木研究较少,且主要针对清香木抗旱性机理方面[13,14],而对清香木在水分胁迫下光合荧光特性的研究更是罕见,据此探讨清香木光合作用的抑制机理及其与土壤水分定量关系的研究尚未见报道.文中通过盆栽控水模拟比较研究不同土壤水分条件下清香木叶片的光合荧光特性,初步探讨清香木对生境中水分变化的反应和适应机制,为清香木科学补水及干热河谷造林绿化提供科学依据.
1 材料与方法
1. 1 试验地概况
试验地( 102°45'E,25°04'N) 位于西南林业大学校园内,海拔 1946m.该地春季干燥少雨,日温变化大,月平均气温多在 20℃以下; 夏季雨量集中,降雨量占全年雨量的 60% 以上,平均气温 22℃; 秋冬季日照充足,天睛少雨,每月晴天平均在 20 天左右,日照 230 小时左右,雨日 4 天左右,全月降雨量仅占全年的3 - 5% .年平均气温 15℃ ,年均日照 2200 小时,年降水量 1035mm,年温差为全国最小,日温差较大.
1. 2 实验设计
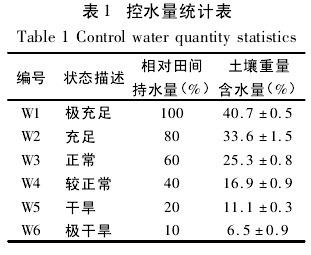
实验采用盆栽法栽植、常规管理的2 年生清香木苗木( 高约70cm) 为材料,盆栽土壤为昆明常见红壤,质地粘重,密度 0. 93g·cm^- 3,田间持水量 40. 7%,速效氮、磷、钾分别为 58. 14、5. 25、55. 76mg·kg^- 1,pH值 4. 9.2013 年 10 月 18 日自苗圃中选择长势优良、树体大小基本一致的盆栽清香木 18 盆,放置于空旷、光线好的试验地,每 3 盆为一组,共 6 组.实验共设置 6 个不同土壤水分梯度处理( 表 1) : 极充足( W1) 、充足( W2) 、正常( W3) 、较正常( W4) 、干旱( W5) 、极端干旱( W6) ,分别控制水分为土壤田间持水量的 100%、80%、60%、40%、20%、10% ,用 HH2 型土壤湿度计测得土壤重量含水量分别为 40. 7 ± 0.5% 、33. 6 ± 1. 5% 、25. 3 ± 0. 8% 、16. 9 ± 0. 9% 、11. 1 ± 0. 3% 、6. 5 ±0. 9% ,每天 18: 00 左右定时定量对应编号补水,下雨天进行遮雨处理,以确保不同处理土壤含水量稳定.植物充分适应各自土壤水分处理后( 实验标准管理 1. 5 个月) 开始实验,每组处理 3 盆 3 株清香木,每株清香木选择 3 枝叶,测定其光合参数和叶绿素荧光参数.
1. 3 测定方法
1. 3. 1 光合参数测定
选择晴朗天气( 2013 年 12 月 2 日) ,用 LI -6400 便携式光合系统测定仪( 利用自然光源和田间 CO2)对不同土壤水分处理下清香木叶片的光合参数进行测定.测量时选用 6400 -15 小叶叶室,测定面积用叶室中清香木叶片面积占叶室面积( 0. 785cm²) 的百分比估算.每株清香木选择 3 片光照均一的叶片并标上记号,于 10:00 -11:00 测量.测定指标包括清香木叶片的 Pn、Tr、Gs、PAR、Ci 等,并对 WUE = Pn/Tr 进行考察.
1. 3. 2 叶绿素荧光参数测定
叶绿素荧光相关参数用 Li -6400 光合仪的标准荧光叶室进行测定.12 月 4 日 22:30( 叶片已进行充分的暗适应) ,针对事先标记好的叶片,测定其最小初始荧光 Fo 和最大荧光 Fm.12 月5 日上午11:00( 光适应状态) ,打开活化光,将标记过的叶片依次置于荧光叶室内,测定光下最小荧光 Fo'、光下最大荧光Fm'、稳态荧光 Ft.按以下公式计算:
光化学最大量子效率: Fv/Fm = ( Fm - Fo) /Fm
有效荧光产量: Yield( △Fv/Fm) = ( Fm'- Ft) /Fm'
电子传递速率: ETR = Yield × PAR ×0. 84 ×0. 5
光化学淬灭系数: qP = ( Fm' - Ft) /( Fm' - Fo')
非光化学淬灭系数: NPQ = ( Fm - Fm') /Fm' = Fm/Fm' - 1
1. 4 数据处理
采用 Excel2003 及 SPSS11. 5 进行数据分析和制图.多重比较采用 LSD 法在 Sig =0. 05 显着水平下对不同数据间的差异进行检验比较.
2 结果与分析
2. 1 不同土壤水分处理对清香木叶片光合作用特征参数的影响.
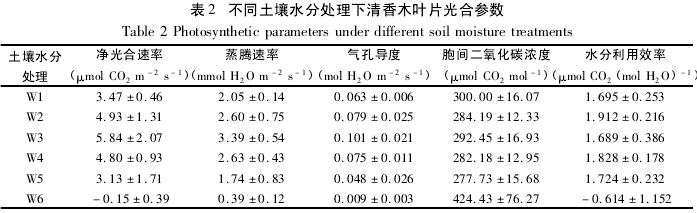
净光合速率和蒸腾速率是植物的两个基本生理特征[15],通常 Pn 高时 Tr 也较高[16].如表 2,W1 -W3,Pn 和 Tr 逐渐增大; W3 - W6,Pn 和 Tr 逐渐减小.Pn 和 Tr 在不同土壤水分处理下各自相互间差异性一致,W1、W2、W3、W4、W5 均极显着高于 W6( p <0. 01) ,W3 显着高于 W1( p <0. 05) ,W5 显着低于 W2、W3、W4( p < 0. 05) ,但 W5 与 W1 无明显差异( p > 0. 05) .WUE 值由 Pn 和 Tr 决定,极干旱( W6) 条件下WUE 值为负( 表 2) ,显着低于前五组 WUE 值( p < 0. 05) ,而 W1 - W5 条件下,WUE 值虽有波动,但相互之间无明显差异( p >0. 05) .Gs 表示气孔张开的程度,Gs 较大时植物能够顺利地进行水、气交换,Gs 较小时抑制水分的流失[17].
如表 2,清香木 Gs 在 W3 土壤水分处理下值最大,且显着高于其他各组处理( p <0. 05) ,土壤含水量较高时( W1 - W2) ,Gs 无显着差异( p >0. 05) ,但土壤含水量较低时( W4 - W6) ,Gs 显着减小,且相互之间差异显着( p <0. 05) .
不同土壤水分处理下清香木叶片 Ci 变化趋势与 Pn 基本相反,如表 2,Pn 相对较大时( W1 - W5) ,Ci较低,而当 Pn 显着减小时( W6) ,Ci 显着增大,Ci 在 W1 - W5 相互之间无明显差异,但 W6 时显着增大( p< 0. 05) .
2. 2 不同土壤水分处理对清香木叶片叶绿素荧光参数的影响
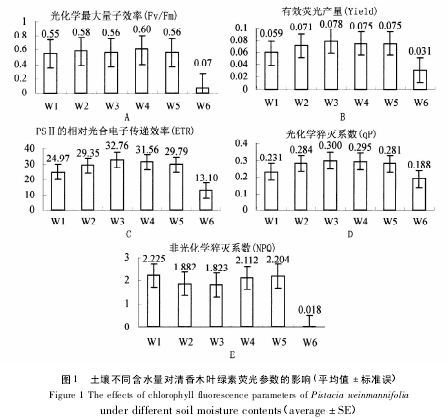
据图1A,清香木叶片 Fv/Fm 值在 W4 时最大,且在 W1、W2、W3、W4、W5 相互之间无明显差异( P >0.05) ,W6 时最小,仅为最大值的 11. 7% ,W6 与前五组处理差异极显着( P < 0. 01) ; 据图 1B,W1 - W3,清香木叶片的 Yield 逐渐变大,W3 - W6 逐渐变小,且在 W6 处明显降低,Yield 在 W1 - W5 依次变化之间差异不显着( P >0. 05) ,但 W1 与 W3 差异显着( P =0. 032) ,W6 与 W1、W2、W3、W4、W5 之间差异极显着( P <0. 05) ; 据图 1C,实验中清香木叶片的 ETR 在 W3 土壤水分处理情况下达到最大值,W1、W2、W4、W5、W6情况下分别为最大值的 76. 20%、89. 58%、96. 33%、90. 93%、39. 98%,W1 与 W3、W6 差异显着( P < 0.05) ,且 W2、W3、W4、W5 相互之间无明显差异( P > 0. 05) ; 据图 1D,不同土壤水分处理下清香木叶片 qP值不同,前五组土壤水分处理相互之间无明显差异( P > 0. 05) ,W6 与 W2、W3、W4、W5 差异显着( P < 0.05) ,但 W6 与 W1 无明显差异( P = 0. 32 > 0. 05) ; 据图 1E,W1 - W3,清香木叶片的 NPQ 值逐渐变小,W3- W5 逐渐变大,但相互之间无明显差异( P > 0. 05) ,W6 土壤水分处理下 NPQ 值显着下降,此时 PSⅡ受到破坏,热耗散能力下降.
3 讨论
大量研究表明引起 Pn 降低的气孔和非气孔限制因素可以根据植物叶片 Ci 的变化来判断,当 Pn 下降伴随着 Ci 降低时可以认为 Pn 的下降主要是受气孔限制所致,如果 Pn 下降的同时 Ci 升高或者不变,则主要是非气孔限制因素所致[18,19].实验中,W1 - W2,Gs 缓慢增大,Pn 和 Tr 也逐渐增大,而 Ci 缓慢减小,此时主要是非气孔因素限制清香木叶片光合作用; W2 - W5,Gs、Pn、Tr 和 Ci 的变化趋势基本一致,相关性检验分析知 Pn 和 Tr 与 Gs 显着正相关,相关系数分别达0. 960 和0. 990,主要是气孔因素影响清香木叶片光合作用; W6 时 Pn 显着减小,Ci 却显着增大,此时光合速率降低主要是由于非气孔因素引起的.裴斌对沙棘叶片的研究表明土壤干旱胁迫加剧过程中有一临界点,临界点之前光合作用受气孔因素限制,之后受非气孔因素限制[20],这与文中研究结果一致.
植物的 WUE 高,表明固定单位质量 CO2所需的水量小,植物的节水能力强,耐旱,生产力高[21].W1- W5,WUE 相互之间无明显差异,说明在未达到干旱胁迫阈值之前,清香木具有较高的水分利用效率,Ci值在 W1 - W5 相互之间无明显差异也可能与较高的 WUE 有关.W6 时清香木叶片 WUE 值为负,同时Pn、Tr、Gs 值显着降低,说明 W6 已超出清香木干旱胁迫阈值,即清香木干旱胁迫阈值在土壤重量含水量为 11. 1%和 6. 5%之间.W3 - W6,WUE 先增大后减小,这与 Heitholt 的发现一致,适度干旱能使植物水分利用效率提高[22],对山杏、辽东楤木等较多植物的研究也有类似规律[20].
叶绿素荧光参数在植物光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用,与反映光合作用"表观性"的光合气体交换参数相比更具有反映光合作用"内在性"的特点,任何环境因子对光合作用的影响都可通过叶片叶绿素荧光动力学反映出来[23].Fv/Fm 是暗适应条件下 PSⅡ的最大光化学效率,反映了 PSⅡ中心最大光能转化效率,持续稳定的 Fv/Fm 值表明光反应系统未受到损伤[24 -26],胁迫条件下该参数明显下降.实验中,W4 时清香木叶片的 Fv/Fm 值最大,而 Fv/Fm 在前五组处理相互之间无明显差异,说明清香木在 W1 - W5 水分处理下不受胁迫或轻微胁迫,其光反应系统Ⅱ未受到破坏,但随着干旱加剧( W6) ,Fv/Fm 值极显着下降,这时 PSⅡ受损.Yield 和 ETR 显着正相关,变化趋势一致,随着土壤水分含量由高到低均先增大后减小,在 W3 处理下值最大,且 W1 与 W3 差异显着,说明在土壤水分过于充足会胁迫清香木生长,这时适当降低土壤水分可提高清香木叶片的光合作用效率.极干旱( W6) 破坏了 PSⅡ,PSⅡ反应中心光子需求量减少,进而表观电子传递效率下降,导致 W6 水分处理下 Yield、ETR 显着降低.
qP 是 PSⅡ天线色素吸收的光能用于光化学电子传递的份额,qP 降低反映 PSⅡ中开放的反应中心比例和参与 CO2固定的电子减少[27].NPQ 反映的是天线色素吸收的光能不能用于电子传递而以热形式耗散掉的光能部分,是植物保护 PSⅡ的重要机制[28].W1 - W3,土壤水分胁迫逐渐缓解,PSⅡ反应中心开放程度变大,天线色素吸收光能更多的用于光化学电子传递,更多的电子参与 CO2固定,所以 qP 逐渐增大,NPQ 逐渐减小,清香木光合作用效率增加; W3 - W5,NPQ 逐渐增大,植株逐渐受到干旱胁迫,但能通过保持较高的热耗散维持光合结构 PSⅡ保持正常,Fv/Fm 值和 qP 值与各自最大值无显着差异也表明 PSⅡ反应中心未受破坏,但极干旱下( W6) ,NPQ 突然显着减小( 为 W5 的 0. 83%) ,此时清香木叶片的光合结构PSⅡ已受到损坏,对热能的耗散能力也几乎丧失殆尽,清香木叶片也退绿枯萎.
4 结论
( 1) 土壤水分极充足和极干旱时非气孔因素导致清香木叶片光合作用降低,土壤水分相对正常时气孔因素限制清香木叶片光合作用.
( 2) 清香木耐干旱,土壤干旱未达到阈值前具有较高的水分利用效率,适度干旱可以提高清香木的光合作用效率和水分利用效率.
( 3) 极干旱破坏清香木叶片的光合结构 PSⅡ,使植物枯萎死亡.云南红壤生长的清香木,其干旱胁迫阈值在土壤重量含水量为 11. 1 和 6. 5%之间.
参考文献
[1]李林芝,张德罡,辛晓平,等. 呼伦贝尔草甸草原不同土壤水分梯度下羊草的光合特性[J]. 生态学报,2009,29( 10) : 5271 -5279.
[2]何炎红,郭连生,田有亮. 白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J]. 西北植物学报,2005,25( 11) : 2226 -2233.
[3]Teskey R O,Fites J A,Samuelson L J,et al. Stomatal limitations to net photosynthesis in Pinus taeda L. under different environmental conditions[J]. Tree Physiology,1986,2( 1/2/3) : 131 -142.
[4]安文明,师庆东,张毓涛,等. 克拉玛依人工林俄罗斯杨( Populus russkii) 与新疆杨( P. alba var. Pyramidalis) 光合特性分析[J]. 干旱区资源与环境,2012,26( 9) : 67 -72.
[5]Zhang S Y,Zhang G C,Gu S Y,et al. Critical responses of photosynthetic efficiency of goldspur apple tree to soil water variation insemiarid loesshilly area[J]. Photosynthetica,2010,48( 4) : 589 - 595.
[6]黄雪清,焦德茂. 转 C4 光合酶基因水稻株系的抗光氧化特性[J]. 植物生理学报,2001,27( 5) : 393 -400.
[7]肖春旺. 施水量对毛乌素沙地 4 种优势植物叶绿素荧光的影响[J]. 草地学报,2001,9( 4) : 296 -301.
[8]Kevin O. Imaging of chlorophyll a fluorescence: theoretical and practical aspects of an emerging technique for the monitoring ofphotosynthetic per-formance[J]. Journal of Experimental Botany,2004,55: 1195 - 1205.
[9]段爱国,崔永忠,张建国,等. 干热河谷植被恢复树种光合与水分生理特性的灌溉效应[J]. 干旱区资源与环境,2013,27( 12) : 112 -118.
[10]Montanaro G,Dichio B,Xiloyannis C. Shade mitigates photoinhibition and enhances water use efficiency in kiwifruit under drought[J]. Photo-synthetica,2009,47( 3) : 363 - 371.
[11]李扬,黄建辉. 库布齐沙漠中甘草对不同水分和养分供应的光合生理响应[J]. 植物生态学报,2009,33( 6) : 1112 -1124.
[12]欧立军,陈波,邹学校. 干旱对辣椒光合作用及相关生理特性的影响[J]. 生态学报,2012,32( 8) : 2612 -2619.
[13]赵琳,郎南军,温绍龙,等. 云南干热河谷 4 种植物抗旱机理的研究[J]. 西部林业科学,2006,35( 2) : 9 -16.
[14]贾利强,李吉跃,郎南军,等. 水分胁迫对黄连木、清香木幼苗的影响[J]. 北京林业大学学报,2003,25( 3) : 55 -59.
[15]杨泽粟,张强,赵鸿,等. 半干旱地区旱作春小麦净光合速率和蒸腾速率对微气象条件的响应[J]. 干旱区资源与环境,2014,28( 7) :56 - 61.
[16]刘惠,赵平,蔡锡安,等. 坡地和沼泽地野牡丹( Melastoma candidum) 叶片的解剖特征与气孔气体交换特性[J]. 热带亚热带植物学报,2005,13( 2) : 109 - 116.
[17]云文丽,侯琼,王海梅,等. 河套灌区食用向日葵光合作用的光响应曲线分析[J]. 中国油料作物学报,2013,35( 4) : 405 -410.
[18]运向军,卫智军,杨静,等. 禁牧休牧短花针茅草主要植物种光和特性研究[J]. 干旱区资源与环境,2010,24( 7) : 138 -143.
[19]Chartzoulakis K,Patakas A,Kofidis G,et al. Water stress affects leaf anatomy,gas exchange,water relations and growth of two avocado culti-vars[J]. Scientia Horticulturae,2002,95: 39 - 50.
[20]裴斌,张光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33( 5) : 1386 -1396.
[21]孙学凯,范志平,王红,等. 科尔沁沙地复叶槭等 3 个阔叶树种的光和特性及水分利用效率[J]. 干旱区资源与环境,2008,22( 10) :188 - 194.
[22]Heitholt J J. Water use efficiency and dry matter distribution in nitrogen and water - stressed winter wheat[J]. Agronomy Journal,1989,81:464 - 469.
[23]王文林,万寅婧,刘波,等. 土壤逐渐干旱对菖蒲生长及光合荧光特性的影响[J]. 生态学报,2013,33( 13) : 3933 -3940.
[24]Jones D T,Sah J P,Ross M S,et al. Responses of twelve tree species common in Everglades tree islands to simulated hydrologic regimes[J].Wetlands,2006,26( 3) : 830 - 844.
[25]Lavinsky A O,De Souza Sant C,Mielke M S,et al. Effects of light availability and soil flooding on growth and photosynthetic characteristics ofGenipa Americana L. seedlings[J]. New Forests,2007,34( 1) : 41 - 50.
[26]尹海龙,田长彦. 根施甜菜碱对盐胁迫下玉米幼苗根系生长与光合特性的影响[J]. 干旱区资源与环境,2013,27( 9) : 113 -118.
[27]柏祥,陈开宁,黄蔚,等. 黄菖蒲和美人蕉对水生梯度的响应差异[J]. 生态学杂志,2011,30( 3) : 464 -470.
[28]赵青松,李萍萍,王纪章,等. 工厂化黄瓜穴盘育苗昼温适应性[J]. 应用生态学报,2011,22( 9) : 2343 -2347.





