原标题:水分胁迫对欧美I-107杨树苗生理生化特性的影响
提 要: 以欧美 I -107 杨扦插苗为试材,研究不同程度干旱胁迫处理对杨树苗叶片生理生化特性的影响.结果表明: 随着水分胁迫程度的增加和时间的延长,杨树苗叶片的相对含水量、自由水含量显着降低; 束缚水含量、束缚水/自由水比值在轻度胁迫下逐渐升高,而在中度和重度胁迫下先升后降; 脯氨酸含量在轻度胁迫下与对照差异不显着,在中度和重度胁迫下显着高于对照; 可溶性蛋白在轻度胁迫下逐渐升高,而在中度和重度胁迫下先升后降; SOD 和 CAT 活性先上升后下降,丙二醛含量显着增加.可见,I -107 杨树苗在轻度水分胁迫下具有相对较强的抗氧化防御和渗透调节机制,而在中度和重度胁迫下明显减弱.
关键词: 水分胁迫; I -107 欧美杨; 束缚水/自由水; 保护酶; 丙二醛
近年全球的气候变化使得干旱问题日益严重[1 -2].前人研究表明,植物在遭受干旱等逆境时,体内活性氧代谢系统失调,导致活性氧过量积累而造成伤害.植物会形成内源保护系统,包括抗氧化酶类和非酶抗氧化剂,以维护体内活性氧代谢的平衡.同时,植物在水分亏缺的状态下,体内会主动积累可溶性糖、脯氨酸等进行渗透调节,以维持细胞膨压,即植物对不良环境的适应性反应[3].因此,研究水分胁迫下植物体内抗氧化酶类活性及渗透调节物质含量的变化,是了解植物在长期进化过程中所演化出适应干旱的机制和策略的重要基础.
杨树是北方平原与沙区营造防护林和用材林的主要树种,品种繁多,栽培面积大,在生态环境治理和解决木材短缺方面均占有重要地位.但是,在没有灌溉条件的干旱、半干旱地区,杨树生长受到了严重的抑制,从而限制了这种优良树种的经济和生态效益的发挥[4].近年来,已有报道从水分胁迫角度,对杨树的耗水规律和水分利用效率[5]、光合特性[6]等方面进行了研究.但是,对杨树在水分胁迫下保护酶活性、膜脂过氧化作用及渗透调节能力的研究报道相对较少,而明确这些化学物质对水分胁迫的反应是从生理机制上了解杨树抗旱性的重要内容.为此,文中通过盆栽试验,观测了 4 种水分处理对 I -107 欧美杨树苗叶片组织含水量、渗透调节物质、保护酶活性和膜脂过氧化作用的影响,旨在为进一步了解水分胁迫对杨树影响的机理以及认识杨树对水分环境的适应能力提供理论依据.
1 材料与方法
1. 1 试验设计
试验地点设在山东省林业科学研究院试验苗圃,供试土壤为潮土,土壤速效氮 27. 96mg·kg^- 1,速效磷 26. 52mg·kg^- 1,速效钾 79mg·kg^- 1,有机质含量为 6. 83g·kg^- 1.所用化肥为尿素、过磷酸钙和氯化钾,用量分别为 7. 72、16. 17 和 6. 57 g.杨树扦插苗品种为 I - 107 欧美杨,接穗长 15 ~ 16cm,茎粗 2cm.
试验用盆为购自市场的塑料盆,盆高20cm,宽30cm.于2011 年4 月13 日盆栽试验时,将肥料与土壤充分混匀后装盆,每盆装土 10. 5kg,进行正常栽培管理.
试验于 2011 年 6 月 19 日进行,每盆充分灌溉,使土壤含水量一致,停止灌溉后等土壤自然落干进行水分胁迫处理,经测定田间持水量为 32. 65%.试验共设 4 个土壤水分处理: 1) 正常水分处理( 对照,CK) ,田间持水量的 65% ~ 75% ; 2) 轻度水分胁迫( LS) ,田间持水量的 55% ~ 65% ; 3) 中度水分胁迫( MS) ,田间持水量的 45% ~55%; 4) 重度水分胁迫( SS) ,田间持水量的 35% ~45% .每处理 40 盆,每盆 1 株.用称重法控制土壤含水量,使之保持相应的土壤湿度,每天早晚称重两次,补充当天失去的水分,使各处理保持设定的含水量.在胁迫开始后的第15d、30d、45d、60d、75d、90d、105d 和120d,每处理分别选择 5 株幼苗,取每株幼苗从顶端往下第 6 至第 8 片完全舒展并且成熟的功能叶,采样后放入冰壶中,迅速带回实验室进行相关指标的测定.
1. 2 研究方法
( 1) 叶片组织含水量: 采用烘干法测定,相对含水量( %) = ( 鲜生物量 - 干生物量) /( 饱和鲜生物量- 干生物量) × 100% ; 总含水量( % ) = ( 初始鲜生物量 - 干生物量) / 初始鲜生物量 × 100% ; 自由水含量采用称量法测定[7]; 束缚水含量( %) = 总含水量 - 自由水含量.最后,计算束缚水/自由水.
( 2) 生理指标测定: 叶片脯氨酸含量采用磺基水杨酸提取茚三酮显色法测定; 可溶性蛋白含量采用考马斯亮蓝 G -250 法测定[8]; SOD 活性采用氮蓝四唑( NBT) 光还原法测定; CAT 活性采用紫外分光光度法测定[8]; 丙二醛( MDA) 含量采用硫代巴比妥酸法测定[8].
2 结果与分析
2. 1 水分胁迫对杨树苗叶片组织含水量的影响
如表 1 所示,随着时间的延长和胁迫程度的加深,杨树苗叶片相对含水量呈现逐渐降低的趋势.在轻度胁迫下,胁迫初期( 15d) 的相对含水量与对照差异不显着,而在中度和重度胁迫下显着低于对照.
随着胁迫时间的延长,各水分处理之间的差异越来越大,在胁迫末期( 120d) ,与对照相比,轻度、中度和重度胁迫下的相对含水量分别下降了 6. 12%、17. 45% 和 23. 56%.可见,随着干旱强度的加剧,相对含水量逐渐降低.
从表 1 还可以看出 ,在轻度胁迫下,随着胁迫时间的延长,杨树苗叶片的自由水含量逐渐降低,而束缚水含量、束缚水/自由水比值逐渐升高,在胁迫末期( 120d) 与对照达到了显着差异,这是植物对非生物胁迫做出的有效响应机制之一.在中度和重度胁迫下,自由水含量下降幅度更大,而束缚水含量、束缚水/自由水比值呈先升高后降低的趋势,其中,中度胁迫下在胁迫 60d时,束缚水含量、束缚水/自由水比值达到最大,而重度胁迫下在胁迫45d 时就达到了最大,之后均开始下降.
2. 2 水分胁迫对杨树苗叶片渗透调节物质含量的影响
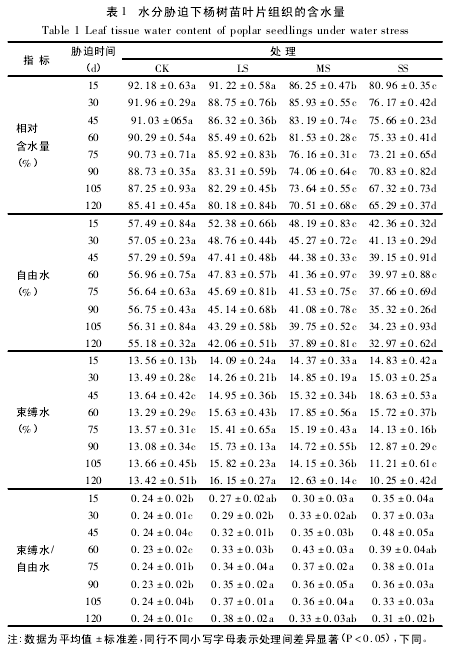
从图 1 可知,在三种水分胁迫条件下,杨树苗叶片中脯氨酸含量均表现出逐渐升高的趋势.其中在轻度胁迫下,脯氨酸含量与对照差异不显着,而中度和重度胁迫下均显着高于对照.在胁迫末期( 120d) ,对照、轻度、中度和重度胁迫下脯氨酸含量分别为胁迫初期( 15d) 的 1. 38、1. 43、1. 90 和 2. 55 倍,而轻度、中度和重度胁迫下的脯氨酸含量分别为对照的 1. 07、1. 64 和 2. 10 倍 ( 图 1A) .
随着时间的延长和胁迫程度的加深,可溶性蛋白含量在轻度胁迫下呈逐渐升高的趋势,而在中度和重度胁迫下先升后降.在整个试验过程中,轻度、中度和重度胁迫下的可溶性蛋白平均含量分别为对照的117. 49% 、164. 73% 和 179. 64% ( 图 1B) .
2. 3 水分胁迫对杨树苗叶片抗氧化酶活性的影响
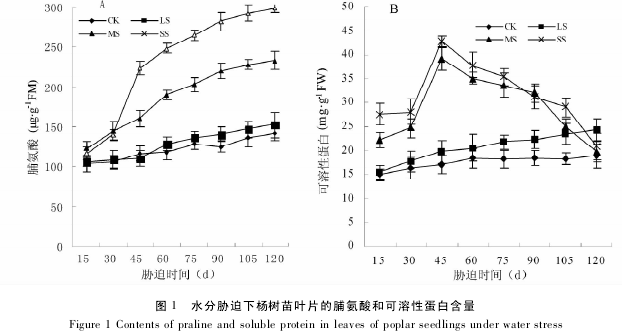
图 2 所示,在整个试验期间,随着胁迫程度的加深和时间的延长,杨树苗叶片 SOD 和 CAT 活性均呈先上升后下降的趋势.这说明一定强度的水分胁迫可使杨树苗叶片的抗氧化酶 SOD 和 CAT 活性上升;但严重的水分胁迫可能抑制了 SOD 和 CAT 活性,使之降低.
轻度胁迫下,SOD 活性在胁迫 75d 时达到最大值,CAT 活性在胁迫 60d 时达最大值; 中度胁迫下,SOD和 CAT 分别在胁迫 45d 和 30d 时活性达到最大; 重度胁迫下,SOD 和 CAT 活性均在胁迫 30d 时就达到了最大值.在整个试验期间,随着胁迫程度的加剧,各胁迫处理的 SOD 和 CAT 活性的平均值逐渐降低,并且差异达显着水平.
2. 4 水分胁迫对杨树苗叶片丙二醛含量的影响
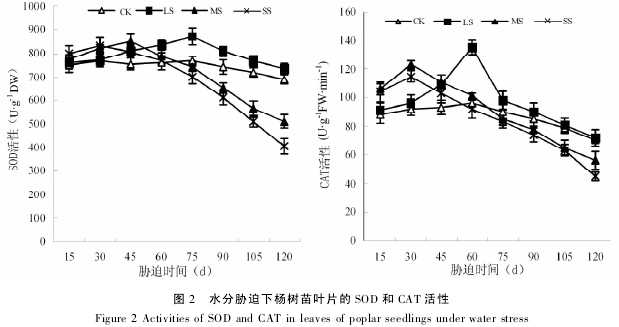
从图 3 可见,各胁迫处理的MDA 含量在胁迫期间随着时间的延长逐渐升高,在胁迫末期( 120d)均达到最大,并显着高于对照.同胁迫初期( 15d) 相比,轻度、中度和重度胁迫在 胁 迫 末 期 ( 120d) 的MDA 含量分别提高 105. 36% 、120.38% 和 143. 92% ; 在整个试验期间,轻度、中度和重度胁迫的 MDA 含量平均值分别比对照提高 65. 31、183.12% 和 208. 78% .可见,随着胁迫强度的加深和时间的延长,杨树苗叶片 MDA 含量的增加幅度越来越大.
3讨论
3. 1 水分胁迫与叶片组织含水量
文中试验表明,杨树苗叶片的相对含水量随水分胁迫的加剧呈下降趋势,且胁迫越严重下降幅度越大.这与刘锦春等[9]在柏木幼苗上的研究结果一致.本试验还发现,在轻度胁迫下,杨树苗叶片的自由水含量逐渐降低,束缚水含量及束缚水/自由水比值逐渐升高,表明在水分胁迫条件下,杨树苗将叶片组织内的部分自由水转化为束缚水,自由水含量降低有利于减缓新陈代谢,而束缚水含量和束缚水/自由水比值的升高,能够增加组织的渗透势,使原生质胶体吸附的水分增多,植物的保水能力提高,有效减轻水分胁迫造成的伤害.但在中度和重度胁迫下,束缚水含量、束缚水/自由水比值呈先升后降的趋势,说明随着水分胁迫程度的加剧和时间的延长,干旱逆境对杨树苗的伤害已经超过了它的自我调节阈值,所以束缚水含量和束缚水/自由水比值开始下降,这也说明杨树苗忍耐水分胁迫的能力是有限的.而刘艳等[10]在甘草幼苗上的研究表明,束缚水/自由水比值并没有下降,这与本试验结果不完全一致,可能与胁迫强度、胁迫时间和植物抗旱性等不同有关.
3. 2 水分胁迫与叶片渗透调节物质
脯氨酸和可溶性蛋白是植物体内重要的渗透调节物质.文中研究得出,在中度和重度水分胁迫下,杨树苗叶片的脯氨酸含量显着增加,这与范苏鲁等[11]在大丽花上的研究结果一致.而在轻度胁迫下,脯氨酸含量与对照差异不显着,可能是因为轻度水分胁迫对杨树苗的伤害较小.
葛体达等[12]研究认为,可溶性蛋白含量在水分胁迫下下降.也有研究表明,干旱抑制蛋白质的合成并诱导蛋白质的降解,从而使植株体内的总蛋白质含量降低[13].文中研究表明,在轻度胁迫下,杨树苗的可溶性蛋白含量逐渐升高.这可能是杨树苗通过增加可溶性蛋白含量来增强渗透调节能力,维持较低的渗透势,以抵抗水分胁迫带来的伤害[14].也可能是由于胁迫下促进某些特殊种类的蛋白质即"逆境蛋白"或"胁迫蛋白"合成的结果[12].但是在中度和重度胁迫下,随着胁迫时间的延长,杨树苗叶片的可溶性蛋白含量呈先增加后降低趋势.这可能是因为胁迫强度的加剧,超过了植物所能耐受的阈值,干旱可能抑制了蛋白质的合成,或者加速了其降解,导致蛋白质含量下降.
3. 3 水分胁迫与叶片抗氧化酶系统
相关研究[15 -16]表明,植物 SOD 和 CAT 活性随水分胁迫的加强或时间的延长,表现为连续上升或先上升后下降的变化趋势.文中研究发现,随着水分胁迫时间的延长,SOD 和 CAT 活性都呈现出先升后降的趋势.说明水分胁迫在初期激发了杨树苗叶片体内保护酶系统的活性来做出保护性反应; 但随着胁迫时间的延长,各胁迫处理的保护酶活性在达到最大值后均呈现下降趋势,可能是由于过多活性氧或过氧化氢的积累,超过保护酶系的阈值,打破了彼此的动态平衡,从而导致酶光钝化、新酶合成被抑制[17].本试验还得出,轻度胁迫下,MDA 含量的上升幅度较小,而中度和重度胁迫下的上升幅度较大.这与整个胁迫试验期间各胁迫处理的 SOD 和 CAT 活性的平均值变化规律( 轻度胁迫 > 中度胁迫 > 重度胁迫) 保持一致,进一步说明了中度和重度胁迫对杨树苗的细胞膜伤害较大,已经超出它的耐受限度,植物代谢紊乱发生膜脂过氧化,质膜遭到损害,大量离子外渗.这与刘锦春等[9]和王玉魁等[16]的研究结果一致.
4 结论
随着水分胁迫程度的增加和时间的延长,杨树苗叶片的相对含水量、自由水含量显着降低; 束缚水含量、束缚水/自由水比值在轻度胁迫下逐渐升高,而在中度和重度胁迫下先升后降; 脯氨酸含量在轻度胁迫下与对照无显着差异,在中度和重度胁迫下显着高于对照; 可溶性蛋白含量在轻度胁迫下逐渐升高,而在中度和重度胁迫下呈先升高后降低的趋势; SOD 和 CAT 活性先升后降,两种酶对水分胁迫和活性氧的响应存在一定差异; 丙二醛含量显着增加,质膜遭到损害,大量离子外渗,重度胁迫下质膜的损害最严重.综合分析认为,I -107 杨树苗在轻度水分胁迫下具有相对较强的抗氧化防御和渗透调节机制,而在中度和重度胁迫下明显减弱.
参考文献
[1]文琦,刘彦随. 北方干旱化对水土资源与粮食安全的影响及适应 - 以陕北地区为例[J]. 干旱区资源与环境,2008,22( 7) : 7 -11
[2]Wang W X,Vinocur B,Altman A. Plant responses to drought,salinity and extreme temperatures: towards genetic engineering for stress tolerance[J]. Planta,2003,218: 1 -14.
[3]姚觉,于晓英,邱收,等. 植物抗旱机理研究进展[J]. 华北农学报,2007,22( S1) : 51 -56.
[4]侯庆春,韩蕊莲. 黄土高原植被建设中的有关问题[J]. 水土保持通报,2000,20( 2) : 53 -56
[5]杨建伟,梁宗锁,韩蕊莲,等. 不同干旱土壤条件下杨树的耗水规律及水分利用效率研究[J]. 植物生态学报,2004,28( 5) : 630 -636.
[6]付士磊,周永斌,何兴元,等. 干旱胁迫对杨树光合生理指标的影响[J]. 应用生态学报,2006,17( 11) : 2016 -2019.
[7]刘向莉,高丽红,刘明池. 植物组织中自由水和束缚水含量测定方法的改进[J]. 中国蔬菜,2005( 4) : 9 -11.
[8]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000.
[9]刘锦春,钟章成,何跃军. 干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系统的影响[J]. 应用生态学报,2011,22( 11) : 2836 -2840.
[10]刘艳,陈贵林,蔡贵芳,等. 干旱胁迫对甘草幼苗生长和渗透调节物质含量的影响[J]. 西北植物学报,2011,31( 11) : 2259 -2264.
[11]范苏鲁,苑兆和,冯立娟,等. 干旱胁迫对大丽花生理生化指标的影响[J]. 应用生态学报,2011,22( 3) : 651 -657.
[12]葛体达,隋方功,白莉萍,等. 水分胁迫下夏玉米根叶保护酶活性变化及其对膜脂过氧化作用的影响[J]. 中国农业科学,2005,38( 5) : 922 -928.
[13]魏良民. 几种旱生植物碳水化合物和蛋白质变化的研究[J]. 干旱区研究,1991,8( 4) : 38 -41.
[14]邵艳军,山仑,李广敏. 干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J]. 中国生态农业学报,2006,14( 1) : 68- 70.
[15]王东清,李国旗,苏德喜. 干旱胁迫对两种罗布麻渗透调节物质积累和保护酶活性的影响[J]. 干旱区资源与环境,2012,26( 12) : 177- 181.
[16]王玉魁,阎艳霞,余新晓,等. 干旱胁迫下灰白滨藜保护酶活性及抗旱生理特性研究[J]. 干旱区资源与环境,2010,24( 10) : 122 -126.
[17]Dat J F,Lopez - Delgado H,Foyer C H,et al. Parallel changes in H2O2and catalase during thermotolerance induced by salicylic acid or heatacclimation in mustard seedlings[J]. Plant Physiology,1998,16: 1351 - 1357.





