摘 要: 对基因工程抗体的种类以及筛选制备进行详细介绍,并对目前其在小分子识别中的研究进行梳理总结,分析基因工程抗体在识别小分子方面的优势,对应用中存在的问题进行讨论,希望对基因工程抗体在小分子识别中的进一步应用和产品研发提供一些思路。
关键词: 基因工程抗体; 小分子; 抗体库技术; 体外展示技术; 检测;
Abstract: The types of genetically engineered antibodies with preparation and selection were introduced. Current researches on small molecule detection were also summarized. The advantages of genetically engineered antibodies in recognizing small molecules were analyzed and the problems in application were discussed to provide some ideas for the further adhibition and product development.
Keyword: genetically engineered antibody; small molecule; antibody library technique; in vitro display technology; detection;
基因工程抗体,也称重组抗体,是通过基因工程和重组抗体技术获得的高质量第三代抗体,是从杂交瘤、免疫脾细胞、外周血淋巴细胞等中提取m RNA,反转录成c DNA,PCR扩增出抗体基因,按一定方式连接到表达载体中,在适当的细胞中表达并折叠成有功能的抗体分子片段。相对于杂交瘤技术需要几个月以上时间才能生产抗体,基因工程抗体仅需几周就能在细菌、酵母或其他细胞中产生[1],并基本消除抗体的免疫原性,生产工艺简单,廉价易得,应用前景广阔。
基因工程抗体已用于治疗、诊断、检测等领域的药物或产品开发,涉及对小分子的识别。小于1 ku的小分子,包括寡肽、寡糖、寡核苷酸、维生素、矿物质、小分子团水、动植物的代谢产物等,不能单独诱导免疫反应产生抗体。这些小分子通常与载体蛋白缀合以触发免疫反应,因此易产生载体效应,难以获得高特异性抗体。基因工程抗体与体外展示技术结合可完全排除载体蛋白的干扰。在构建抗体文库[2]和大规模淘选时使用不同的载体蛋白,能快速富集仅识别小分子特异性抗体。通过改变淘选条件,可在增强特异性的同时提高抗体的稳定性和亲和力[3]。
1 、基因工程抗体种类
根据抗体基因的不同来源,基因工程抗体可分为嵌合抗体、改型抗体、全人源化抗体等。嵌合抗体基因通常由鼠源可变区基因和人源恒定区基因拼接而成,保留高特异性和亲和力的同时大大降低了异源抗体引起的不良反应。改型抗体是将鼠源互补决定区基因接入人抗体骨架得到的抗体,可基本消除免疫原性。全人源化抗体的基因全部来自人抗体基因。
根据抗体结构,基因工程抗体包括抗原结合片段(Fragment antigen-binding,Fab)、单链抗体(Singlechain variable fragment,sc Fv)、单域抗体(Single-domain antibody,sd Ab)等(图1)[4]。Fab是抗体上与抗原结合的区域,包含轻链可变区(VL)、恒定区和重链可变区(VH)、CH1区。与Ig(约155 ku)相比,Fab体积小,易于在细菌系统中表达,组织穿透能力强[5];与其他重组抗体相比,Fab免疫原性低、亲和力高,近几年广泛应用于预防、诊断、治疗等领域。sc Fv是VH与VL的融合蛋白,连接肽通常富含甘氨酸以提高柔韧性,可将VH的N端(或C端)与VL的C端(或N端)相连[7]。虽然去除了C区并加入连接肽,但sc Fv仍然保留了原免疫球蛋白的特异性[8]。sd Ab也称纳米抗体,它的发现基于骆驼和鲨鱼体内天然缺失轻链的重链抗体。sd Ab是已知最小的功能性抗原结合片段,大小仅14 ku[9],结构简单,易于在细菌和酵母[10]中表达,特别适合基因工程方法[11]。sd Ab可溶性好,稳定性高,可用于探索抗原受体起源、研发疫苗、治疗药物、诊断试剂和生物技术研究工具等。sc Fv是最常用的抗体类型,可能是因为考虑到抗体与小分子的结合效率。虽然sd Ab可单独识别小分子,但亲和力往往不够理想。sc Fv是满足VH和VL同时存在的最小的抗体片段。虽然Fab也有VH和VL,但两个C区和中间的铰链区使其分子体积比sc Fv大了一倍多。且C区不参与小分子的识别与结合,其主要功能是维持抗体分子的稳定,所以单从亲和力角度考虑,Fab与sc Fv相比没有特别的优势,反而双倍的体积会在构建抗体文库和淘选过程中带来不便。虽然缺失C区而易于多聚化一直是sc Fv的不足,但通过开发双特异性抗体可以克服这个缺点。
图1 不同基因工程抗体形式[4]
![图1 不同基因工程抗体形式[4]](http://www.xueshut.com/uploads/allimg/210519/36-2105191012194U.jpg)
Figure 1 Different genetically engineered antibody formats[4]
2 、基因工程抗体的制备
抗体库技术是制备基因工程抗体的主要方法,分为构建和筛选两个过程。构建抗体库是在DNA水平上获得抗体可变区基因并克隆到载体中,在展示系统中表达抗体以便通过淘选富集阳性克隆,最后利用抗原筛选出携带特异性抗体基因的克隆,进行鉴定与分析。不同的展示系统其原理不尽相同,在构建和筛选抗体库的方法上也有所差别,各具优势。
2.1、 抗体库构建
根据抗体基因的来源可将抗体库分为天然库、合成库和免疫库。天然库的V基因来自未免疫个体的抗体基因。构建高度多样性的天然抗体库需要花费大量精力,但构建成功后可以反复使用,针对多种抗原进行筛选。然而,由于抗体基因来自人或动物免疫系统,所以无法保证通过筛选获得的克隆能在细菌中表达。此外,天然库筛出的抗体常常会引起宿主菌的不良表达或对其产生毒性,这些问题可以通过合成抗体库来解决[12]。天然抗体库一般不适合在没有载体分子的情况下分离识别小分子的抗体。合成库不受天然免疫系统的限制,因此更有可能包含目的抗体。全合成库是通过克隆生殖系DNA抗体基因序列构建的。VH、D、J或Vκ/λ、Jκ/λ基因片段在体外进行排列组合,重组成完整的VH和VL基因。随后将合成库克隆到表达载体中,可生成107~1010的文库。已有研究从合成库中分离出蛋白和半抗原的特异性抗体,但亲和力一般不高。免疫库是为代替杂交瘤而最先被开发出的抗体库,具有库容小但特异性和亲和力高的特点。通常将小分子与载体蛋白偶联后对动物进行注射免疫,动物体内对此抗原产生高水平的抗体,在总抗体m RNA中高度表达对应的抗体m RNA。因此,即使来自免疫供体的抗体文库库容只有105,也能产生特异性抗体,并且由于抗体基因在体内已经经历了亲和力成熟,所以不需要进一步提高亲和力。免疫库已被用于筛选病毒表面抗原、细菌霉素、细胞表面肿瘤抗原的特异性抗体,其KD值低至10-10mol/L。在构建免疫抗体库时,用多种抗原免疫单只动物可同时获得多种特异性高亲和力抗体[13]。
2.2 、抗体库筛选
基因工程抗体的体外分离取决于筛选大型抗体基因组合文库以分离出与靶分子特异性结合的克隆的能力。大多数免疫技术应用都需要筛选105~1011大小的抗体库,所以必须开发出高效、高通量的筛选技术。过去30年来,各种技术的复杂性和灵敏度不断提高,已从大量抗体库中分离高亲和力抗体。展示技术是目前筛选抗体库的主流方法,其中使用最广泛的是基于丝状噬菌体表面的抗体展示。将抗体基因与外壳蛋白基因连接并融合表达,使抗体蛋白成为噬菌体外壳蛋白的一部分,阳性克隆与固定抗原结合,其他噬菌体被洗去,洗脱后再重复该过程,以达到富集的目的(图2)。3~6轮后感染合适的细菌,以便收集噬菌粒,获得DNA序列并测序,以鉴定具有亲和性的抗体。噬菌体展示可直接得到抗体基因并高选择性地筛选抗体,但易受转化效率限制。
也可在微生物细胞表面展示抗体,如大肠杆菌和酿酒酵母[14]。以大肠杆菌为例,将抗体基因插入大肠杆菌外膜蛋白基因,使抗体蛋白进入重组细胞外表面并展示在外膜蛋白上,但不能展示过大的蛋白。抗体库的每个细胞展示不同抗体的多个拷贝,将抗体库与荧光标记的抗原共孵育以达到筛选目的。能与抗原结合的细胞被荧光标记,通过荧光激活细胞分选(Fluorescence-activated cell sorting,FACS)分离。
图2 噬菌体展示流程
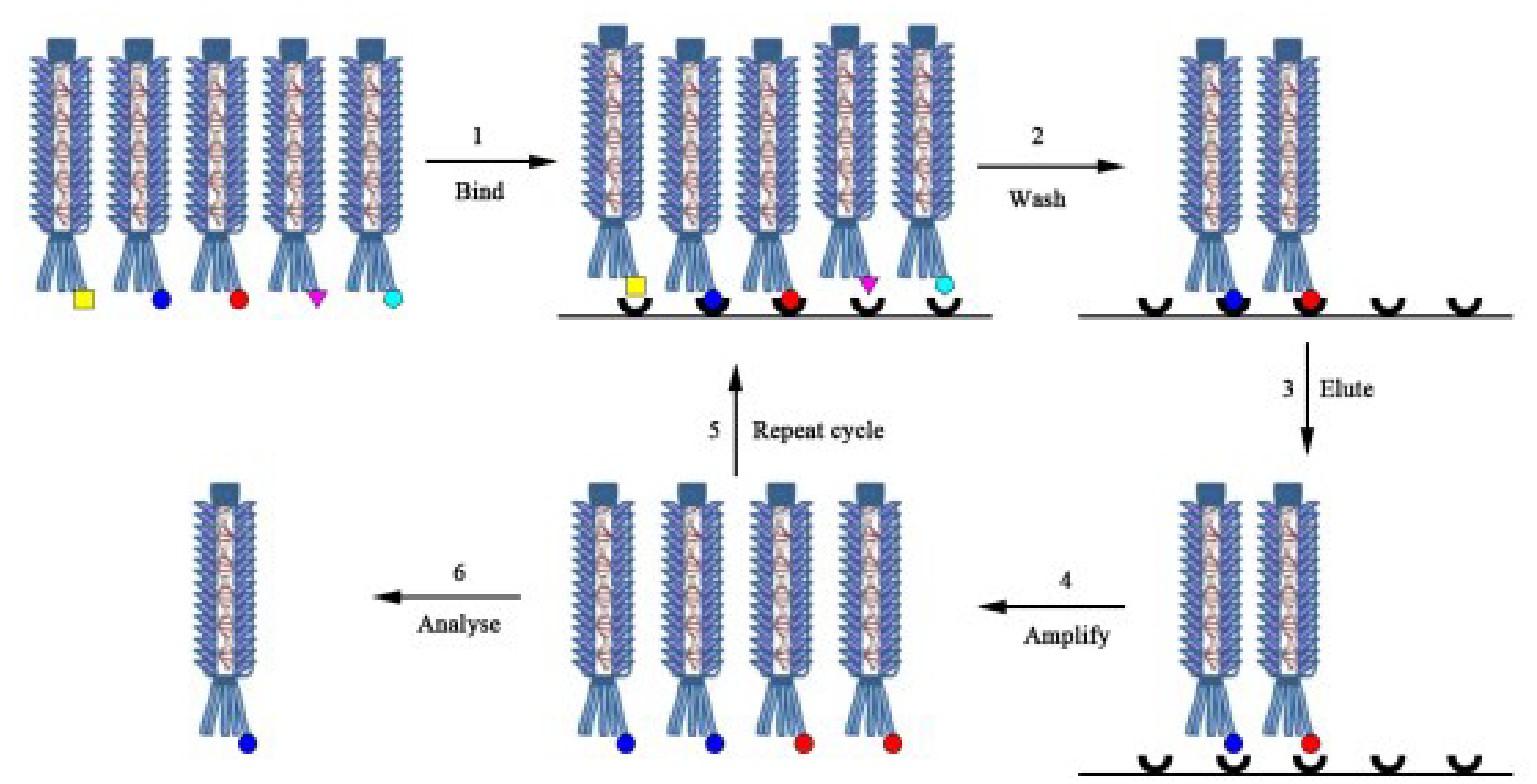
Figure 2 General protocol of phage display
核糖体展示需要核糖体、m RNA和抗体形成三元复合物,通过加工修饰DNA,使核糖体翻译到m RNA末端时缺乏终止密码子而不脱离,形成三元复合物。复合物的m RNA被反转录,产生编码抗体的DNA,抗体负责与固定化抗原结合。然后DNA被RNA聚合酶转录,开始另一个形成和筛选三元复合物的循环。也可以直接通过活性氨基酸类似物嘌呤霉素形成共价的m RNA-抗体复合物,优点是共价m RNA-抗体复合物更稳定,可以在严格的筛选条件下富集抗体并增强稳定性。核糖体展示不受细胞转染和表达影响,但操作过程较复杂。
不同的淘选策略决定了最终的结果,例如淘选中使用的洗脱方法会影响抗体的结合特性,但有效的策略在实验前是很难预测的[15]。多种方式组合的淘选策略可能比单一的方法效果更好,有研究称噬菌体展示、酵母展示和FACS结合的筛选方法广泛适用于分离可溶性抗原的scfv[16]。抗体库的筛选是抗体工程最重要的工具之一。筛选大容量抗体库的能力使模拟哺乳动物免疫反应的技术得以发展,无需动物免疫即可分离抗体,并改造出具有更高亲和力、稳定性、效应子功能的抗体。
3 、基因工程抗体在识别小分子中的应用
常见的小分子类别包括农药、除草剂、杀虫剂、药物、维生素、类固醇、激素、炸药、染料、毒素和代谢物等。还有一些是生物学研究中常用的试剂,如荧光素、生物素、地高辛和二硝基酚[17]。因此识别小分子的基因工程抗体大多应用于食品、环境污染物检测,医学检验及免疫疗法中[18]。
3.1 、食品和环境污染物检测
基因工程抗体已经较多应用到食品和环境污染物检测中,表现出良好的灵敏度和特异性。杀虫剂、多氯联苯、生物毒素、多环芳烃和金属等低分子量污染物的特异性抗体对食品、水源、生态系统安全至关重要[16]。霉菌毒素不仅污染食品,还会危害人体健康,如黄曲霉毒素B1[19]和脱氧雪腐镰刀菌烯醇[20]致癌,贝类毒素和微囊藻毒素[21]等海洋毒素也是研究热点。食品中的另一类主要污染源来自农药、除草剂和杀菌剂,如莠去津[22],这类物质也是环境污染物之一。其他由于滥用或残留而易造成污染的物质有维生素、抗生素[23]、抗菌素[15]、药物[24],经过治疗的动物的肉和牛奶中可能会有残留[25]。此外,环境中的污染物还涉及工业相关的石油、阻燃剂、炸药等(表1)。
值得注意的是,这些研究开发的免疫分析系统针对的分析物虽然不同,但研发的目的与方向却是一致的:一是用非竞争性免疫测定或其他更优的免疫测定法代替竞争法;二是提高其广谱特异性,这对实现快速、方便、准确的现场检测十分重要,也对抗体的特异性提出了更高的要求。基于抗体重链和轻链结合的开放夹心免疫分析(Open-sandwich immunoassay,OS-IA)只需要单个抗体就能快速非竞争地均相检测小分子,然而这种免疫分析方法更青睐sc Fv和Fab。虽然sd Ab在检测小分子中也有应用,且在与小分子结合过程中,VH的作用似乎比VL重要,但由于缺乏常规抗体的重链-轻链结构域,所以不容易结合小分子,成功的例子很少[26]。
3.2 、医学检验与免疫治疗
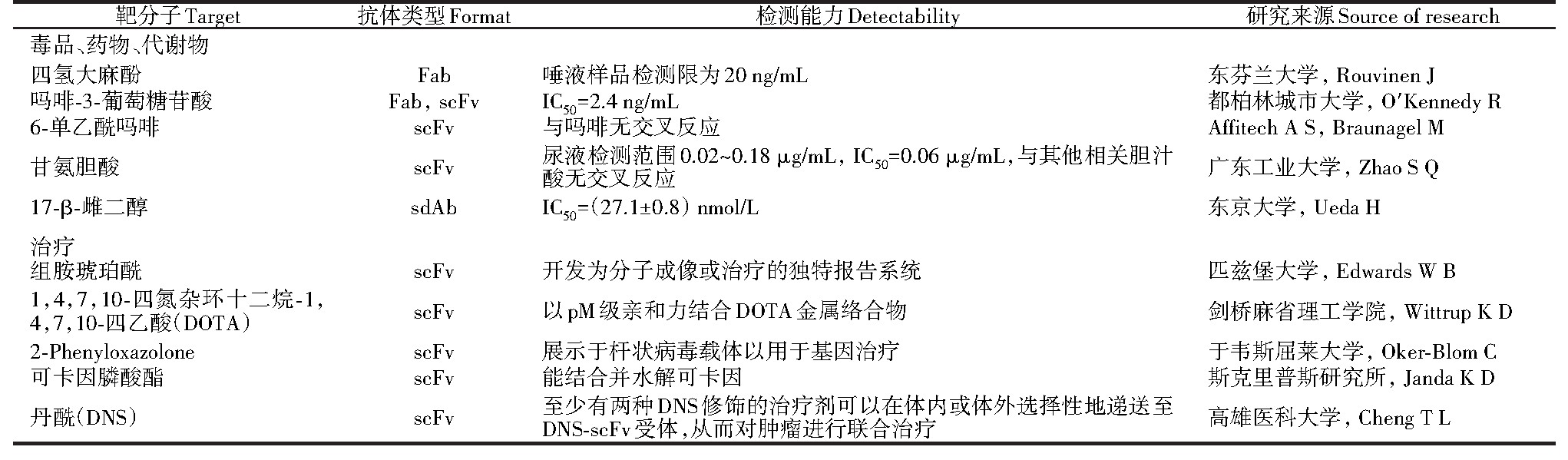
针对小分子的抗体可用于体外快速诊断[21]、滥用药物诊断、毒品检测(表2),不限于传统诊断和药物检测所用的血清,可直接测定人的唾液、尿液、排泄物等。Immunalysis公司的毒品尿检试剂盒使用了抗6-乙酰吗啡的Fab,能特异性识别6-乙酰吗啡而与分子结构上只差一个醛基的吗啡没有交叉反应[27]。完整抗体相对较大的体积和较长的血清半衰期不利于肿瘤的深层渗透,对放射敏感性组织(如骨髓)的高辐射剂量也一直是个问题。为了获得较高的肿瘤特异性信号和治疗功效,在靶向药物递送过程中需要提高肿瘤对背景的比率[28]。除了直接靶向蛋白抗原,基因工程抗体与小分子的结合为肿瘤治疗、基因治疗、蛋白替代疗法提供了新的思路。
表1 用于检测食品和环境污染物的基因工程抗体
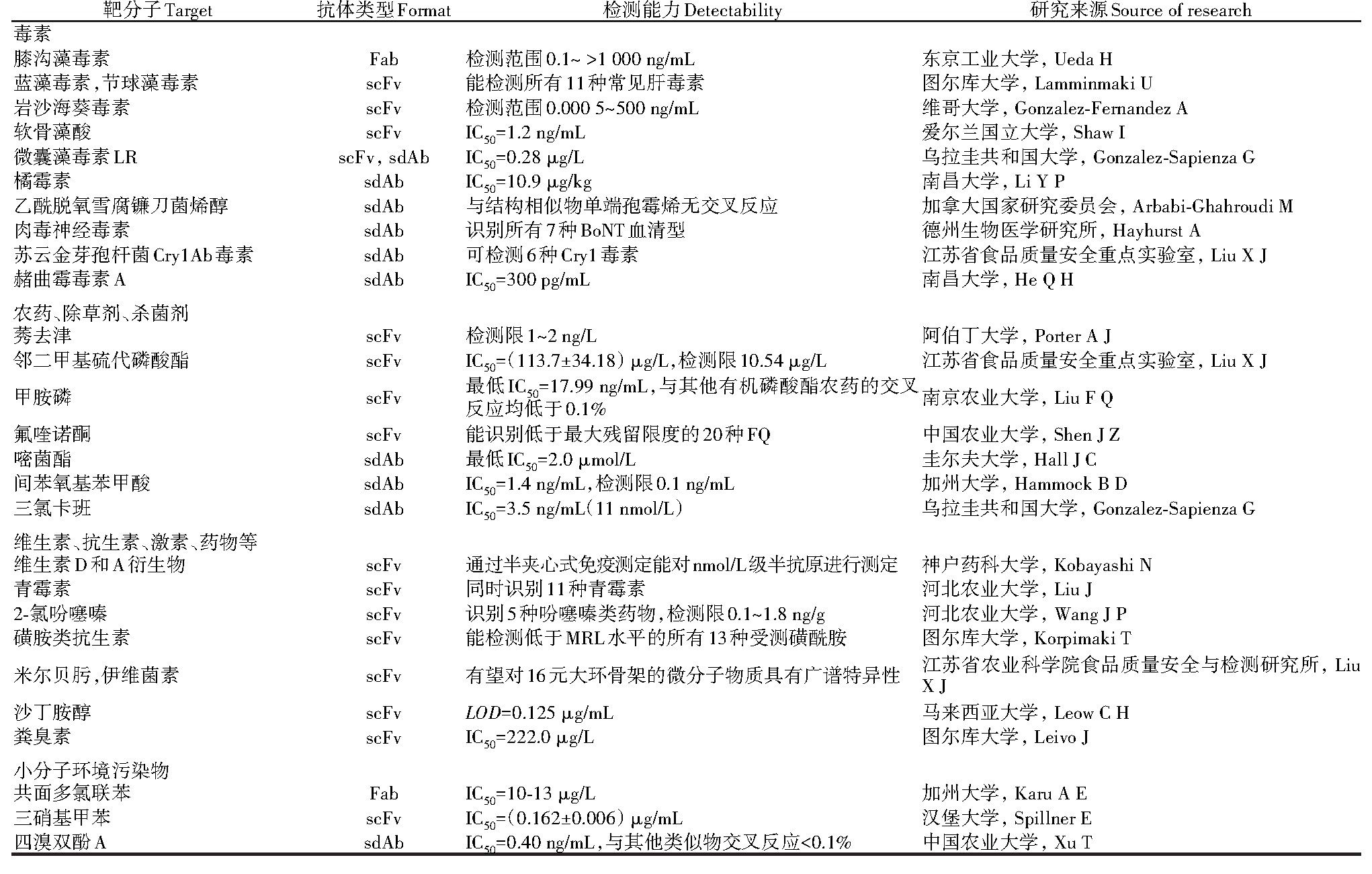
表2 用于医学检验与免疫治疗的基因工程抗体
4 、讨论与展望
与传统抗体相比,基因工程抗体在识别小分子方面的优势十分明显。虽然通过传统免疫方法已获得具有特异性的小分子单克隆抗体和多克隆抗体,但多抗的功能在不同免疫批次之间可能会有所不同,生产单抗的杂交瘤细胞系也可能不够稳定[29],其亲和力和特异性远不如基因工程抗体。结合体外展示技术,通过控制筛选条件,基因工程抗体能够识别相关小分子间的细微差异,如甲基化、磷酸化等化学修饰、蛋白质序列和特定的构象,其效果好于通过免疫获得的抗体。尽管抗体库技术还没有完全取代传统方法,但通过体外展示筛选出的基因工程抗体能快速获得抗体序列信息,更好地控制抗体的性质,有利于在基础研究和应用研究中的应用[30]。基因工程抗体还克服了免疫耐受性,可选择识别高度保守的靶标的亲和试剂,对化学或热变性有更高抗性[12]。在技术层面,基因工程抗体的体外展示相对简单、廉价、快速,易于自动化以提高筛选效率[31]。
在制备基因工程抗体时,小分子与载体分子结合作为抗原,具有高溶解度和易于固定的优点,但也可能会改变小分子的抗原性。将两种性激素尿液代谢物分别与BSA偶联时,发现小分子本身的活性基团、不饱和立体结构等对产生抗体的特异性存在一定影响。此外,体外展示通常会产生针对免疫优势表位的抗体片段,而当小分子的表位较弱时,则不会或很少产生针对小分子的抗体。可将小分子直接与固相载体结合,针对固定的小分子筛选抗体来避免这个问题。虽然理想目标是抗体对靶分子独具高特异性,但也有可能会出现仅识别小分子-载体加合物和载体蛋白而不能单独识别小分子的情况,最有效且直接的方法是在淘选阶段改变载体蛋白[32]。虽然原理上将抗体库与过量的载体蛋白共孵育也能去除与载体蛋白结合的抗体[22],但在实验中发现,判断载体蛋白是否过量十分困难,且需要控制加入的抗体库的量,这种间接竞争的方法无法完全去除非阳性克隆。
出于检测的目的,基因工程抗体需要具备识别小分子与其结构类似物的能力。虽然通过抗体库技术可以产生满足这类要求的抗体,但仅通过展示技术无法直接将其筛选出来。目前的鉴定方法一般以酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)为主,不仅要测定抗体识别小分子的亲和力,还需测定抗体与其他相似小分子的交叉反应率以判断特异性,通常需要分析上千个克隆才能得到亲和力和特异性都满足产品要求的抗体,巨大的工作量也成为基因工程抗体识别小分子应用中的阻碍。其他不利因素还包括许多小分子的标准品难以获得或价格昂贵,增加了制备基因工程抗体的成本。开发免疫测定产品的趋势之一是开发类别特异性检测法或多种分析物测定法,一次测试即可测定多个目标。针对小分子的分析测定和诊断方法种类繁多,除了最常见的高效液相色谱法、ELISA、放射免疫分析之外,还有基于表面等离子共振的抑制免疫分析、OS-IA、双抗体夹心ELISA、间接竞争性噬菌体ELISA、免疫PCR等。不同的检测方法对抗体的要求不同,在制备识别小分子的基因工程抗体时,也必须选择合适的检测方法。
参考文献
[1]ZENG X,SHEN Z,MERNAUGH R.Recombinant antibodies and their use in biosensors[J].Analytical&Bioanalytical Chemistry,2012,402(10):3027-3038.
[2]SIEGEL D L.Recombinant monoclonal antibody technology[J].Transfusion Clinique et Biologique,2002,9(1):15-22.
[3]SCHMITZ U,VERSMOLD A,KAUFMANN P,et al.Phage display:a molecular tool for the generation of antibodies-a review[J].Placenta,2000,21(Suppl A):S106-S112.
[4]HOLLIGER P,HUDSON P J.Engineered antibody fragments and the rise of single domains[J].Nature Biotechnology,2005,23(9):1126-1136.
[5]SANZ L,CUESTA A M,COMPTE M,et al.Antibody engineering:facing new challenges in cancer therapy[J].Acta Pharmacologica Sinica,2005,26(6):641-648.
[6]PARHAMI-SEREN B,VISWANATHAN M,MARGOLIES M N.Selection of high affinity p-azophenyarsonate Fabs from heavy-chain CDR2 insertion libraries[J].Journal of Immunological Methods,2002,259(1/2):43-53.
[7]SCHIRRMANN T.Tumorspezifische targeting der humanen natürlichen killerzellinie YT durch gentransfer chimürer immunglobulin-tzellrezeptoren[D].Berlin:Universit?tsklinikum Charité,2005.
[8]PETERSON E,OWENS S M,HENRY R L.Monoclonal antibody form and function:manufacturing the right antibodies for treating drug abuse[J].The AAPS Journal,2006,8(2):E383-390.
[9]LEE C M,IORNO N,SIERRO F,et al.Selection of human antibody fragments by phage display[J].Nature Protocols,2007,2(11):3001-3008.
[10]HOLT L J,HERRING C,JESPERS L S,et al.Domain antibodies:proteins for therapy[J].Trends in Biotechnology,2003,21(11):484-490.
[11]CHRIST D,FAMM K,WINTER G.Repertoires of aggregation-resistant human antibody domains[J].Protein Engineering Design and Selection,2007,20(8):413-416.
[12]MAYNARD J,GEORGIOU G.Antibody engineering[J].Annual Review of Biomedical Engineering,2000,2:339-376.
[13]LI Y,COCKBURN W,KILPATRICK J B,et al.High affinity ScFvs from a single rabbit immunized with multiple haptens[J].Biochemical and Biophysical Research Communications,2000,268(2):398-404.
[14]DAUGHERTY P S,IVERSON B L,GEORGIOU G.Flow cytometric screening of cell-based libraries[J].Journal of Immunological Methods,2000,243(1):211-227.
[15]TULLILA A,NEVANEN T K.Utilization of multi-immunization and multiple selection strategies for isolation of hapten-specific antibodies from recombinant antibody phage display libraries[J].International Journal of Molecular Sciences,2017,18(6):1169.
[16]SUN Y,BAN B,BRADBURY A,et al.Combining yeast display and competitive FACS to select rare hapten-specific clones from recombinant antibody libraries[J].Analytical Chemistry,2016,88(18):9181-9189.
[17]SINGH M K,SRIVASTAVA S,RAGHAVA G P,et al.HaptenDB:a comprehensive database of haptens,carrier proteins and anti-hapten antibodies[J].Bioinformatics,2006,22(2):253-255.
[18]RANGNOI K,JARUSERANEE N,O'KENNEDY R,et al.Onestep detection of aflatoxin-B-1 using scFv-alkaline phosphatase-fusion selected from human phage display antibody library[J].Molecular Biotechnology,2011,49(3):240-249.
[19]RANGNOI K,CHOOWONGKOMON K,O'KENNEDY R,et al.Enhancement and analysis of human antiaflatoxin B1(AFB1)scFv antibody-ligand interaction using chain shuffling[J].Journal of Agricultural and Food Chemistry,2018,66(22):5713-5722.
[20]HENRY K A,HUSSACK G,KUMARAN J,et al.Role of the nonhypervariable FR3 D-E loop in single-domain antibody recognition of haptens and carbohydrates[J].Journal of Molecular Recognition,2019,32(11):E2805.
[21]PIREZ-SCHIRMER M,ROSSOTTI M,BADAGIAN N,et al.Comparison of three antihapten VHH selection strategies for the development of highly sensitive immunoassays for microcystins[J].Analytical Chemistry,2017,89(12):6800-6806.
[22]CHARLTON K,HARRIS W J,PORTER A J.The isolation of super-sensitive anti-hapten antibodies from combinatorial antibody libraries derived from sheep[J].Biosensors&Bioelectronics,2002,16(9/10/11/12):639-646.
[23]HE X,DUAN C F,QI Y H,et al.Virtual mutation and directional evolution of anti-amoxicillin ScFv antibody for immunoassay of penicillins in milk[J].Analytical Biochemistry,2017,517:9-17.
[25]LEE W,SYED A A,LEOW C Y,et al.Isolation and characterization of a novel anti-salbutamol chicken scFv for human doping urinalysis[J].Analytical Biochemistry,2018,555:81-93.
[26]KORPIMAKI T,ROSENBERG J,VIRTANEN P,et al.Improving broad specificity hapten recognition with protein engineering[J].Journal of Agricultural and Food Chemistry,2002,50(15):4194-4201.
[27]CUI X P,VASYLIEVA N,WU P P,et al.Development of an indirect competitive enzyme-linked immunosorbent assay for glycocholic acid based on chicken single-chain variable fragment antibodies[J].Analytical Chemistry,2017,89(20):11091-11097.
[28]WANG G H,KIM H,REKHA B,et al.Validation of a new recombinant antibody fragment(rFab)-based homogeneous enzyme immunoassay for the highly specific detection of 6-acetylmorphine in urine[J].Journal of Analytical Toxicology,2015,39(9):726-733.
[29]KIM H Y,WANG X L,WAHLBERG B,et al.Discovery of hapten-specific scFv from a phage display library and applications for HER2-positive tumor imaging[J].Bioconjugate Chemistry,2014,25(7):1311-1322.
[30]BRADBURY A,PL CKTHUN A.Reproducibility:standardize antibodies used in research[J].Nature,2015,518(7537):27-29.
[31]BRADBURY A R,SIDHU S,DUBEL S,et al.Beyond natural antibodies:the power of in vitro display technologies[J].Nature Biotechnology,2011,29(3):245-254.
[32]WILLATS W G.Phage display:practicalities and prospects[J].Plant Molecular Biology,2003,50(6):837-854.
[33]AROLA H O,TULLILA A,KILJUNEN H,et al.Specific noncompetitive immunoassay for HT-2 mycotoxin detection[J].Analytical Chemistry,2016,88(4):2446-2452.





