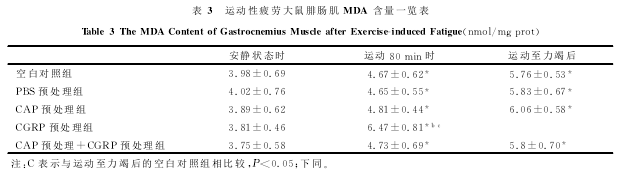
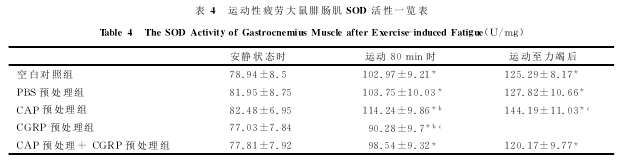
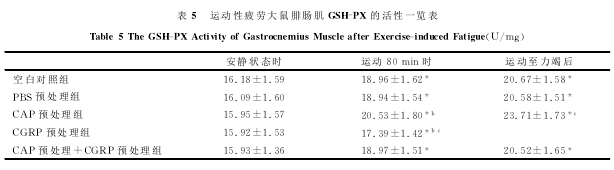
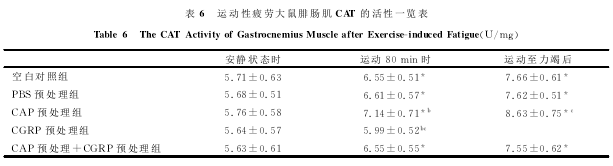
2.4骨骼肌MDA含量及SOD、GSH-PX、CAT活性的检测
表3表明,在安静状态时,各组之间MDA含量的变化差异无显着性(P>0.05)。运动80min时,空白对照组、PBS预处理组和CAP预处理+CGRP预处理组相比,MDA的含量也无明显差别;但CGRP预处理组与空白对照组相比,MDA的含量显着上升(P<0.05);而CAP预处理组与空白对照组相比,MDA的含量略有上升,但差异无显着性(P>0.05)。力竭运动后即刻,空白对照组、PBS预处理组和CAP预处理+CGRP预处理组相比,MDA的含量也无明显差别;但CGRP预处理组与空白对照组相比,MDA的含量显着上升(P<0.05);CAP预处理组与空白对照组相比,MDA的含量也有所上升,但差异无显着性(P>0.05)。运动80min时、力竭运动后即刻各组与安静状态下各对应组相比较,MDA的含量均显着上升(P<0.05)。
表4、表5、表6表明,在安静状态时,各组之间SOD、GSH-PX和CAT的活性变化差异无显着性(P>0.05)。运动80min时,空白对照组、PBS预处理组和CAP预处理+CGRP预处理组相比,SOD、GSH-PX和CAT的活性差异也无显着性(P>0.05);但CGRP预处理组与空白对照组相比,SOD、GSH-PX和CAT的活性显着下降;而CAP预处理组大鼠与空白对照组相比,SOD、GSH-PX和CAT的活性显着上升(P<0.05)。力竭运动后即刻,空白对照组、PBS预处理组和CAP预处理+CGRP预处理组相比,SOD、GSH-PX和CAT的活性也无明显差别;但CGRP预处理组与空白对照组相比,SOD、GSH-PX和CAT的活性显着下降(P<0.05);而CAP预处理组大鼠与空白对照组相比,SOD、GSH-PX和CAT的活性显着上升(P<0.05)。运动80min时、力竭运动后即刻各组与安静状态下各对应组相比较,骨骼肌SOD和GSH-PX的活性均显着上升(P<0.05);CAT的活性在运动80min时、力竭运动后即刻各组与安静状态下各对应组相比较,除CGRP预处理组差异无显着性外,其余各组均显着上升(P<0.05)。
3讨论
本研究运用一次性运动至力竭疲劳动物模型,通过给大鼠皮下注射CGRP和用CAP耗竭CGRP的方法从行为学、形态学和生理机能的角度检测CGRP对大鼠运动性疲劳的影响,探索CGRP与运动性疲劳之间的潜在关系。
本研究首先测量了不同干预措施条件下大鼠运动至力竭的平均时间。研究结果表明,给大鼠皮下注射CGRP后,在其他组运动至80min时该组已达力竭状态,大鼠运动至力竭的时间缩短大约37%;而用CAP耗竭内源性CGRP后大鼠运动至力竭的时间延长大约32%.这提示,CGRP可能加速了大鼠运动性疲劳的产生。
通过免疫组织化学和放射免疫的方法,测试不同干预措施条件下大鼠安静状态、运动至80min时、力竭运动后即刻腓肠肌神经肌肉接头CGRP的变化,发现力竭运动后即刻,大鼠腓肠肌神经肌肉接头CGRP的表达量与安静状态时相比明显上升。以往研究表明,一次大强度的下坡跑后,大鼠后肢运动神经元的CGRP显着提高,并持续2周左右,到第四周恢复到安静水平[13],这与本研究结果基本一致。运动神经元CGRP表达的增加可能是由于运动时腓肠肌的收缩提高了相关运动神经元的发放活动,从而引起运动神经元CGRP的表达均增加。运动80min时各组与安静状态下各对应组相比较,除CGRP预处理组外,其余各组CGRP的表达量有所下降,这可能是由于大鼠经过一段时间的运动,机体机能状态未达到力竭水平出现的一种保护性现象。给大鼠皮下注射CGRP后,无论安静状态、运动80min时,还是力竭运动后即刻,大鼠腓肠肌神经肌肉接头CGRP的表达均明显升高,而补充CAP后,无论安静状态、运动80min时,还是力竭运动后即刻大鼠腓肠肌神经肌肉接头CGRP的表达均明显下降。这说明,本研究的干预是有效的。
为了进一步了解CGRP对运动性疲劳的影响,本研究检测了不同干预措施条件下CGRP对大鼠骨骼肌形态结构及骨骼肌酶的活性和自由基含量的影响。1990年,Fisher等通过建立大鼠钝挫伤模型,发现伤后骨骼肌出现了许多肌细胞核,形态类似卫星细胞,说明,骨骼肌细胞核的变化可初步反映骨骼肌受损伤的程度。本研究发现,给大鼠皮下注射CGRP,运动至80min时(力竭运动后即刻)大鼠骨骼肌的细胞核明显增多、增大,而用CAP耗竭CGRP后大鼠骨骼肌细胞核增多、增大的现象不明显。提示,CGRP干预导致了显着的肌细胞形态学改变,因而,CGRP可能加速了骨骼肌的损伤。骨骼肌细胞核的增多、增大可能与以下原因有关:1)骨骼肌损伤时,肌卫星细胞分裂,变成纺锤形的成肌细胞,然后多个成肌细胞融合成管状的多核细胞(称为肌管),最后变成骨骼肌纤维;2)破碎骨骼肌纤维的细胞核及其周围的肌浆可变为成肌细胞;3)结缔组织中的某种细胞也可分化为成肌细胞[1].
研究表明,通过测量大鼠骨骼肌中MDA的含量及SOD、GSH-PX和CAT的活性能反映大鼠的运动能力及运动性疲劳的产生[8,9,33].MDA是细胞脂质过氧化的一种主要产物,生物膜脂质的不饱和脂肪酸最易受到自由基的攻击而发生过氧化,所以,组织MDA的含量可反映机体脂质过氧化水平,间接反映机体细胞受自由基攻击损伤的严重程度[16,18].在自由基的连锁反应中,SOD、GSH-PX和CAT都是机体内的抗过氧化物酶。SOD是体内主要的自由基清除酶,能够催化超氧阴离子歧化为O2和H2O2,从而保护细胞膜和线粒体等免受氧化损伤,而H2O2可以被GSH-PX和CAT催化分解为O2和H2O[2,14].CAT主要集中在过氧化物酶体中,而GSH-PX主要在细胞质中。GSH-PX能特异地催化GSH对H2O2的还原反应,起到保护细胞膜结构和功能完整性的作用[23].本研究表明,给大鼠皮下注射CGRP后,与空白对照组相比,大鼠骨骼肌中MDA含量显着升高,SOD、GSH-PX和CAT的活性显着下降,而用CAP耗竭CGRP后,与空白对照组相比,大鼠骨骼肌中MDA含量显着下降,SOD、GSH-PX和CAT的活性显着升高。这提示,CGRP在一定程度上增加了大鼠力竭运动后体内自由基的生成量,降低了体内自由基的清除,增加了自由基对细胞脂质成分的氧化损伤作用,加速了运动性疲劳的产生。研究报道,CGRP有预防小鼠自身免疫性糖尿病发病及抗氧化应激的作用,增加SOD和CAT的生成,降低MDA的含量[26].这一报道与本研究结果正好相反,这可能与实验模型或CGRP剂量有关。在脊椎动物骨骼肌,CGRP通过作用于CGRP受体,诱发肌肉的收缩[29],在成年啮齿类动物膈肌,CGRP缩短了肌肉收缩的相对不应期[11],上调了骨骼肌纤维cAMP的水平[21].结合本研究实验结果,认为,CGRP对大鼠运动性疲劳的影响可能是由于CGRP对骨骼肌长时间的作用导致骨骼肌长时间收缩,从而引起大鼠运动性疲劳的提前发生。
综上所述,本研究观察到CGRP干预可导致大鼠运动至力竭的时间缩短,形态学上骨骼肌损伤加剧,骨骼肌自由基生成增多,提示,CGRP加速了运动性疲劳的产生。但是,CGRP加速运动性疲劳产生的具体机制,尤其是其下游的作用靶点,需要更进一步的研究。