
引言
【研究意义】玉米赤霉烯酮(zearalenone, ZEA),又称 F-2 毒素,主要由禾谷镰刀菌产生的一种非类固醇类的、具有雌激素活性的真菌毒素。全世界谷物和饲料普遍受到 ZEA 的严重污染。在中国,落后的谷物收获条件和油料加工过程加重 ZEA 的污染,使ZEA 等霉菌毒素的污染程度远远超出国外。【前人研究进展】研究表明,ZEA 及其代谢物通过雌激素受体激活雌激素反应基因的转录,引起多种动物的雌激素中毒症。ZEA 主要在肝脏进行代谢,因此肝脏是 ZEA 的靶器官之一,影响鼠、雌性仔猪和兔肝脏正常功能酶的活性,诱发不利的肝脏损伤,以致发展成肝癌。【本研究切入点】国内外有关 ZEA的大量文献主要集中在对成年繁殖母猪繁殖性能和雌性断奶仔猪外生殖器官上的影响,对肝肾功能的研究仅限于血液指标和高剂量ZEA处理的实验动物。迄今为止,尚未见有关低剂量 ZEA(1.0—3.2 mg·kg-1)对断奶仔猪肝肾组织病理学及毒性剂量效应关系的系统报道。【拟解决的关键问题】本研究以肝肾为研究对象,研究低剂量 ZEA 对断奶仔猪血清代谢产物、肝肾组织病理学和肝脏超微结构的影响,以期揭示 ZEA 对肝肾毒性及其作用机制,为养猪生产提供理论指导。
1 材料与方法
1.1 试验时间和地点
试验时间为 2009 年 9 月 21 日至 2010 年 6 月 10日,试验在山东省沂南县孙祖镇金珠园猪场进行。
1.2 试验材料
玉米赤霉烯酮为以色列 Fermentek (Jerusalem,Israel)公司生产,色谱纯,纯度保证值为 98%。
1.3 试验动物与管理
仔猪 21 日龄断奶,选择(35±1)日龄、平均体重为(10.36±1.21)kg 健康的三元(斯格×长×大)杂交断奶仔猪 20 头,按照体重随机分为 4 个处理,每个处理 5 头,每个重复 1 头猪,各处理组间初始体重差异不显着(P>0.05)。
仔猪采用试验笼(0.48 m2)单独饲养。单体笼使用塑料漏缝地板,安装有乳头饮水器和料槽,仔猪自由采食和饮水。试验开始前对猪舍进行全面清扫、消毒,试验期间每周进行一次猪舍消毒。舍内安装红外保温灯,第 1 周维持试验笼内温度在 30℃左右,第 2周将猪舍内环境温度维持在 26—28℃。猪舍相对湿度为 65%。预饲期 7 d,正式期 18 d。试验在沂南金珠园猪场进行。
1.4 基础日粮与试验设计
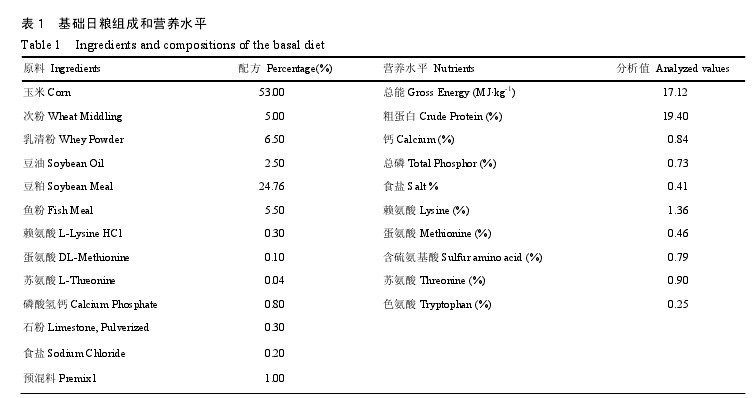
试验基础日粮组成和营养水平见表 1。对照组(Contr.)饲喂基础日粮,试验 1 组(Contr. + ZEA1)、2 组(Contr. + ZEA2)和 3 组(Contr. + ZEA3)分别在基础日粮的基础上添加 1.1、2.0 和 3.2 mg·kg-1ZEA。
1.5 试验日粮的配制、养分含量和毒素水平的测定
1.5.1 玉米赤霉烯酮污染日粮的配制 将色谱纯度(98%)晶体粉末状 ZEA 由乙酸乙酯溶解制成溶液,再将含有 ZEA 的乙酸乙酯溶液喷洒到一定量的滑石粉载体上,并放置过夜使乙酸乙酯挥发,制成1 000 mg·kg-1的 ZEA 预混剂,然后用不含毒素的玉米粉进一步将 1 000 mg·kg-1的 ZEA 预混剂稀释成10 mg·kg-1的ZEA预混剂,最后按照试验日粮中ZEA的设计水平,用 ZEA 预混剂替代配方中的玉米和载体配制成试验日粮。试验所需日粮需于试验正式开始前一周一次性配合完成,在实验前和试验结束后分别取样,用以分析日粮中的养分含量以及毒素水平。
1.5.2 常规养分测定 日粮常规养分含量按照文献的方法进行。粗蛋白用凯氏定氮法;能量用 HR-15氧弹式热量计测定;钙根据高锰酸钾滴定法测定;食盐按照硫氰酸铵反滴定法测定;氨基酸用日立 835-50氮基酸自动分析仪进行测定。
1.5.3 日粮毒素测定 日粮中 ZEA、呕吐毒素、黄曲霉毒素和烟曲霉毒素测定委托台湾亚洲谷物检测中心 ( Asia Mycotoxin Analysis Center, ChaoyangUniversity of Technology)测定。呕吐毒素的测定采用高效液相色谱法(HPLC),ZEA、黄曲霉毒素和烟曲霉毒素采用酶联免疫吸附(ELISA)和荧光测定法。黄曲霉毒素、ZEA、呕吐毒素和烟曲霉毒素的最低检测限为分别为 1 μg·kg-1、0.1、0.1 和0.25 mg·kg-1。对照日粮和试验日粮中 ZEA 的含量分别为 0、1.1、2.0 和 3.2 mg·kg-1,未检测到其他毒素。【表1】
1.6 血样的采集、处理与测定
试验结束后,对仔猪进行前腔静脉空腹采血。使用真空促凝管采集血样 30 mL,3 000 r/min 下离心 10min 分离血清,待测定血清代谢产物含量。
血清代谢产物总蛋白、球蛋白、胆红素、胆固醇、甘油三酯、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)采用 COBAS MIRA Plus(Roche DiagnosticSystem Inc., 瑞士)全自动生化分析仪测定。
1.7 屠宰试验、样品采集和测定
试验末采血结束后,仔猪电击致死后放血,打开腹腔,首先对肝脏和肾脏器官进行肉眼观察,并记录病变情况。首先切取肝脏和肾脏组织块,厚度约为 0.2—0.3 cm,大小约为 1.5 cm×1.5 cm×0.3 cm,迅速将样品固定于 10%的福尔马林溶液,待做组织切片检测。然后切取米粒大小的肝脏组织块,迅速用 2.5%戊二醛磷酸盐缓冲液固定,待做电镜切片进行超微结构观察。
1.7.1 组织切片制作 取保存好的组织块,用乙醇逐级脱水,二甲苯透明,采用 BMJ23 型包埋机包埋,LEICA RM2135 切片机进行切片(5 μm),用苏木精和伊红( H.E) 染色,树胶封片,日本 PM-20 显微照像设备进行图像采集,载玻片在 40×、100×和 400×放大倍数下用光学显微镜(Carl Zeiss, Germany)检查。
1.7.2 电镜切片制作 将待检样品切成 0.5 mm3大小,置于 2.5%多聚甲醛-戊二醛混合固定液中进行前固定,1%锇酸进行后固定 1 h;梯度丙酮脱水后,用812 树脂包埋,制备超薄切片,醋酸双氧铀和柠檬酸铅双重染色后,透射电镜(JEV1230,80kV)观察,拍照。
1.8 数据统计
试验数据采用 SAS软件进行统计。处理间差异采用单因子方差(One-Way ANOVA)分析进行。采用正交多项式比较法对不同 ZEA 梯度的处理效应进行一次线性回归分析,用 Duncan’s 多组极差检验法进行多重比较,显着性水平 P<0.05。
2 结果
2.1 血清代谢产物指标
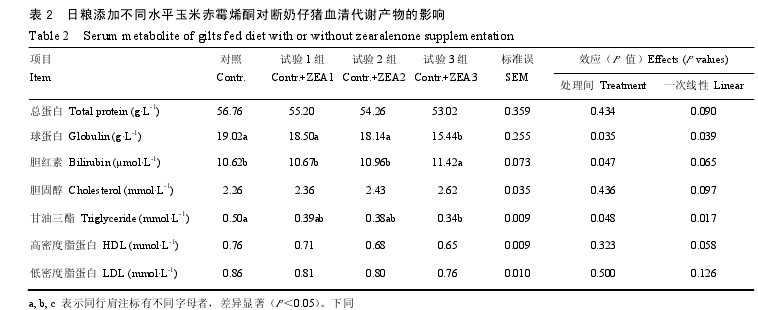
日粮添加不同水平玉米赤霉烯酮对断奶仔猪血清代谢产物的影响见表 2。3.2 mg·kg-1ZEA 处理组仔猪血清胆红素显着高于对照仔猪(P<0.05),而血清球蛋白和甘油三酯则显着低于对照组(P<0.05),其它则差异不显着。随日粮 ZEA 水平的增加,血清球蛋白和甘油三酯呈一次线性降低(P<0.05)。【表2】
2.2 肝脏组织形态学
日粮添加不同水平玉米赤霉烯酮对断奶仔猪肝脏组织切片的影响见图 1。对照组肝细胞未见明显病变(A);1.1 mg·kg-1ZEA 处理组肝细胞肿胀,颗粒变性(B,红色箭头);2.0 mg·kg-1ZEA 处理组肝细胞肿胀,颗粒变性(C,红色箭头);3.2 mg·kg-1ZEA处理组肝细胞肿胀,颗粒变性并见空泡变性(D,蓝色箭头)。
2.3 肾脏组织形态学
日粮添加不同水平玉米赤霉烯酮对断奶仔猪肾脏组织切片的影响见图 2。对照组肾脏细胞结构正常(A);1.1 mg·kg-1ZEA 处理组肾小管上皮细胞轻微肿胀(B,红色箭头);2.0 mg·kg-1ZEA 处理组肾小管上皮细胞重度颗粒变性(C,绿色箭头),有些管腔内充满大量透明底状物或蛋白尿(C,蓝色箭头)。3.2 mg·kg-1ZEA 处理组肾小管上皮细胞显着肿胀,重度颗粒变性,管腔狭窄(D,绿色箭头),有些管腔内充满大量透明底状物或蛋白尿(D,蓝色箭头)。
2.4 肝脏超微结构
日粮添加不同水平玉米赤霉烯酮对断奶仔猪肝脏超微结构的影响见图 3。对照组肝细胞结构清晰,线粒体完整,胞浆内细胞器散在分布,粗面内质网上有丰富的核糖体(A,白色箭头);1.1 mg·kg-1ZEA处理组肝细胞未见明显病理变化(B);2.0 mg·kg-1ZEA 处理组肝细胞膜上有 2 个小的自噬体(C,红色箭头),细胞核附近有一个大的自噬体(C,蓝色箭头)。3.2 mg·kg-1ZEA 处理组肝脏中炎性细胞浸润,两个血管之间可见一个嗜中性白细胞(D,绿色箭头)。
3 讨论
有关 ZEA 毒性的研究有些是采用添加 ZEA 的纯毒素进行,有些则采用已知 ZEA 含量的天然污染日粮进行。但是天然污染日粮通常含有 ZEA 以外的其它一种或者几种毒素,对 ZEA 毒性的研究带来不利的影响。因此,本试验选择高纯度的 ZEA 毒素添加在没有被污染的日粮中,来研究 ZEA 的毒性机理。考虑到猪尤其是母猪对 ZEA 的敏感性,而且猪是用外推法研究人类的最好模型,所以本试验动物选择猪。本试验中 ZEA 的添加剂量是根据本实验室前期的研究结果设计。
3.1 玉米赤霉烯酮对仔猪血清代谢产物的影响
ZEA 主要在肝脏中代谢成 α-玉米赤霉烯醇(ZOL)或 β-ZOL,α-ZOL 比 ZEA 具有更强的雌激素活性。NTP首次报道 ZEA(50 或 100 mg·kg-1)能够诱导不利的肝脏损害,诱发肝癌。O?uz 等建议,慢性真菌毒素中毒症可以在明显的临床症状出现之前,通过测定血清生化参数的改变进行诊断。本研究中 3.2 mg·kg-1ZEA 处理组球蛋白的显着降低表明ZEA 导致肝脏严重应激。而且,2.0 和 3.2 mg·kg-1ZEA处理组仔猪血清尿素和肌酐的显着升高进一步证实ZEA 诱导肾脏功能的损害。血清尿素浓度可以较准确地反映动物体内蛋白质代谢和氨基酸之间的平衡状况,它是反映蛋白质代谢的重要指标。血清尿素含量与日粮氮利用率成反比,能够衡量日粮蛋白质的生物学价值。血清尿素与蛋白质代谢有密切关系,本试验中在日粮蛋白质含量稳定的情况下,血清尿素升高表明 ZEA 促进了蛋白质的分解代谢,从而影响了血清球蛋白水平。总蛋白降低前人已有报道,证明 ZEA具有蛋白质分解作用以及引起肾脏机能障碍,其机理可能是 ZEA 及其代谢物影响临界氨基酸的利用率。
孙美乐等在大鼠肝细胞体外培养液中加入 0.5—15.0 mg·mL-1ZEA,结果培养液中白蛋白及细胞内DNA 含量下降,表明 ZEA 对体外培养大鼠肝细胞有损伤作用。本研究中 3.2 mg·kg-1ZEA 处理组甘油三酯显着降低,因为肝脏是产生甘油三酯的主要器官,ZEA诱导的肝脏应激导致脂类的分泌受到抑制。
3.2 玉米赤霉烯酮对仔猪肝肾组织结构的影响
肝脏是动物体内最大的腺体,它在动物的代谢、胆汁生成、解毒、凝血、免疫等过程中起着非常重要的作用,是人体内的一个巨大的“化工厂”。 因此,肝脏的结构完整对动物健康是非常重要的。
Collins 等报道,给妊娠 6—19 d 的鼠分别强饲 0、1、2、4 或 8 mg·kg-1BW 的 ZEA,4 和 8 mg·kg-1ZEA处理组显着增加肝脏指数。本研究中,仔猪日粮添加 3.2 mg·kg-1水平的 ZEA显着增加仔猪肝脏和肾脏器官指数。
ZEA 诱导的肝脏组织病理学损害已有报道。
?peranda 等证实,3 mg·kg-1ZEA 处理断奶仔猪,诱导肝脏发生间质性炎症的组织病理变化。高剂量 ZEA(40 或 500 mg·kg-1BW)导致小鼠肝脏明显的病灶、脉管肿胀和淋巴浸润,肾脏近端小管上皮细胞肿胀、颗 粒 变性 、肾 小 球萎 缩和 血 管扩 张。 Pfohl-Leszkowicz 等报道,单次剂量 ZEA(2 mg·kg-1,腹腔注射或口服)处理雌性小鼠显着增加肝脏和肾脏DNA 加合物的数量,证实 ZEA 及其代谢物具有基因毒性。Jiang 等对断奶母猪肝肾组织病理学的研究表明,1.3 mg·kg-1ZEA 处理导致仔猪肝脏中央静脉肝细胞水泡变性、淋巴浸润和肾脏肾小管上皮细胞肿大、脂肪变性和水泡变性。Dong 等证实,1.2 和 2.4 mg·kg-1ZEA处理(静脉注射)山羊导致肝脏细胞肿大以及淋巴细胞浸润、肾脏淋巴浸润。但是,Forsell 等用 10 mg·kg-1ZEA 处理小鼠没有观察到肝脏和肾脏的组织病理学变化。本研究中,ZEA 处理仔猪肝脏细胞颗粒变性、间质增生,超微观察发现 2.0—3.2 mg·kg-1ZEA 处理组肝细胞变形、萎缩、脂肪变性并伴有大量脂滴,细胞质和线粒体肿,内质网扩张较严重、排列无序,线粒体基质丢失,嵴消失,甚至整个线粒体为空泡,肝脏中炎性细胞浸润;肾脏近端小管变性、肿胀、管腔变小,远端小管内有大量透明蛋白尿,且具有剂量依赖特性,表明1.1—3.2mg·kg-1ZEA 导致肝肾应激,肝肾组织切片的炎性变化与血清生化参数和血液学指标相一致。
4 结论
4.1 3.2 mg·kg-1ZEA 处理组仔猪血清胆红素显着高于对照仔猪(P<0.05),而血清球蛋白和甘油三酯则线性降低(P<0.05);4.2 与对照组相比,1.1、2.0 和 3.2 mg·kg-1ZEA 处理组肝细胞肿胀,颗粒变性。与对照组相比,2.0 和 3.2mg·kg-1ZEA 处理组肾小管上皮细胞颗粒变性,管腔变窄,有些管腔内充满大量透明底状物或蛋白尿;4.3 2.0和3.2 mg·kg-1ZEA 处理组肝细胞膜上可见自噬体和嗜中性白细胞。





