摘 要: 为评价含碘、季铵盐、过硫酸氢钾、二氧化氯这四类常用消毒剂对非洲猪瘟病毒(ASFV)的灭活效果,参考OIE参考实验室相关操作流程,基于畜禽栏舍、运载工具、器具消毒及皮肤黏膜消毒目的,根据说明书标明的浓度范围选择不同工作浓度,与ASFV分别在4℃和20℃条件下作用30分钟,10倍连续稀释后接种猪肺泡巨噬细胞,同时加入猪红细胞,培养观察红细胞吸附现象。结果显示,本试验四类消毒剂对ASFV均有灭活作用,但灭活效果因消毒剂的种类和工作浓度不同有所差异。相同工作浓度的同一消毒剂产品,在4℃和20℃这两种条件下的灭活效果基本一致。季铵盐类和二氧化氯类消毒剂,在说明书推荐的工作浓度下,均有效灭活ASFV;多数含碘类、过硫酸氢钾类消毒剂,需在其说明书标明浓度范围的较高工作浓度时,才可有效杀灭ASFV。本研究为非洲猪瘟防控工作中消毒剂的选择和使用提供参考。
关键词: 非洲猪瘟; 消毒剂; 灭活; 病毒; 消杀;
Abstract: In order to evaluate the inactivation effect of four kinds of disinfectants against African swine fever virus(ASFV)including iodine disinfectant,quaternary ammonium,potassium persulfate and chlorine dioxide,with reference to relevant operation procedures of OIE reference laboratories,and based on the purpose of disinfecting livestock and poultry sheds,transportation vehicles,instruments and skin mucous membrane,the above disinfectants were set at different concentrations according to corresponding instructions and reacted with ASFV for 30 minutes at 4 ℃ and 20 ℃,respectively. The reaction products were diluted 10 times continuously and inoculated in porcine alveolar macrophages,meanwhile,porcine erythrocytes were added in to cultivate and observe the adsorption status of red blood cells. The results showed that ASFV could be inactivated by all the above disinfectants,but the effect depended on the type and concentration of the disinfectants;the same disinfectant with same concentration could receive similar effect at 4 ℃ and 20 ℃ ;ASFV could be effectively inactivated by quaternary ammonium and chlorine dioxide with the concentration as proposed in respective instructions;but failed by most iodine disinfectant and potassium persulfate unless the higher concentration was reached as indicated in corresponding instructions. The study provided some references to select and use disinfectants in the control of ASFV.
Keyword: ASF; disinfectant; inactivation; virus; disinfection and sterilization;
接触传播是非洲猪瘟(African swine fever,ASF)传播的重要方式。据调查,在我国发生的多起规模化养殖场ASF疫情是由人员、运输工具携带非洲猪瘟病毒(African swine fever virus,ASFV)接触猪群引发。同时,健康猪可通过接触ASFV污染的水、饲料、垫料等而造成感染。因此,在生猪养殖、运输调运、屠宰加工、检验检疫等各环节,选择合适消毒剂杀灭病毒,阻断其接触传播途径,对于ASF防控非常重要。

ASFV属于囊膜DNA病毒,其衣壳由外脂膜下的数个同心的脂质和蛋白层组成,对乙醚和氯仿易感[1]。针对ASFV的消毒剂选择,可借鉴已有针对囊膜病毒的消毒剂,如伪狂犬病病毒、猪繁殖与呼吸综合征病毒和猪瘟病毒等[2]。甲醛、次氯酸钠、柠檬酸、苛性钠、酚化物、碘化物、季铵盐等均已证实对ASFV有杀灭效果[3,4,5,6]。
为评价我国市售消毒剂对ASFV的杀灭效果,本试验选择常用的市售含碘、季铵盐、过硫酸氢钾、二氧化氯等四类消毒剂,以OIE参考实验室有关操作流程为依据,开展消毒剂对ASFV灭活效力评价,以期为我国ASF防控工作提供技术支持。
1 、材料与方法
1.1 、消毒剂
收集市面常见的含碘、季铵盐、过硫酸氢钾、二氧化氯等四类消毒剂,其中含碘类7种,商品代号A1~7;季铵盐类1种,商品代号B1;过硫酸氢钾类5种,商品代号C1~5;二氧化氯类消毒剂1种,商品代号D1。除A1、C5外,其余产品均注册有兽药产品批准文号,试验时所有产品均在有效期内(表1)。
1.2、 病毒
中国非洲猪瘟病毒分离株African swine fever virus isolate CN2018/1株,由国家非洲猪瘟参考实验室分离鉴定。
表1 消毒剂产品信息

1.3 、试剂与耗材
DMEM培养基、胎牛血清为GIBCO公司产品;细胞瓶及96孔细胞板,购自Corning公司。
1.4 、猪肺泡巨噬细胞、红细胞和血清制备
无菌采集健康猪肺脏,向肺脏注入灭菌PBS灌洗数次,收集灌洗液,离心收集猪肺泡巨噬细胞,按5×106个/m L浓度100μL/孔接种96孔板。次日铺板,进行测试。
同步无菌采集抗凝血,离心收集血清,之后将细胞沉淀洗涤3~5次,弃去白细胞和血小板,用PBS配成10%猪红细胞悬液,4℃保存备用。
1.5 、消毒剂对细胞状态影响试验
基于畜禽栏舍、运载工具、器具消毒及皮肤黏膜(部分含碘类消毒剂适用)消毒目的,按消毒剂说明书推荐,合理选择高、中、低工作浓度,并将消毒剂原液制成10倍工作浓度备用。将0.1 m L10倍工作浓度液加入到0.9 m L含1%猪血清的PBS中充分混合,混合物分别在20℃和4℃条件下作用30 min。部分无法配制10倍工作浓度的,包括含碘类消毒剂A1、A4、A5的1:2稀释工作浓度,取0.5 m L消毒剂原液加入0.5 m L含1%猪血清的PBS。阴性对照组,直接取1 m L含1%猪血清的PBS,按相同条件作用处理。
作用结束后,采用含1%猪血清的PBS连续10倍稀释各组作用后产物至10-8,每孔50μL接种猪肺泡巨噬细胞培养物,同时加入1%猪红细胞10μL,每个稀释度(含未稀释作用产物即原液)做4重复孔。将96孔板置于37℃5%CO2条件下培养6d,观察记录细胞状态。评估消毒剂对猪肺泡巨噬细胞和猪红细胞状态影响,用于消毒剂对ASFV灭活作用试验参照。
1.6、 消毒剂对ASFV灭活作用试验
参考OIE参考实验室开展的消毒剂对ASFV灭活效力评估操作流程,制定本试验方案。按1.5方法,稀释消毒剂至10倍工作浓度备用。测试组,将0.1 m L 10倍工作浓度液和0.1 m L ASFV培养物加入到0.8 m L含1%猪血清的PBS中充分混合,混合物分别在20℃和4℃条件下作用30 min。部分无法制成10倍工作浓度的,包括含碘类消毒剂A1、A4、A5的1:2稀释工作浓度,将0.5 m L消毒剂原液和0.1 m L ASFV培养物加入到0.4 m L含1%猪血清的PBS,按相同条件作用处理。阳性对照组,将0.1 m L ASFV培养物加入到0.9 m L含1%猪血清的PBS中充分混合,按相同条件作用处理。阴性对照组,直接取1 m L含1%猪血清的PBS,按相同条件作用处理。
作用结束后,用含1%猪血清的PBS连续10倍稀释各组作用后产物至10-8,每孔50μL接种猪肺泡巨噬细胞培养物,同时加入1%猪红细胞10μL,每个稀释度(含未稀释作用产物即原液)做4重复孔。将96孔板置于37℃5%CO2条件下培养6 d,每天观察,记录并统计各稀释度培养孔(含未稀释作用产物即原液)中红细胞吸附(HAD)反应结果;如结果可疑或无法判定,则再次传代后综合判定结果。重复试验2次,统计消毒剂不同工作浓度下各培养孔中HAD结果,采用Reed-Muench法计算半数红细胞吸附量(HAD50),测定病毒滴度log10 HAD50/m L。参照卫生部颁布的2002版《消毒技术规范》[7],计算消毒剂平均灭活对数值,消毒后平均灭活对数值≥4,判为有效灭活ASFV。平均灭活对数值按如下方法计算:设阳性对照组平均病毒感染滴度(HAD50)的为N0,试验(消毒)组平均病毒感染滴度(HAD50)为Nx。平均灭活对数值=log10 N0-log10 Nx。
2、 结果与分析
2.1、 消毒剂对细胞状态影响试验
含碘、季铵盐、过硫酸氢钾、二氧化氯等四类消毒剂对细胞状态影响结果详见表2。含碘类消毒剂中,A1~5成分主要为碘化物,对细胞状态影响不显着。A6、A7主要成分为碘、磷酸、硫酸时,对细胞状态影响可见于原液、10-1~10-3稀释孔中,表现为猪肺泡巨噬细胞和猪红细胞不同程度的破碎、崩解。
季铵盐类消毒剂对细胞状态影响见于原液、10-1~10-2稀释孔中,表现为猪肺泡巨噬细胞和猪红细胞不同程度破碎、崩解。
过硫酸氢钾类消毒剂对细胞状态影响可见于原液、10-1稀释孔中。其中,C4的1:200、1:800、1:1 600工作浓度原液孔中出现不同程度的猪肺泡巨噬细胞和猪红细胞破碎、崩解;C1、C2、C5的1:200工作浓度原液孔和C4的1:200工作浓度10-1稀释孔,与阴性对照组相比,猪肺泡巨噬细胞和猪红细胞轮廓模糊,折光性下降,状态相对较差,但形态未见明显异常。
二氧化氯类消毒剂对细胞状态影响较小,各培养孔中猪肺泡巨噬细胞和猪红细胞形态均未见明显异常。
2.2 、消毒剂对ASFV灭活作用试验
阳性对照组,培养6 d后,发生显着细胞病变,猪肺泡巨噬细胞大量萎缩、死亡脱落,部分猪肺泡巨噬细胞聚团且附着有大量猪红细胞,经ReedMuench法计算病毒液滴度为107.2 HAD50/m L。阴性对照组中细胞形态无异常,猪肺泡巨噬细胞轮廓清晰,大多数呈圆形或椭圆形,均匀附着于96孔板底,猪红细胞均匀散落于猪肺泡巨噬细胞间隙中。
消毒剂对ASFV灭活检测结果详见表3。季铵盐类和二氧化氯类消毒剂各1种,在本试验中各工作浓度下原液及不同稀释度培养孔种,均未发现HAD现象,与阳性对照相比,平均灭活对数为7.2,表明有效灭活ASFV。参照消毒剂说明书主要成分综合分析,季铵盐类消毒剂有效成分浓度≥0.015%溴化二甲基-二癸基烃铵(B1的1:667工作浓度),二氧化氯类消毒剂有效成分浓度≥0.007 5%二氧化氯时(D1的1:600工作浓度),可有效灭活ASFV。
含碘类消毒,主要成分为聚维酮碘时,需在说明书标明浓度范围的较高工作浓度,即A1的1:2和1:10、A2的1:20、A4的1:2和1:10、A5的1:2工作浓度时,平均灭活对数为7.2,表明有效灭活ASFV。虽然A1、A4、A5主要成分均为10%聚维酮碘,A1、A4有效成分浓度≥1%聚维酮碘(1:10工作浓度)时,可有效灭活ASFV,而A5在相同工作浓度,平均灭活对数仅为1.1~1.5,未能有效灭活ASFV,提示不同厂家同类产品消毒效果存在差异。A6、A7成分为碘、磷酸、硫酸等,与单独使用碘化物相比,杀灭病毒所需工作浓度更低,A6工作浓度高于0.33%和A7工作浓度高于1:500时,未在培养孔中发现HAD现象,平均灭活对数为7.2,表明有效灭活ASFV。此外,A3所有工作条件下,平均灭活对数均<4,本试验中未有效灭活ASFV。
表2 消毒剂对细胞状态影响试验结果
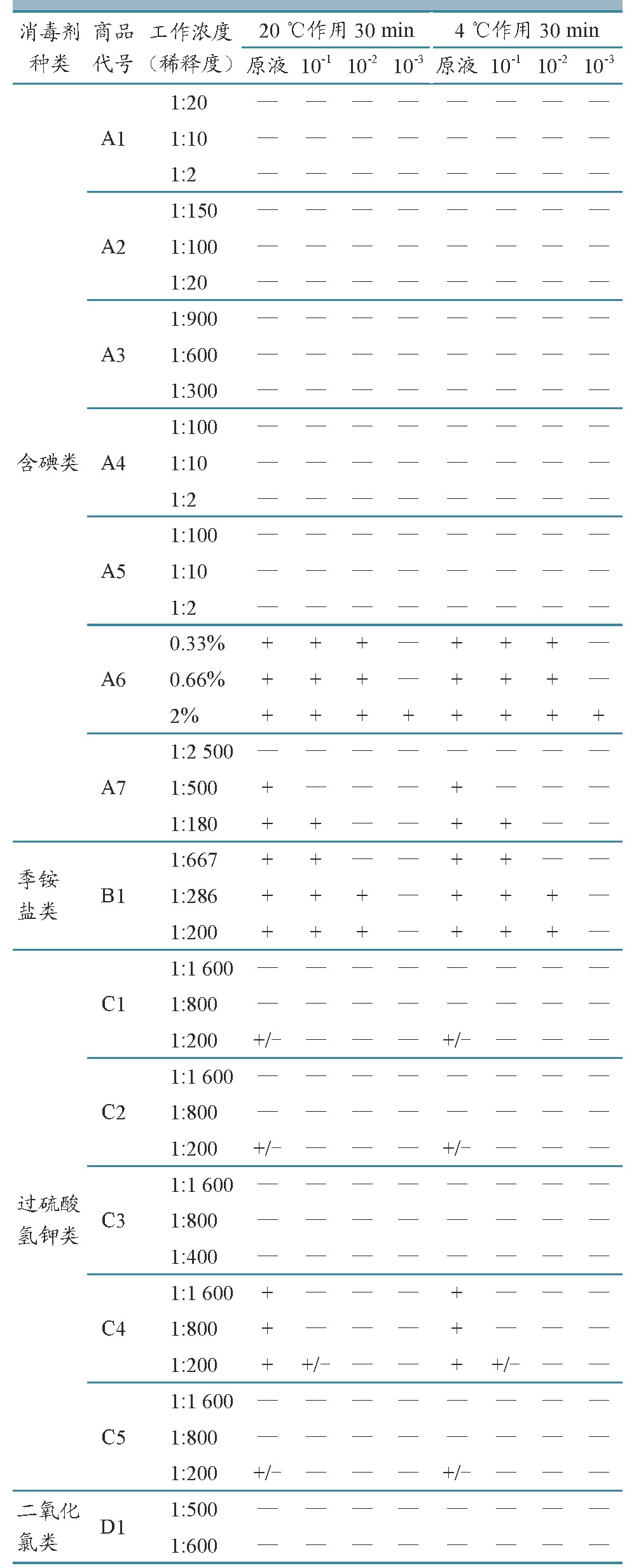
注:“+”.培养孔中出现不同程度的细胞破碎、崩解;“+/-”.培养孔细胞状态相对较差,但形态未见明显异常;“—”.培养孔细胞状态未见明显异常。
过硫酸氢钾类消毒剂需在说明书标明浓度范围的较高工作浓度时,即1:200稀释时,平均灭活对数为7.2,表明有效灭活ASFV。不同厂家生产的过硫酸氢钾类消毒剂在相同工作浓度下,灭活病毒效果有所差异,如在1:800工作浓度下,C1、C4与C5相比,灭活后病毒滴度低约1~2个对数值。此外,C3在所有工作条件下,平均灭活对数均<4,未有效灭活ASFV。
3 、讨论
理想的消毒剂应具有起效迅速、作用时间持久、受环境因素影响小等特点,并具有广谱的微生物杀灭能力,对人员无毒无害,在环境中可降解、无残留。本研究所选的含碘、季铵盐、过硫酸氢钾、二氧化氯等四类市面上常用消毒剂,毒性相对较小,对人员和环境相对安全,除用于畜禽栏舍、运载工具、器具等消毒目的外,生产实践中还常用于人员、办公场地、宿舍、公共食堂等消毒。
本研究表明,本试验所用消毒剂对ASFV均有灭活作用,但灭活效果因消毒剂的种类和工作浓度不同有所差异。相同工作浓度的同一消毒剂产品,在4℃和20℃这两种条件下的灭活效果基本一致。本试验中季铵盐类和二氧化氯类消毒剂,在说明书推荐的工作浓度下,均有效灭活ASFV;多数含碘类、过硫酸氢钾类消毒剂,需在说明书标明浓度范围的较高工作浓度时,才可有效杀灭ASFV。少数产品,各有1个厂家生产的含碘类、过硫酸氢钾类消毒剂,在说明书标明的高、中、低工作浓度均未能有效杀灭ASFV。此外,从含碘类消毒剂A1、A4、A5的1:10工作浓度,过硫酸氢钾类消毒剂C1、C4、C5的1:800工作浓度显示的效果差异,可见不同厂家生产的同类消毒剂产品其消毒效果存在差异。
消毒剂对细胞状态影响结果显示,与戊二醛类、酚类消毒剂相比,本研究中的二氧化氯类消毒剂、主要成分为碘化物的含碘类消毒剂、绝大多数过硫酸氢钾类消毒剂,在测试工作条件下,对细胞损伤相对较小。仅主要成分为碘、磷酸、硫酸等的含碘类消毒剂,及季铵盐类消毒剂的部分工作浓度下出现不同程度的猪肺泡巨噬细胞和猪红细胞破碎、崩解。
表3 消毒剂对非洲猪瘟灭活检测结果
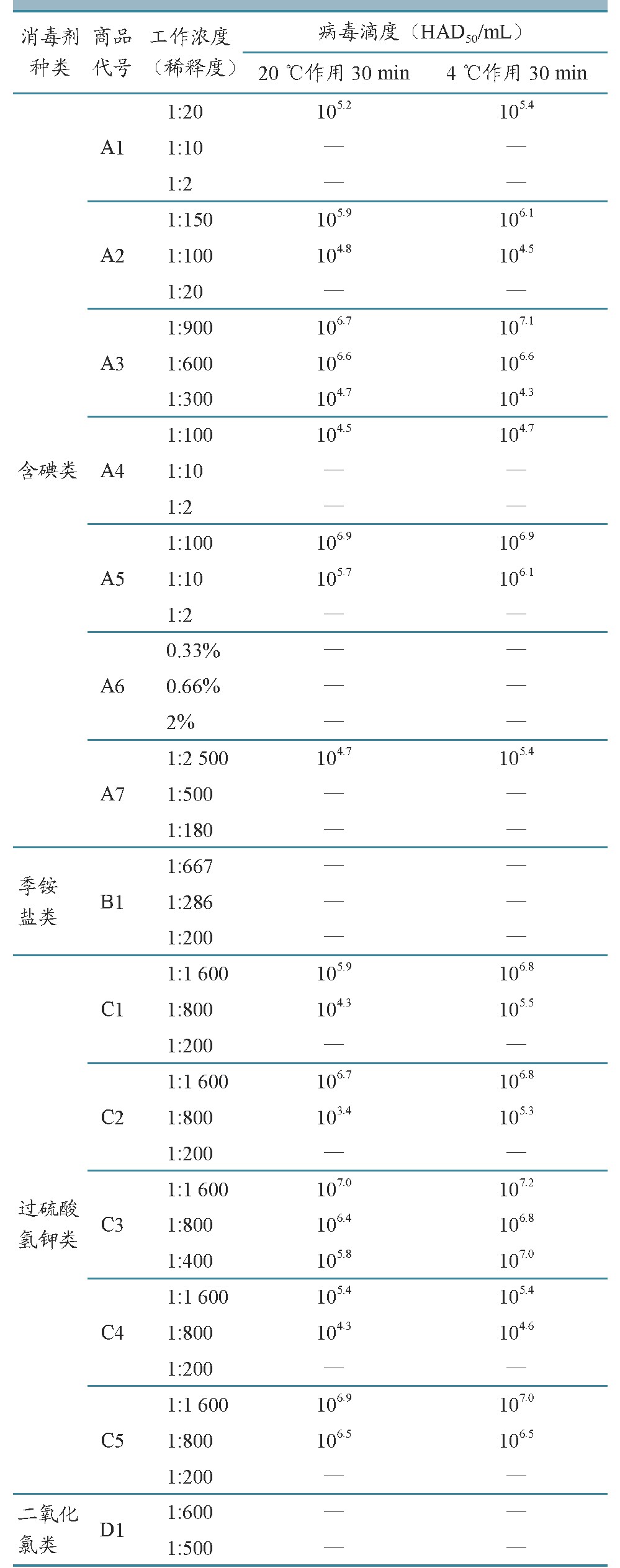
注:“—”.在原液及系列稀释的细胞培养孔中均未出现HAD现象。
在本研究测试条件下,这四类常用消毒剂均可有效灭活ASFV。但在实际应用中需结合生产实际,包括根据消毒对象性质、环境条件、表面有机物等选用合适的消毒剂种类,同时保证合理的使用浓度、作用温度和作用时间,执行严格的消毒程序,只有这样才能获得良好的消毒效果[2,8]。本研究从细胞水平上,验证评估了四类常用消毒剂对ASFV的灭活效果,可为生猪养殖、运输调运、屠宰加工、检验检疫等工作中的消毒剂的选择和使用提供参考。
参考文献
[1] BELTRAN-ALCRUDO D,ARIS M,GALLARDO C,et al.非洲猪瘟:发现与诊断-兽医指导手册[M].罗马:联合国粮食与农业组织(FAO),2018.
[2]JUSZKIEWICZ M,WALCZAK M,WOZNIAKOWSKI G,et al.Characteristics of selected active substances used in disinfectants and their virucidal activity against ASFV[J].Journal of veterinary research,2019,63(1):17-25.
[3]GALLINA L,SCAGLIARINI A.Virucidal efficacy of common disinfectants against orf virus[J].Veterinary record,2010,166(23):725-726.
[4]SHIRAI J,KANNO T,TSUCHIYA Y,et al.Effects of chlorine,iodine,and quaternary ammonium compound disinfectants on several exotic disease viruses[J].Journal of veterinary medical science,2000,62(1):85-92.
[5]KRUG P W,DAVIS T,O'BRIEN,C,et al.Disinfection of transboundary animal disease viruses on surfaces used in pork packing plants[J].Veterinary microbiology,2018,219:219-225.
[6]TURNER C,WILLIAMS S M.Laboratory-scale inactivation of African swine fever virus and swine vesicular disease virus in pig slurry[J].Journal of applied microbiology,1999,87(1):148-157.
[7] 卫生部卫生法制与监督司.消毒技术规范[S].北京:中华人民共和国卫生部,2002.
[8]李尚华,逄磊.非洲猪瘟下之猪场消毒剂选择的建议[J].今日养猪业,2019,110(2):68-69.





