
骨关节炎( osteoarthritis,OA) 是一种随年龄增长而发生率明显增加的退行性关节疾病,其发病是一个多因素参与的复杂过程[1],至今其病因和发病机理仍不是十分清楚。大量研究表明,关节软骨的退变被认为是引起 OA 和 OA 发展过程中最重要的病理环节[2-3].软骨细胞作为软骨的唯一细胞成分,其细胞的生物学特性的变化和 OA 的发生发展密切相关[4-6].
软骨细胞体外培养是了解软骨细胞生物学性状和软骨细胞分化、增殖及软骨基质合成过中影响因素的重要方法,同时也是寻找有效地防治疗 OA 的重要基础。由于 OA 本身存在的病理特征如软骨的大量磨损和退变,导致体外分离培养骨关节炎患者软骨细胞存在较大难度。因而目前针对骨关节炎的细胞水平的研究,大部分集中在动物关节软骨细胞的体外培养及相关研究领域[7-9].
然而人骨关节炎是一个多因素的结果,单纯依靠体外的模型获得的 OA 软骨细胞可能并不能真正意义上替代人的OA 软骨细胞,从而丧失其研究结果对临床的指导意义。因此,从临床上分离培养的人 OA 软骨细胞可能是 OA 研究的最佳对象。我们对人 OA 软骨细胞的分离、消化和培养进行了初步的研究,并对其细胞形态学特点进行了评价,为后期关于人 OA 软骨细胞水平的相关研究提供实验基础。
1 资料与方法
1. 1 研究对象及样本来源 所有标本均取自于四川大学华西医院骨科 10 例晚期骨关节炎行全膝关节置换患者,取材位置位于股骨内、外髁负重过渡区的关节软骨组织。其中男3例 ,女7 例 ; 年龄 ( 61 . 7 ± 6 . 69 ) 岁 ; 体重指数 ( 27 . 50 ±1. 28) .骨关节炎的诊断标准参照美国风湿病学会膝骨关节炎诊断标准[10],严格排除免疫性及其他可能影响膝关节病情的合并症,所有患者术前经全科讨论意见一致。该研究获得医院伦理委员会的批准,所有患者术前均经其本人知情同意。
1. 2 实验试剂与仪器 主要实验试剂: DMEM 低糖培养基、0. 01mol 磷酸盐缓冲液、0. 25% 胰蛋白酶、L-谷氨酰胺、青-链霉素、Ⅱ型胶原酶、二型胶原抗体、胎牛血清、Cell CountingKit-8、SYBR?Premix Ex TaqTMⅡ、TRIzol、二甲基亚砜、四甲基偶氮唑盐、DAB 显色试剂盒。实验设备: 超净工作台( Heraeus 公司,德国) 、水浴摇床( memmert 公司,德国) 、倒置相差显微镜( olympus 公司,日本) 、37℃ 5% CO2孵育箱( sanyo 公司,日本) 、多功能酶标仪、离心机、电泳仪、微量天平等。
1. 3 软骨细胞获取及培养方法
1. 3. 1 软骨细胞的分离培养 膝关节置换术中在无菌条件下显露膝关节软骨组织,以锐利刀片取 OA 患者软骨组织( 股骨髁和胫骨平台) ,用生理盐水冲洗 3 次,尖刀片刮除软骨膜后生理盐水再次冲洗 2 ~ 3 次,放入无菌的装有适量DMEM 低糖培养基( 链霉素 100 U / mL,青霉素 100 U / mL) 的50 mL 无菌离心管中立即转送至实验室。采用两步消化法分离关节软骨细胞,将软骨组织移入无菌培养皿中并用 PBS液冲洗 3 次,仔细将附带的软组织或滑液去除,移入加有少量培养基的抗生素小瓶内,干净无菌眼科剪机械粉碎至 1mm3以下。之后再将组织块转入另一 50 mL 无菌离心管中,1 000 r / min 低温离心 5 min,随后加入 5 倍体积的 0. 25% 胰蛋白酶消化 20 min,弃去上清液,用低糖 DMEM 培养基洗涤2 ~ 3 次。加入 5 倍体积的含 0. 2% Ⅱ型胶原酶低糖 DMEM溶液,置 37℃水浴箱中轻微振荡消化,一般消化 4 ~ 5 次,每次25 min,每次消化后静置 5 min 取上清液,移入事先盛有血清及低糖 DMEM 培养基的离心管中终止消化,然后 1400 r/min 离心 5 min,弃去上清液,再用低糖 DMEM 培养基洗涤 2次后待接种,每次如此分时段收集细胞,以免先消化下来的软骨细胞因消化时间过长活性下降。汇合分时段收集的细胞悬液,200 目金属滤网过滤细胞悬液( 用以除去杂质) ,所得细胞沉淀经吹打后移入含 20% 胎牛血清的低糖 DMEM 培养基的25 cm2培养瓶中,置于37℃,恒温,5%CO2,饱和湿度培养箱内培养,隔 2 d 换液。
1. 3. 2 传代及鉴定前准备 原代培养细胞覆盖瓶底 80% 以上时,吸尽培养基,PBS 液清洗 2 ~3 次后加入 0. 25% 胰蛋白酶,37℃,5%CO2 孵育箱消化 2 ~ 3 min,待镜下观察大部分细胞变圆漂浮时,加入 20% 含胎牛血清培养基终止消化,并适度拍打培养瓶底以帮助贴壁细胞顺利脱壁,1 000 r/min,离心 3 min 后加入适量 20%胎牛血清 DMEM 培养基重悬,血球计数板计数,104/ mL 传代接种进入传代培养。同时使用血盖片准备进行细胞爬片,Ⅱ型胶原免疫组化及甲苯胺蓝染色进行细胞形态学的进一步鉴定。
1. 3. 3 软骨细胞爬片的制作和固定 每孔收集细胞 8 × 104个,种植于 6 孔细胞培养板( 底部放入血盖片) ,37℃,5%CO2条件下,培养至血盖片上软骨细胞融合率达到 80%; 移除培养基,以 PBS 液冲洗 3 次,每次 1 min; 4%多聚甲醛固定10 min; 双蒸水冲洗 3 次,将细胞爬片分开; - 80℃ 长期保存,用时室温自然解冻。
1. 4 检测指标
1. 4. 1 倒置相差显微镜观察 在软骨细胞分离培养以及传代培养的各个时期通过倒置相差显微镜观察 OA 软骨细胞的形态、贴壁生长情况、生长特性及细胞密度,并拍照保存。
1. 4. 2 甲苯胺蓝染色 对各代关节软骨细胞用爬片技术,待细胞基本长满后,取出细胞爬片,PBS 液冲洗 3 次,4% 多聚甲醛室温固定 20 min,自来水漂洗 15 min,双蒸水冲洗 3次,放于染色架上,1% 甲苯胺蓝染色 30 min,双蒸水洗去多余的染液,100%无水乙醇脱水,中性树胶封片倒置相差显微镜下观察并拍照记录。
1. 4. 3 Ⅱ型胶原免疫组织化学染色 对各代关节软骨细胞用爬片技术,取出细胞爬片,放于染色架上,滴加正常非免疫动物血清室温下孵育 10 min.除去血清,滴加 1 ︰ 1 000 兔抗人Ⅱ型胶原一抗,4℃过夜。PBS 液冲洗 3 次,每次 5 min.滴加生物素标记的二抗,室温下孵育 10 min,PBS 液冲洗 3次,每次 5 min.DAB 显色,苏木精复色,无水乙醇脱水,中性树胶封片倒置相差显微镜下观察并拍照记录。
1. 4. 4 细胞增殖检测 取生长良好的第 2,4,6 代 OA 软骨细胞采用 CCK8 法绘制软骨细胞生长曲线。在 96 孔板中接种细胞悬液 100μL,7 000 个细胞; 每孔加入 10μLCCK-8; 将培养板在培养箱内孵育 2 h; 在 460 nm 测定吸光度。
共 3 块 96 孔板,隔 2 d 换液。于第 1、3、5、7、9、11 天观察,加入 CCK-8 后振荡 5 min 后酶标仪上测吸光度值,波长为取细胞数的平均值作为结果,然后绘制折线图来描绘细胞的生长情况。
2 结 果
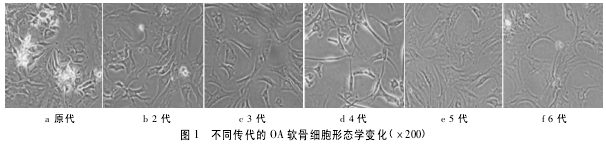
2. 1 细胞培养形态学变化 倒置显微镜观察发现,软骨原代细胞呈不均匀分布的多角形或条状,形态欠规则,似短成纤维细胞样,生长速度偏慢,约 13 d 左右可达 80%,具有细胞密度依赖性。培养至第 3 代时即已出现长梭形细胞,且生长速度开始下降,4 代后较为明显,至第 6 代细胞形态几乎全部变为长梭形,似成纤维细胞样( 见图 1) .
2. 2 细胞形态学染色鉴定 甲苯胺蓝染色均可见细胞外基质中染色呈阳性,原代软骨细胞正染以蓝色为主,经多次传代后,甲苯胺蓝染色明显减少,4 代时排列仍密集,至 6 代以后甲苯胺蓝染色蓝色表现很少( 见图 2) .
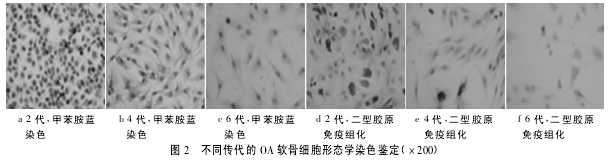
Ⅱ型胶原免疫组化染色细胞核染色呈阳性,表现为棕黄色。随着传代次数的增加,棕黄色明显减弱,阳性率降低,至第 4 代细胞仅有棕黄色着色显着减少,至第 6 代时已基本呈阴性,无棕黄色。
2. 3 生长曲线 利用 CCK8 法绘制软骨细胞生长曲线,明确了该细胞的指数生长时间。第 2 代 OA 软骨细胞经培养后,1 ~5 d 为潜伏期,增殖速率很慢,第 5 天细胞开始加速增殖,7 d 左右增殖最明显,呈指数增长。第 9 天后,细胞增长明显放缓。第 4、6 代 OA 软骨细胞的生长曲线与第 2 代细胞基本相同,但增殖峰值低,指数增长期时间短,且这一变化随传代次数的增多而愈发明显( 见图 3) .

3 讨 论
由于种属的差异,来源于动物的关节软骨细胞其生物学特征与人关节软骨细胞的生物学特征差异较明显,且经一些因素作用而来的骨关节炎模型并不能模拟出人骨关节炎的多因素影响,所以不能完全代替人类的软骨细胞进行实验研究。而从临床上经体外分离、培养所获得的人骨关节炎关节软骨细胞,与人体的生理状态相符合,其研究结果可信、可靠,对临床进行骨关节炎的防治研究更具有指导意义。随着医学技术的发展,已经有众多的学者开始由动物关节软骨细胞的体外培养及诱导成模转向从临床获得人关节炎软骨细胞再进行实验研究[11-13].本实验采用胰蛋白酶及Ⅱ型胶原酶联合消化法获得了大量高纯度、高活性的人关节软骨细胞。研究结果发现 4 代以内细胞生长良好,6 代以后出现大量的去分化现象; 形态学、免疫组织化学染色显示细胞培养也证实 4 代以内可以保持表型的稳定。
软骨细胞及周围软骨基质共同构成了关节软骨的主要成分。与其他结缔组织不同,软骨不包含血管,软骨细胞是主要靠滑膜分泌的关节液所营养,且成熟的软骨细胞被完全包裹在大量的细胞外基质中而无法迁移或增生。因此,相对于其他结缔组织软骨生长和修复更加缓慢[14].软骨细胞无特异性标志物,但是软骨细胞可以产生大量基质成分氨基多糖和Ⅱ型胶原。Ⅱ型胶原为软骨细胞的基因表达产物,可以通过其来确定软骨细胞的表型。本实验通过对软骨细胞分泌的氨基多糖的甲苯胺蓝染色和Ⅱ型胶原的免疫组织化学染色,再结合取材部位和培养过程中的观察,证实所培养的细胞为人的软骨细胞。
研究发现在人正常软骨细胞体外培养过程中,由于细胞外环境与体内内环境差异的存在,软骨细胞的表型难以保持长久的稳定,进而细胞逐渐丧失其生物学特性,细胞形态、分化、增殖等都将发生一系列变化[15-17].童迅等[18]研究显示,正常人的软骨细胞在培养 5 代以内细胞生长良好,生物学特性明显,5 代以后出现去分化现象,骨关节炎软骨细胞增殖慢,生物学特征退变更早。胡炯等[19]研究显示,骨性关节炎软骨细胞形态似成纤维细胞,生长速度明显较正常软骨细胞慢,Ⅱ型胶原免疫组化和甲苯胺蓝染色均较弱,传至第 4代软骨细胞生物学特性基本消失。我们的研究显示,OA 软骨细胞在体外培养时随传代次数的增加,细胞会逐渐走向衰老和去分化; 甲苯胺蓝染色原代软骨细胞正染阳性,传代至 4代后,甲苯胺蓝染色显着减少,至 6 代以后甲苯胺蓝染色蓝色阳性率很低; Ⅱ型胶原免疫组化染色细胞核染色呈阳性,随着传代次数的增加,至第 4 代细胞显着减少,至第 6 代时已基本无棕黄色。这与童讯和胡炯等人的研究一致,表明骨关节炎软骨细胞分泌的氨基多糖和Ⅱ型胶原随传代次增加出现过早退变的生物学特征。
本研究的细胞生长曲线图显示随着传代次数的增加,细胞的增值峰也逐渐降低,2 代细胞较 4 和 6 代细胞具有更好的分化能力。这种 OA 软骨细胞增殖特性提示我们4 代以内的细胞可能是用于实验研究的选择范围。
总之,本实验采用胰蛋白酶及Ⅱ型胶原酶联合消化法可成功从体外分离出骨关节炎软骨细胞,2 代的骨关节炎软骨细胞具有高增值峰,4 代以内的软骨细胞表型稳定,生长良好。这种 OA 软骨细胞增殖特性提示我们 2 或3 代软骨细胞是用于实验研究的最佳选择,为进一步研究人软骨细胞的其他生物学特性及骨关节炎的发病机制提供了实验基础。本研究的不足之处在于没有使用正常关节软骨细胞进行对照研究。
参考文献:
[1] Creamer P,Hochberg MC. Osteoarthritis[J]. Lancet,1997,350( 9076) : 503-508.
[2] Isogai N,Kusuhara H,Ikada Y,et al. Comparison of dif-ferent chondrocytes for use in tissue engineering of car-tilage model structures[J]. Tissue Eng,2006,12 ( 4) :691-703.
[3] Alsalameh S,Amin R,Gemba T,et al. Identification ofmesenchymal progenitor cells in normal and osteoarthri-tis human articular cartilage [J]. Arthritis Rheum,2004,50( 5) : 1522-1532.
[4] Beatriz C,Noboru T,Shuhei O,et al. Autophagy is aprotective mechanism in normal cartilage and its aging-related loss is linked with cell death and osteoarthritis[J]. Arthritis Rheum,2010,62( 3) :791-801.





