
细胞的微管是细胞内骨架结构之一, 对细胞生命活动起至关重要的作用, 如细胞正常形态构建与维持、细胞内货物运输、细胞迁移、细胞分裂等[1,2]. 细胞功能的发挥依赖于细胞微管的动态不稳定性以及可调控性, 尤其是细胞在时间与空间上对其进行精确的调控。 细胞微管除了形成细胞内的骨架结构, 还可以在细胞分裂时期形成有丝分裂的纺锤体以及在细胞间期形成突出于细胞表面的特异化细胞器, 称之为纤毛(或鞭毛)。 纤毛作为细胞表面突出的“天线”, 既可以作为运动器官, 也可以作为“信号接收器”, 介导了细胞的运动与信号转导。
细胞微管由a和b微管蛋白构成, 两者形成异源二聚体首尾衔接组成微管原丝, 13根微管原丝组成的圆筒状结构形成了典型的微管, 其直径24~26 nm,壁厚5 nm, 中间腔直径15 nm, 长度不定。 由于组成微管的异源二聚体具有极性, 所以微管也具有极性,b微管蛋白指向正端, a微管蛋白指向负端[3,4]( 图1(b))。 微管的负端指向细胞微管发生区微管组织中心(由中心粒组成), 而中心粒是由9组3联体微管组成的中空结构, 发射出的微管辐射于整个细胞。 特异化的微管细胞器纤毛主要也是由微管蛋白二聚体组成,分为“9+2”型和“9+0”型的纤毛, 发生于由中心粒组成的基体(basal body), 是纤毛的微管组织中心[5~7].
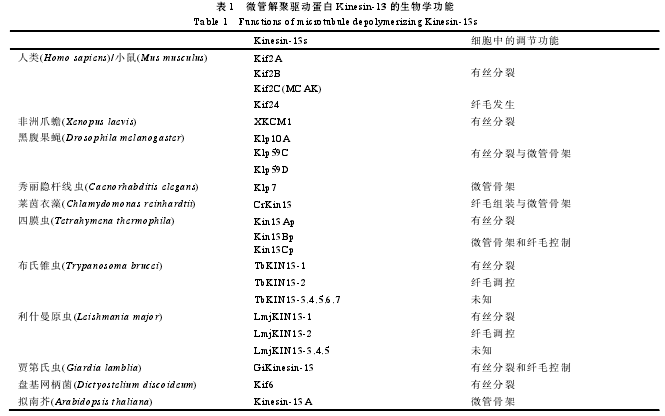
生物学功能的有效发挥需要微管在体内进行动态的调节, 目前发现多种微管相关蛋白可以协助执行此功能[8]. 例如, tau蛋白可以稳定微管[9], katanin蛋白可以切割微管[10], EB蛋白家族和CLASP蛋白家族结合在微管的末端发挥调节作用[11,12]. 而驱动蛋白家族(Kinesin)成员较为特殊, 包含与微管侧壁结合并沿微管运动的蛋白, 以及作用于微管末端并调节微管动态学变化的蛋白[13,14]. 本文将重点阐述Kinesin中对于微管具有解聚作用的Kinesin-13亚家族成员在不同研究体系中的功能与作用机理的研究进展(表1)。
1 Kinesin-13 家族概述
在人类基因组中目前已知存在45种驱动蛋白,其中9种驱动蛋白参与了细胞微管的动态学变化。 遗传与生化实验证明Kinesin家族成员的共同点是拥有高度保守的马达结构域(motor domain), 并且可以与微管结合[15,16]. 总体来讲, 马达结构域位于氨基端(N-terminal)的Kinesin行使沿微管正向运输功能, 位于羧基端(C-terminal)的Kinesin行使沿微管负向运输功能, 而位于中部的, 则不会沿微管运输, 但执行微管解聚功能, Kinesin-13就属于此分类[13,14](图1(a))。
但是目前的研究表明, 一些特殊的Kinesin并不遵循此规律, 例如, Kinesin-8和Kinesin-14可以分别沿微管进行正向与负向运输, 但是同时也可以解聚微管[17,18].那么微管是怎么被微管解聚驱动蛋白Kinesin-13解聚的? Kinesin-13一般形成二聚体结构执行相应微管解聚的功能[13]. 总体来说, 微管解聚驱动蛋白可以造成微管末端的微管原丝形成弯曲的构象, 从而使微管的末端逐个解离微管原丝的ab微管蛋白二聚体(图1(b))。 其详细的作用机制为: Kinesin-13不会沿着微管进行直接运动, 而是以展开的构象、相对微弱的结合力结合在微管的侧面, 然后向正负两端随机扩散[19~21]. 当Kinesin-13扩散至微管的末端, 空间结构发生变化, 紧密结合微管末端原丝, 使相邻的双条微管原丝空间结构发生弯曲, ATP水解产能, 促进微管末端二聚体的解离[21~27]. 在执行解聚微管过程中,依赖于Kinesin-13的ATP结合形式与ADP结合形式的循环, 来动态调节与微管结合的紧密程度, 以较高的效率促进微管解聚作用[26].
研究表明, Kinesin-13的马达结构域对于微管的解聚是必需的, 并且马达结构域的存在足以在体外进行微管解聚作用[28]. 因此, 马达结构域是Kinesin-13家族具备微管解聚能力的共性。 尽管具有马达结构域的Kinesin-13已经具备微管解聚能力, 但是全长Kinesin-13则是进行微管解聚的更有效分子形式, 说明其他的功能域也是必需的[19,29]. Kinesin-13的N端结 构 域 对 于 蛋 白 的 亚 细 胞 定 位 是 必 需 的 , 而Kinesin-13 的 C 端结构域对于二聚化是必需的 ( 图1(a))。 而 富 有 正 电 荷 氨 基 酸 的 颈 部 结 构 域 (neckdomain)对于Kinesin-13微管解聚活性的高效发挥是必需的[29,30]. 对Kinesin-13解聚微管构型的研究发现,Kinesin-13的凸面结构与微管原丝弯曲的空间具备互补性, 揭示Kinesin-13是如何高效解聚微管的[29,31].
如果将Kinesin-13进一步进行系统分类, 可以将其分为2个小家族: 动物特有的亚类Kif2和原始的亚类Kif24[32]. 在Kinesin-13家族成员中普遍存在的邻近中间马达结构域的neck结构域[30](图1(a)), 并非存在于原始Kinesin-13家族成员中, 如LmjKIN13-2(利士曼原虫), CrKin13(衣藻)等, 所以原生生物的Kinesin-13属于后者, 并且不具备neck结构域这一特有的结构。

2 Kinesin-13 在细胞中执行的主要功能
Kinesin-13在细胞中执行与微管结构动态学变化方面的相关功能, 研究发现该蛋白主要参与细胞分裂与纤毛的调控(图2), 下面作详细的阐述。
2.1 Kinsein-13在细胞分裂中的功能
在细胞分裂时期, 染色体需要正确进行中期排列与末期向纺锤体两极对称分离, 从而完成精准的细胞周期调控[33]. 研究发现, Kinesin-13蛋白以“微管侧面滑动, 末端捕获解聚”机制来进行细胞分裂中纺锤体微管的动态学变化, 控制分裂周期纺锤体中心粒微管与动粒微管的解聚, 从而促进染色体的正确排列与分离[32,34~36]. 因此, Kinesin-13可以调节有丝分裂的顺利进行。
免疫去除爪蟾卵细胞提取物中的XKCM1/Kif2C,将导致微管“灾变”(catastrophe)频率的降低, 形成长的纺锤体微管, 从而造成纺锤体微管的异常[37]. 而过多的Kinesin-13同样造成因微管过短而未形成功能性的纺锤体[38]. 同样的研究结果也出现在哺乳动物细胞中, 过表达Kinesin-13蛋白造成微管“灾变”频率的增加, 并导致微管数目的降低[39,40]. 在哺乳动物细胞中, Kinesin-13家族成员Kif2B促进动粒微管的正确装配[41], 而 Kif2A则促进纺锤体两极微管的正确装配[42,43]. MCAK/Kif2C则是定位于着丝粒区域微管,调节该区域微管的正确装配[44,45]. 因此, 实验数据说明, 不同的Kinesin-13家族成员可能位于细胞内不同的亚区位来发挥其微管解聚活性, 从整体上确保纺锤体微管正确装配与染色体正确分离。
黑腹果蝇的Klp10A在细胞分裂时期促进后期染色体的分离[46,47]. 进一步研究发现, Klp10A作用于纺锤体两极微管, 而Klp59C对于解聚染色体动粒微管是必需的, 正负两端协同作用促进染色体有效分离[46,48,49]. 另外 , 在果蝇中存在的另一个家族成员Klp59D也是解聚动粒微管, 并间接影响Klp10A定位于两极微管处, 从而促进染色体分离[50].
在盘基网柄菌中, Kif6对于该菌的存活至关重要, 缺失Kif6导致该菌染色体分离滞后, 纺锤体形态异常等有丝分裂缺陷, 这与哺乳动物和爪蟾中Kinesin-13家族成员在有丝分裂过程中扮演的角色是一致的。

2.2 Kinesin-13在纤毛调控中的功能
纤毛是由基体(中心体)形成的“9+2”或者“9+0”型的微管结构, 突出于细胞表面, 并且在动物细胞中分布广泛[52]. Kinesin家族中的异源三聚体Kinesin-2驱 动 蛋 白 被 认 为 是 纤 毛 内 运 输 (intraflagellartransport, IFT) 的核心 , 用以维持与再生纤毛[53~55].然而, 纤毛中除了含有异源三聚体Kinesin-2之外, 还包含多种Kinesin蛋白参与行使纤毛的功能[56]. 而其中Kinesin-13调节纤毛组装与控制纤毛长度的研究成果最为丰富。
研究发现, 布氏锥虫编码7个Kinsein-13蛋白, 其中TbKIN13-2主要定位于布氏锥虫的纤毛, 是利什曼原虫LmjKIN13-2的同源蛋白, 对于纤毛轴丝具有有限的调控作用, 而LmjKIN13-2对于纤毛轴丝的调控作用较强[57~59]. 与锥虫相似的利士曼原虫含 5 个Kinsein-13蛋白, 其中LmjKIN13-2蛋白定位于纤毛,过表达该蛋白导致利士曼原虫纤毛缩短而敲低该蛋白导致利士曼原虫纤毛增长。 其中微管解聚基序(KVD)和微管结合基序(KEC)分别起微管解聚与结合的作用, 当在利士曼原虫中将该基序突变将会导致由LmjKIN13-2所引起的纤毛缩短效应的降低[58]. 二者的TbKIN13-1与LmjKIN13-1属同源蛋白, 仅参与有丝分裂调控, 未参与纤毛调控[57,60].
四膜虫含有3个Kinesin-13家族成员, 分别为Kin13Ap, Kin13Bp和Kin13Cp[57]. Kin13Ap与纤毛无关, 而Kin13Bp和Kin13Cp则定位于细胞体与组装的纤毛中, 与细胞骨架形态、运动和纤毛长度相关[61].
贾第氏虫的GiKinesin-13蛋白既调控贾第氏虫纤毛长度, 又调控细胞周期微管动态学变化。 体内表达Kinesin-13(S280N)蛋白促使贾第氏虫8根纤毛显着地增长, 中体体积显着减小并且伴随着有丝分裂缺陷。
另外, 使用影响微管稳定性的nocodazole(去稳定剂)与taxol(稳定剂), 将影响依赖于微管动态变化的有丝分裂和纤毛[62].对衣藻的研究发现其仅含有一个Kinesin-13基因[63]. 敲低衣藻的CrKin13导致衣藻纤毛组装和解聚的缺陷: 一方面, CrKin13解聚胞质微管为再生的纤毛提供微管组装的前体蛋白; 另一方面, 在纤毛缩短时, 参与纤毛轴丝微管的解聚。 在这2个过程中都发生了CrKin13的磷酸化调控。 CrKin13是否参与了细胞分裂的调控, 目前未知[64,65]. 最新的研究表明, 衣藻中的CDKL蛋白在纤毛远端缩短时可以阻止CrKin13早期磷酸化[66]. 表明CDKL在纤毛缩短时对Kinesin-13的调控作用, 而其直接负责磷酸化的激酶还未阐明, 但是在哺乳动物中研究发现Aurora激酶可以直接对Kinesin-13进行磷酸化, 或许给研究者们带来了启示。
大部分的Kinesin-13与纤毛关系的研究集中于原生生物, 目前仅了解到哺乳动物细胞的Kif24与Kif2A和纤毛相关。 Kif24与CP110和Cep97相互作用调控, 负向调控纤毛发生, 而Kif2A的缺失则导致哺乳动物细胞纤毛解聚的缺陷[67,68].
3 Kinesin-13 的调控
在Kinesin-13调控研究方面, 其磷酸化的研究最为全面与广泛。 Aurora激酶已被广泛地研究, 并认为其参与调控有丝分裂纺锤体微管正确装配过程。Aurora激酶通过磷酸化MCAK/Kif2C从而调控MCAK在有丝分裂时期的定位与微管解聚活性[21,69~71].
对哺乳动物细胞与爪蟾的研究发现, MCAK/Kif2C受Aurora B的调控, 纠正错误装配的染色体微管。 利用体外实验与质谱分析技术研究发现, MCAK蛋白上的很多位点被Aurora B激酶磷酸化修饰, 从而控 制 MCAK的 定 位 与 活 性[44,45]. ( ⅰ ) 磷 酸 化 的MCAK将有助于定位在着丝粒区域, 从而发挥其微管解聚活性[45]; (ⅱ ) 不同类型的着丝粒微管上的MCAK比例有所不同, 例如, merotelic型着丝粒微管(非正确装配型, 一个动粒同时被附着来自两极纺锤体微管)上低磷酸化/S196磷酸化的MCAK比例较高,说明需要更多的高活性MCAK去纠正错位的微管装配, 而amphitelic型着丝粒微管(正确装配型, 每一个姐妹染色单体动粒分别附着于临近中心体的纺锤体微管)上低磷酸化/S196磷酸化的MCAK比例较低, 则不需要过多高活性的MCAK[72]. 使用爪蟾提取物及点突变MCAK实验表明, T95位点磷酸化促进MCAK在有丝分裂G2时期染色体的定位, 而S196位点磷酸化将抑制MCAK与要进入有丝分裂期染色体的结合,S110 位点的磷酸化与 T95 位点的去磷酸化则促进MCAK定位于着丝粒部位[70]. 因此, MCAK的磷酸化时空调节对MCAK的定位与功能发挥、染色体排布与分离是至关重要的。
另外, 在爪蟾中ICIS蛋白同样可以激活Kif2A蛋白, 促进其发挥微管解聚活性[43]. 在哺乳动物细胞中, Kif2A可以被磷酸化正向或负向调控, Aurora A负向调节其微管解聚的活性而Plk1正向调节其微管解聚的活性[42]. 而且, S157位点磷酸化抑制Kif2A的微管解聚活性, 而T97位点被Aurora B磷酸化决定其空间分布与活性, 从而精确控制Kif2A在不同区域的解聚活性[43,73]. 而Kif2A的T554位点被Plk1磷酸化, 通过Plk1-Kif2A信号通路来参与纤毛解聚信号通路[68].Kif2B则在促进动粒微管的正确装配过程中受Plk1磷酸化调节, 其中T125位点促进Kif2B对动粒微管的错误修复, 而S204位点则利于Kif2B动粒的定位与在有丝分裂前中期的活性[41]. 其他激酶的研究结果表明一些激酶可以直接磷酸化或调控Kinesin-13的磷酸化, 其中包括CDKL[66], CDK1[74]和PAK1[75]等。
研究发现, 未磷酸化Kinesin-13在微管的末端发挥其微管解聚活性时, 其空间结构处于闭合状态, 即Neck 结 构 域 与 C 端 结 构 域 相 互 作 用 , 有 利 于Kinesin-13紧密结合在微管末端的微管上, 从而促进微管蛋白从微管上解离下来[21]. 然而, 磷酸化Neck结构域中的S196位点造成Kinesin-13空间结构的变化, 阻止Neck结构域与C端结构域的相互作用, 而处于一种展开的构象, 不能使Kinesin-13紧密结合在微管末端, 从而降低微管解聚的活性[21]. 因此, 研究表明, Kinesin-13微管解聚活性降低的根本原因在于磷酸化调控改变其空间构象, 抑制其与微管结合的能力, 从而抑制其解聚酶活性。
除磷酸化调控外, 在细胞中也需要其他蛋白因子参与Kinesin-13微管解聚活性, 共同的正向或负向调节Kinesin-13的微管解聚活性。 例如, 哺乳动物细胞中, MCAK与EB蛋白结合定位于微管末端, 负向的调 节 纺 锤 体 两 极 微 管[76]. Kif18A 和 Kif18B 均 与MCAK调控相联系, 发挥强大的微管解聚活性, 促使微管快速地进行重塑[77,78]. 在果蝇胚胎分裂时期, 姐妹染色体的分离依赖于纺锤体微管的精确调控, 而需要微管负端稳定因子CAMSAP/Patronin/Nezha拮抗Kinesin-13解聚微管活性, 以便有丝分裂后期纺锤体微管向两极牵拉姐妹染色体[79], 而在哺乳动物细胞中该蛋白起相同的作用[80]. 另外, Cep170蛋白有助于Kif2B定位于有丝分裂纺锤体, 从而提高其调节纺锤体微管的能力[81]. 而果蝇的Klp10A需要有CP110,从而作用于纺锤体两极微管[48].然而, 纤毛的Kinesin-13调控研究则相对较少。
在人类细胞中Kif24与中心体CP110, Cep97相互作用,解聚中心体微管从而控制中心体微管的正确装配,缺失该蛋白会诱导纤毛的发生[67]. 最新的研究发现Plk1磷酸化Kif2A的T554位点, 激活其在中心粒上的微管解聚活性, 从而介导初级纤毛的解聚[68]. 在原生生物的研究中, 典型代表是衣藻CrKin13的磷酸化调节机制, 发现CrKin13在纤毛组装时期可以被磷酸化S100位点, 从而有利于CrKin13定位于胞质微管上, 发挥微管解聚酶的活性, 从而为纤毛组装提供游离微管蛋白, 但是其磷酸化调节的激酶是未知的[64,65]. 因此要深入了解纤毛调控分子机制, 应更加深入地研究Kinesin-13的相互作用蛋白与激酶, 建立纤毛调控分子信号通路。
4 讨论与展望
随着Kinesin-13的功能与调节机制研究的不断深入, 人们对该家族成员在不同模式生物中是如何发挥功能的认识也越来越清楚, 但是还有很多问题值得进一步研究, 以便从结构、功能、调节、通路等各个层面全面掌握Kinesin-13的信息, 将Kinesin-13作为疾病, 尤其是癌症与纤毛类疾病的作用靶点[82,83],去诊断和治疗相关疾病, 意义重大。 基于目前对Kinesin-13的研究和了解, 需要注意以下4个问题, 才能更好地研究Kinesin-13的调节机制与功能。
4.1 同一个Kinesin-13在不同细胞组织或时期发挥功能
Kif2A被广泛认为在细胞有丝分裂过程中, 控制着纺锤体两极微管的解聚, 从而介导染色体的正确分离, 但是该蛋白也在处于细胞间期的细胞中发挥其微管解聚功能, 参与细胞其他生理学功能。 研究发现Kif2A在神经细胞中富集表达, 并且与囊泡结构相关[84]. 在Kif2A-/-小鼠中, 由于Kif2A在神经轴突发育过程中所起的微管解聚作用丧失, 造成大脑神经轴突分支的迷乱, 并且在人大脑皮层的相关研究中发现缺失Kif2A同样造成大脑发育障碍[85,86]. 另外,Kif2A在神经轴突发育与修复过程中发挥重要作用,PIPKa激活Kif2A从而抑制轴突分支迷乱[87,88]. 因此,Kif2A在神经细胞中的作用, 可能与人类神经性疾病相关。 最新的证据表明了之前广泛认为的参与细胞周期纺锤体调控的Kif2A还通过磷酸化激活介导初级纤毛的解聚[68], 以及参与爪蟾胚胎的发育过程[89].
在线虫中, 仅存在一个Kinesin-13蛋白Klp7[90].研究发现, Klp7的突变体不仅造成轴突异常变长,并且伴随细胞分裂异常[90~92], 说明该蛋白承担了不同细胞组织与时期所发挥的2项生物学功能。 而果蝇中的Klp10A与Klp59C, 除了在细胞分裂时期促进染色体分离, 还可以在细胞分裂的间期影响胞质微管动态学的变化[93], 并且Klp10A在间期细胞的中心粒区域调节中心粒微管的解聚, 维持中心粒正确形态[48].因此, 在研究Kinesin-13的过程中要注重该蛋白在不同组织细胞与时期的功能, 有助于全面了解该蛋白的生物学功效。
4.2 同一细胞内的不同 Kinesin-13 发挥不同的功能
很多物种中存在多个Kinesin-13蛋白, 因此不同Kinesin-13在细胞中起不同功能, 通过协同效应达到细胞内环境的稳态。 例如, 在果蝇的间期细胞中Klp10A和Klp59C协同发挥作用并定位于微管正向末端, Klp10A促进微管的“灾变”, 而Klp59C抑制微管的“挽救”(rescue)[93,94]. 在细胞分裂时期3个Kinesin-13家族成员Klp10A, Klp59C, Klp59D, 协同地发挥微管解聚活性而促进染色体的分离与细胞分裂, 但是也有具体不同的分工, Klp10A作用于纺锤体两极微管,Klp59C对于解聚染色体动粒微管是必需的, Klp59D则也是解聚动粒微管, 并间接影响Klp10A定位于两极微管[46~50]. 同样地, 在哺乳动物细胞中存在的3个家族成员Kif2A, Kif2B, MCAK/Kif2C均对有丝分裂的正确进行是至关重要的, 通过协同作用达到染色体正确排列与分离, 而具体的角色又有不同的分工,Kif2B, MCAK/Kif2C促进着丝粒区域微管的正确装配 , 而 Kif2A 则 促 进 纺 锤 体 两 极 微 管 正 确 装配[36,41~45,73]. 因此, 每一个生物体系中, 有不同数目的Kinesin-13, 必然也伴随功能的精细分工与不同的调节机制, 所以去进一步揭示每个Kinesin-13在不同体系中扮演的角色及其调节机制是未来研究工作的重点, 这对于从整体了解Kinesin-13在细胞中如何协同发挥功能是重要的, 并且具有实践指导的重要意义, 例如, 如何将Kinesin-13作为靶点进行药物治疗,但要同时考虑其协同作用的机制。
4.3 不同生物细胞中的同一Kinesin-13功能与调节机制不尽相同
虽然Kinesin-13的本质属性均是发挥微管解聚的活性, 但是在不同的细胞体系中其具体的调节机制将会影响Kinesin-13在细胞中生物学功能的发挥。 例如, 果蝇中的Kinesin-13蛋白Klp10A是通过与CP110结合成复合物, 从而控制果蝇中心粒长度, 但其是否控制纤毛发生还未曾报道, 而哺乳动物细胞中的Kif24也与CP110结合成复合物, 但是不控制中心粒长度, 而控制纤毛发生[48,67]. 这些现象表明了不同物种 的 细 胞 类 型 不 同 , 调 节 机 制 不 同 , 从 而 影 响Kinesin-13 的 功 能 发 挥 . 在 原 生 生 物 中 , 衣 藻 的CrKin13敲低之后导致纤毛组装速率降低, 纤毛长度变短, 然而敲低利士曼原虫中同源蛋白LmjKIN13-2的表达将导致其纤毛变长, 但是在布氏锥虫中敲低TbKIN13-2则又对纤毛的影响有限[58,59,64,65]. 上述的研究同样表明纤毛类Kinesin-13也表现出在不同模式生物中具备不同的生物学功能。 因此在以后的研究中应当注意虽然Kinesin-13解聚微管的本质属性是一致的, 但是由于在不同体系内的调节机制可能不尽相同, 造成了最终反映的生物学功能也不尽相同, 甚至相反的现象。
4.4 Kinesin-13丰富的功能有待研究发
从 以 往 的 研 究 数 据 来 看 , 也 不 能 轻 易 断 定Kinesin-13仅呈现上述常见的功能, 如有丝分裂调控与纤毛调控。 因为在布氏锥虫与利士曼原虫的研究中发现, 除了研究较多的2种Kinesin-13执行有丝分裂与纤毛控制的功能, 这2种物种仍包含其他多种Kinesin-13 蛋白 , 很可能介导其他还未发现的功能[57,58]. 在拟南芥中, Kinesin-13A定位于高尔基体,与毛状体发生及细胞次生壁形成相关[95,96]. 这些研究数据暗示着Kinesin-13可能包含其他的生理学功能, 但需要更多Kinesin-13研究数据的支持。
参考文献
1 Nogales E. Structural insight into microtubule function. Annu Rev Biophys Biomol Struct, 2001, 30: 397–420
2 Heald R, Nogales E. Microtubule dynamics. J Cell Sci, 2002, 115: 3–4
3 Mitchison T J. Localization of an exchangeable GTP binding site at the plus end of microtubules. Science, 1993, 261: 1044–1047
4 Desai A, Mitchison T J. Microtubule polymerization dynamics. Annu Rev Cell Dev Biol, 1997, 13: 83–117
5 Gaertig J, Wloga D. Ciliary tubulin and its post-translational modifications. Curr Top Dev Biol, 2008, 85: 83–113
6 Verhey K J, Dishinger J, Kee H L. Kinesin motors and primary cilia. Biochem Soc Trans, 2011, 39: 1120–1125
7 Benmerah A. The ciliary pocket. Curr Opin Cell Biol, 2013, 25: 78–84
8 Walczak C E. Microtubule dynamics and tubulin interacting proteins. Curr Opin Cell Biol, 2000, 12: 52–56





