
外排体(Exosome)是由多种细胞的胞内体衍生而来,通过出芽方式释放到细胞外的一种脂质双层膜性结构〔1〕,大小为40~100nm。由于其携带母细胞成分已逐渐被认为是细胞间进行信息交流,从而产生相互作用的新方式。树突状细胞(DC)作为一种体内分布广泛、最强的抗原提呈细胞,在成熟的过程中可产生外排体(DCex)。DCex除表达一些 非特异性抗原外,还 表 达MHC-Ⅱ类 分 子、CD83、CD86、CD80等免疫抗原,许多研究证实其具有激活免疫反应、抗肿瘤的作用〔2〕。近年来,越来越多的研究表明DCex也具有诱导免疫耐受的功能〔3〕。因此,由于DCex的免疫调节功能和其本身的稳定性、易获得性,已在肿瘤治疗、诱导移植耐受和治疗自身免疫性疾病中引起广泛关注。间充质干细胞(mesenchymal stem cells,MSC)是一种来源于中胚层、成纤维样贴壁生长的细胞,因其具有多向分化潜能、免疫调节和分泌细胞因子的能力,已成为研究治疗免疫疾病和组织修复等的重要手段。
MSC可调节多种免疫细胞的功能,其中DC是MSC免疫调节作用中重要的效应细胞,其重要性已经在MSC应用于造血干细胞移植的临床试验中得到证实。然而,细胞间的调节可能是双向的,在MSC影响DC成熟及发育的同时,DC是否也对MSC能产生作用,目前尚未见到相关报道。本文将主要在体外进行探 讨DC是 否 可 以 通 过 释 放DCex的方式对MSC增殖产生影响。
1 材料与方法
1.1 材料与试剂
人骨髓标本来自于空军总医院血液科健康供者,标本采集经医院伦理委员会要求执行;人淋巴细胞分离液Ficoll(1.077g/ml)购于天津灏洋生物制品科技有限公司;α-MEM、RPMI-1640基础培养基购自美国Gibco公司;胎牛血清(FBS)购自Hy-clone公司;重组人粒细胞-巨噬细胞刺激因子(GM-CSF)、重组人白细胞介素-4(IL-4)、肿瘤坏死因子α(TNF-α)均购于北京新明力泰生物科技有限公司;脂多糖(LPS)、MTT购于美国Sigma公司;CFSE染料购于北京碧云天生物科技有限公司;PE或FITC标记的鼠抗人CD83、CD86、CD80单抗、Per-cp标记的HLA-DR单抗购自于美国BD公司。
1.2 方法
1.2.1 人骨髓MSC的分离、培养及鉴定实验室骨髓标本取自骨髓移植健康供者,经知情同意以及医院伦理委员会批准后采集。细胞分离、培养及鉴定按本 实 验 室 常 规 方 法 进 行〔4-6〕。将 骨 髓 液 用PBS以1︰1的比例稀释后沿离心管壁缓慢加到淋巴细胞分离液(Ficoll液)上,以2 000r/min离心30min,吸出白膜层细胞,即为单个核细胞。
PBS洗涤2次后接种于含10%FBS的α-MEM培养液中,经72h后去除非贴壁细胞,更换新培养液。以后每3天更换新鲜培养液。当细胞80%~90%融合时,胰蛋白酶消化传代。取P3代细胞进行流式鉴定和诱导分化功能鉴定,细胞高表达CD44和CD73,不表达CD31和CD45。此外,细胞具有体外成脂和成骨分化能力。取第3~5代细胞用于实验。
1.2.2 人骨髓来源DC的培养及鉴定同上分离得到单个核细胞,按2×106/ml细胞密度接种于含10%FBS的RPMI-1640培养液中,静置于37℃、5%CO2孵箱。2h后去除非贴壁细胞,更换为含GM-CSF 1 000 U/ml、IL-4 500 U/ml的培养液。隔天半量换液。第5天加TNF-α1 000U/ml促进DC成熟。48h后收集细胞进行流式鉴定。
1.2.3 DCex的制备按Théry等〔7〕方法,DC经LPS(10ng/ml)刺激24h后收集培养上清,3 500r/min离心10min去除细胞大碎片,继续过0.22μm滤膜以去除更小碎片,将上清液加入超离管中,在4℃、绝对平衡的条件下超速离心(100 000r/min,1h)后倒掉上清液,PBS重悬后再次超速离心,收集DCex。将DCex分装后-80℃保存待用。
1.2.4 DCex电镜观察及表面分子检测吸取15μl上述步骤中提取的DCex悬液,滴于铜网上,静置2min后用滤纸慢慢吸干,加20μl磷钨酸于铜网上负染2min后滤纸吸干,PBS洗涤1次,白炽灯下烤20min后放于电镜下观察。应用乳胶珠子(Beads)结合法检测DCex携带抗原。将0.1μgBeads(105个左右)加入1.5 ml离心管中,MESbuffer离心洗涤2次,重悬于MES buffer中,加入5μg DCex,室温孵育1h,4℃条件下轻晃孵育过夜。加入甘氨酸封闭液30min后用3%FBS离心洗涤3次,加入单克隆抗体避光反应40min,3%FBS洗涤2次。应用细胞流式仪进行检测。
1.2.5 MTT法检测MSC增殖将MSC重悬于无血清α-MEM培养基中,按照5×104/ml细胞数接种于96孔板,每孔总体积为100μl,分别加入为不同浓度的DCex(0、1、2、5、10、15μg/ml),置于37℃、5%CO2孵箱分别培养24、48、72h后加入MTT 10μl,37℃孵育4h后弃去液体,加入二甲基亚砜100μl,在490nm波长下测定吸光度值,分析细胞增殖情况。用不同来源的MSC重复实验3次。
1.2.6 CFSE标记及流式细胞术验证MSC增殖取第3代MSC,PBS离心洗涤2次,加入CFSE染料(1μl/ml),37℃、5%CO2孵箱中反应15min,间断摇晃混匀。
PBS离心洗涤2次后重悬于无血清的α-MEM培养基中,按照5×104/孔接种于6孔板中,不同浓度的DCex(0、5、10、15μg/ml),在37℃、5%CO2孵箱中分别培养72h后收集细胞进行流式荧光检测。利用ModFit软件分析数据,以获取各组增殖指数(PI)进行比较。用不同来源的MSC重复实验3次。
1.3 统计学处理
采用SPSS17.0软件进行分析。实验数据以珚x±s表示,组间比较采用one-way ANOVA和t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 DC的形态及表型特征倒置显微镜下观察培养第4天可见聚集成团的细胞,边缘呈毛刺状(图1a),培养第7天可见细胞散在贴壁生长,胞体较大,可见明显树突状突起,具有DC的特殊形态(图1b),流式检测部分DC表达CD86、CD83、CD80、HLA-DR(图2)。【图1-2.略】
2.2 DCex的形态及流式鉴定电子显微镜观察到本实验所收获DCex为圆形或椭圆形的囊性结构,直径为40~100nm,符合外排体形态特征(图3)。进一步表面抗原分析发现,与来源DC相似,DCex也表达HLA-DR、CD86和CD83,部分表达CD80(图4)。证明所获DCex来源于DC。【图3-4.略】
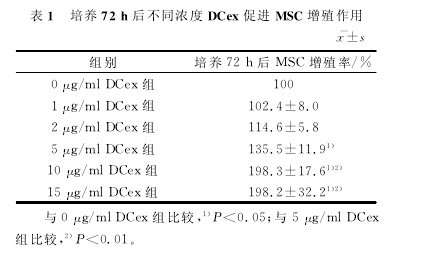
2.3 DCex促进MSC增殖MTT实验结果显示,培养72h后不同浓度DCex促 进MSC增 殖 作 用 见 表1。与0μg/mlDCex组比较,5、10、15μg/ml DCex组细胞均在48h出现促增殖作用(P<0.01)。CFSE标记及流式检测也证实DCex浓度为5、10、15μg/ml组与0μg/ml DCex组比较,PI逐渐增高,见图5。【图5.略.表1】
3 讨论
DC是功能最强大的特异性抗原递呈细胞,在诱导T细胞活化、抗肿瘤及免疫耐受中起重要作用,成熟的DC特异性表达MHC-Ⅰ、MHC-Ⅱ类分子、CD80、CD83、CD86等共刺激分子是其免疫作用的 分 子 基 础 。
DCex是DC成 熟 过 程 中 分 泌 的 一种携带有MHCⅡ类分子、CD80、CD86等特异性抗原肽的脂质双层膜性囊泡,近年来越来越多的研究发现DCex具有抗肿瘤、诱导免疫耐受的作用,同时,由于其非细胞性、稳定性高、储藏时间长等优点而引起极大关注。
MSC是一类广泛分布于各种不同的组织如骨髓、外周血、脐血、脂肪、胎盘、骨实质等中的具有多分化及自我更新能力的干细胞。
Li等〔8〕研究发现MSC能有力地促进DC增殖且明显地下调其表面MHC、CD80、CD86及CD40的表达,并且提出细胞与细胞间的直接接触是可能的机制之一。表明MSC能抑制DC抗原呈递能力,从而调节DC的分化、成熟。细胞间的作用是相互的,通过本实验发现,DCex可促进MSC的增殖,提示DCex可能是DC与MSC相互作用的一种新介质。
研究表明,DCex具有免疫抑制和免疫增强的双重作用〔9〕,不但可以诱导免疫耐受,也可刺激特异性细胞毒T淋巴反应。因此,研究者推测DCex可能作为肿瘤免疫和自身免疫性疾病治疗的新工具〔10-11〕。MSC具有很强的免疫调节作用。本实验证实DCex可促进MSC增殖,提示在MSC存在的条件下,DC可通过释放DCex,间接增强MSC的免疫调节功能。利用DCex治疗类风湿性关节炎等疾病时,可能促进骨组织中富含的MSC的增殖〔12-13〕,从而加速骨损伤修复,并可能增强DCex的疗效。这种推测值得进一步研究探索。
DCex含有与其功能关系密切的特殊蛋白质,包括CD55、CD59(避免DCex受到补体系统的攻击);MFG-E8、Mac-1α/β(细胞靶向作用);hsc73和hsp84(抗原肽结合作用);annexins(Ⅰ、Ⅱ、Ⅳ、Ⅴ、Ⅶ)、rabGD1、rap1B和rab7(膜融合作用);ICAM-1/CD54、CD11b、CD11c和CD58(粘 附 作 用 );Alix、TPx、14-3-3和galectin-3(凋亡作用)〔14〕。在这些蛋白中,与靶向作用相关的蛋白如MFG-E8,与粘附作用相关的蛋白如ICAM-1,与膜融合作用相关的蛋白如annexins(Ⅰ、Ⅱ、Ⅳ、Ⅴ、Ⅶ),都被看作是DCex与细胞的相互作用是起作用的,因此DCex促进MSC增殖的机制是否与DCex的成分相关,需进一步验证。
DCex作为一种新型疫苗在抗肿瘤免疫和诱导移植耐受中显示出了巨大的应用前景,同时MSC的造血支持与免疫抑制作用被临床应用于治疗自身免疫性疾病及血液系统疾病,然而MSC植入体内的效率及安全性也给人类带来了挑战。人体的免疫系统是一个整体,各种免疫细胞是相互联系、相互作用的,在细胞及免疫治疗的过程中,二者在复杂的体内环境中产生哪些变化,是如何相互作用和相互调节的,值得进一步探讨。





