
一、问题的提出
物理化学是许多化工类专业的基础课,它后继于无机化学、分析化学、有机化学课程,与这些课程形成整体化学知识结构,并成为其核心。由于物理化学在本科高校化学化工专业所处的地位,物理化学除了要使学生牢固掌握物理化学理论和规律,打下坚实的物理化学理论基础外,还应与先学的化学理论紧密地对接,这样才能有利于学生通过本科学习形成坚实的化学基础。欲较理想地实现这一教学目的,物理化学在教学中,不仅要注重内部知识结构的先进、完整和通透性,还应注重与其他已学化学知识的关联性。从这一角度出发,本文仅就我们在物理化学教学中关于气液平衡这一知识模块与有机化学中蒸馏知识模块的衔接问 题,谈 谈 我 们 的 认 识,期 望 与 同 行 进 行交流。
二、分析和讨论
(一)测定液体的沸点时温度计水银球应处的位置
相平衡是本科生在物理化学学习中的重要内容之一。教学要求学生掌握用简单的实验方法绘制常压下的气液二组分相图。图1a即相应实验装置。进行该实验时,温度计水银球部分的位置应处于液面以下。[1]无机化学、有机化学的教学中,进行简单蒸馏时,都是要求把温度计水银球的上缘与蒸馏烧瓶的下缘平齐,[1]如图1b所示。都是要测沸点,为什么温度计的水银球应处的位置如此不同?这两处的温度一致吗?这是多数学生常常疑惑的问题,它必须在物理化学教学中得到解决。
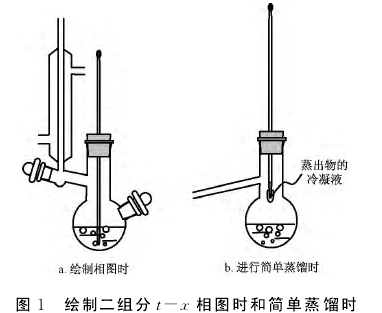
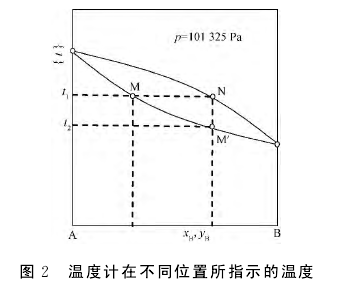
该问题通常出现于学生学习了液态完全混溶二组分的气液两相平衡,进行了相应的相图绘制实验以后。如该问题没有被学生提出,我们就在物理化学课后由老师提出,并组织学生小组进行讨论,得到下述结论。如图2所示,当温度计插入液面以下时,所测温度(t1)是液相组成用M代表的混合液体的沸点。如果把温度计改插在水银球位于支管处,所测温度则是气相(组成以N代表)在水银球上冷凝液(组成以M'代表)的沸点。这是因为,此时气相馏出混合物在温度计的水银球上形成液滴,该液滴中的液体与液体旁流过的气相处于气液平衡,且组成相同。因此,此时位于支管处的水银球指示的温度不是烧瓶内混合液体(M)的沸点,而是气相组成N对应液体M'的沸点。正因为如此,在进行简单蒸馏时,将温度计的水银球上缘与蒸馏烧瓶的下缘平齐,以随时监控气相馏出混合物(冷凝液)的沸点。但是,在绘制二组分气液相图时,要准确测定的是组成为M的混合液的沸点,因此必须将温度计水银球插至烧瓶中液体的液面以下。
以上讨论不仅贯通了物理化学知识与学生已有的化学知识,还大大加深了学生对相应物理化学知识的理解,有效地激发了学生学习物理化学课程的热情。
(二)常压气液平衡相图,是否可用于指导相应简单蒸馏
这也是进行气液相图教学时,应该使学生准确认识的一个问题。对于该问题,我们已尝试在多届学生的物理化学教学中组织学生小组课后讨论,收到了较好的教学效果。不同讨论小组,所得结果通常表现为以下两个典型相反的答案。
答案A:气液相图描述的是在封闭系统内的气液两相平衡问题。常压简单蒸馏实际上是一个敞开系统,即馏出物不断地从系统转移出去。因此,气液相图不适用于简单蒸馏。即在相同压力下,确定沸点的气相馏出物组成和液相组成都会偏离相图给出的数据。
答案B:通过实验绘制气液相图时,要多次改变加入瓶(图1a)内的液体。即该实验使用了多个不同的系统配比。而且,绘制气液相图并不需要严格控制液体总量。这就是说,要绘制定压下确定的气液相图,只需要一系列的液体沸点对应的液相组成和气相组成,而与系统的物量(是否改变)无关。因此,只要气液相图对应的压力和组分与简单蒸馏的相应条件一致,它就适用于指导相应简单蒸馏。
显然,答案A只是从气液平衡理论出发给出的思考结果,而B只是从相图绘制实验出发给出的思考结果。应该说,答案A是错误的,而答案B是片面的或不准确的。如果仅着眼于由确定液相组成在相图上读出液相的起始沸点(必须由插在蒸馏瓶的液面下的温度计测得)及起始馏出物组成(即第一个气泡的组成),或是要由液相沸点在相图上读出相应液相组成及对应的馏出物组成,则答案B就是正确的。这是因为,二组分气液平衡相图就是由这样的数据绘制的。虽然简单蒸馏是在敞开系统进行的过程,馏出物以气相不断地从系统转移出去,但系统的瞬时液相组成、瞬时气相组成(确定沸点的馏出物成分),以及液体的沸点温度三者间的关系仍可以由对应相图准确读出。但是,如果着眼于累积气相馏出物的组成(或物量),与液相组成或液相沸点对应,则答案B就是错误的。这是因为,在简单蒸馏过程中气相不断地从系统转移出去,使得过程中并不存在累积气相馏出物与液相之间的平衡。因此,简单蒸馏过程中累积气相馏出物无论在组成上还是在物量上与液相的瞬时组成、液相的沸点间的关系均严重脱离相图。简言之,对于简单蒸馏过程而言,其气相瞬时组成符合相图,而累积气相馏出物组成及其物量均与相图不符。
(三)对精馏、减压蒸馏、水蒸气蒸馏认识的深化
在本科生的基本实验技术模块中,已对精馏、水蒸气蒸馏和减压蒸馏各自的应用条件有较好总结。[1]例如,精馏适用于分离沸点较接近的物质;水蒸气蒸馏适用于蒸出不溶于水、又不和水反应的高沸点物质;减压蒸馏适用于蒸出在常压沸点下易分解的物质。事实上,这些分离方法的得出,无一不是基于物理化学原理。换句话说,这些分离技术本身,就是将物理化学基本原理创新性应用的实例。我们认为,在物理化学的教学中,通过让学生深入理解这些分离技术形成的创新思维,以培养学生的创新意识,比单纯向学生传授物理化学知识重要得多。
液体总是在其蒸气总压达到作用于其液面的外界压力时沸腾。[2-5]要使沸腾在低于正常沸点的温度下实现,显然有两种思维。一是人为降低作用于液面的外界压力,另一个就是想方设法增大定温下的液体的蒸气总压。前一思维导出了减压蒸馏技术;后一思维,则创新了水蒸气蒸馏技术。
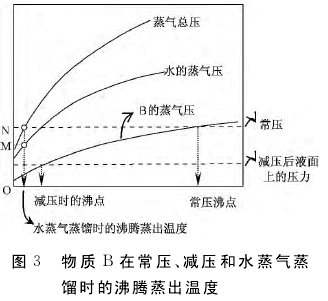
对于前者,学生极易理解,而对于后者,则必须明确下述物理化学原理:对于系统中存在的两个完全不互溶的液体而言,其各自的饱和蒸气压均不因另一液体的存在而受到影响。这样,如图3所示,由于水蒸气分压(pH2O)等量地增加了系统的蒸气总压(p总 =pH2O+ pB),系统在常压下沸腾同时蒸出H2O和物质B的温度便远低于常压简单蒸馏纯物质B的沸腾温度。
这样,与学生已有的化学知识关联进行物理化学教学,不仅可显着提高学生学习物理化学的兴趣,还强化了物理化学理论与前期化学知识的有机融合。在此基础上,进而引导学生在以下几方面进一步讨论,会使学生对相图有更深化的认知:
1.常压下水蒸气蒸馏的温度一定低于100℃。这是因为,蒸气总压p总 =pH2O+ pB一定大于pH2O本身,后者在100℃就达到了常压。
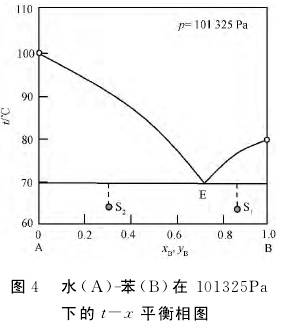
2.只要常压下水蒸气蒸馏的速度足够慢,对于确定的物质B,不管系统中液态物质B和液态水加入量的多少,水蒸气蒸馏的馏出物中都应含有确定比例(图3中的MN/ON)的物质B,即馏出物中物质B的比例取决于对应沸腾温度下物质B的平衡蒸气分压和蒸气总压,而与系统中液态水及液态物质B的量无关。实际上,这由图4给出的相图解释会更清晰:无论系统点为S1还是S2,水蒸气蒸馏的馏出物具有相同的组成(E)。当然,在实际的水蒸气蒸馏过程后期,馏出物的组成偏离该比例的现象,则是由于蒸馏过程由热力学控制变为了动力学控制所致。
3.只要常压下水蒸气蒸馏的速度足够慢,对于确定的物质B,其水蒸气蒸馏的沸腾温度就不会受系统中液态物质B和液态水相对多寡的影响。这由图4可得到很好的解释:无论系统的组成在S1还是S2,系统的沸腾温度均为三相线所在温度。
(四)爆沸现象及防止爆沸的方法
液体沸腾,指的是液体在其液面和其内部同时气化的现象。[2-5]液体在其内部的气化必须由液体内部小气泡的体积增大而实现。但是,因小气泡越小,其附加压力越大。这样,要由液体的自身蒸气形成小气泡时,只有当液体被加热到其饱和蒸气压可达到大气压与小气泡附加压力总和的对应温度时,小气泡才能产生。此时的液体温度早已超过正常沸点,液体成为了过热液体。因小气泡的附加压力与小气泡的半径成反比,这决定了该过热液体中只要能产生蒸气泡,必有蒸气泡的半径越大液体在气泡的气液界面处气化就越剧烈的现象。这就是说,在过热液体中,一旦有蒸气泡出现,必然急剧增大而导致爆沸。
加热水时之所以观察不到爆沸现象,是由于水中溶有的空气受热时由液相溢出,成为小气泡源以避免液体水过热。通常的有机液体不溶解空气,因此蒸馏有机液体时,如不采取措施就会出现爆沸现象。
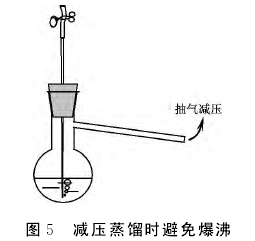
要防止有机液体爆沸,加热时有机液体内部必须有小气泡源以提供初始的小气泡。沸石是一种微孔材料,其孔内的空气受热后溢出即成小气泡源。因此,加热有机液体前先加入少量沸石,可避免有机液体过热而导致爆沸。对于减压蒸馏,只要将用于调节系统压力的毛细管插入液面以下,进入的空气即可为蒸馏液体不断提供小气泡(见图5),从而有效地避免液体爆沸。
三、结论
在物理化学教学中,不仅要注重物理化学内部知识结构的先进、完整和通透性,还要注重与其他已学化学知识的关联性,这样更有利于学生形成坚实的化学知识基础,激发学生的创新思维意识,培养学生的创新能力。
参考文献:
[1]辛剑,孟长功.基础化学实验 [M].第一版.北京:高等教育出版社,2004.
[2]傅献彩,沈文霞,姚天扬等.物理化学[M].第五版.北京:高等教育出版社,2008.
[3]刘俊吉,周亚平,李松林.物理化学[M].第五版.北京:高等教育出版社,2009.
[4]韩德刚,高执棣,高盘良.物理化学[M].北京:高等教育出版社,2001.
[5]胡英,吕瑞东,刘国杰等.物理化学[M].第五版.北京:高等教育出版社,2007.





