摘 要: 目的 比较3种不同密度梯度离心方法对脊髓灰质炎病毒空心颗粒、实心颗粒的分离效果。方法 选择蔗糖密度梯度离心、氯化铯密度梯度离心、Optiprep(碘克沙醇溶液)密度梯度离心方法,对脊髓灰质炎病毒进行纯化,抽取离心之后的蛋白条带,通过计算蛋白回收率、SDS-PAGE分析、病毒颗粒透射电镜观察,评价其对病毒空心颗粒、实心颗粒的分离效果。结果 病毒液经蔗糖、氯化铯和Optiprep 3种介质超速离心,均能分离空心颗粒和实心颗粒。氯化铯密度梯度离心法蛋白回收率优于Optiprep及蔗糖密度梯度离心法;Optiprep密度梯度离心法蛋白纯度优于氯化铯及蔗糖密度梯度离心法。结论 通过蛋白回收率、SDS-PAGE分析、病毒颗粒透射电镜观察初步评价了3种方法对脊髓灰质炎病毒空心颗粒和实心颗粒的分离效果,为脊髓灰质炎病毒分离纯化提供了参考。
关键词: 氯化铯; 蔗糖; 碘克沙醇; 密度梯度离心; 空心颗粒; 实心颗粒; 纯化;
Abstract: Objective To compare the separation effects of empty and solid viral particles of poliovirus by sucrose density gradient centrifugation,cesium chloride density gradient centrifugation and Optiprep density gradient centrifugation.Methods Poliovirus was purified by three kinds of density gradient centrifugation methods respectively,and the protein bands were extracted. The separation effects of empty and solid viral particles were evaluated by protein recovery rate,SDS-PAGE and transmission electron microscopy. Results Both empty and solid viral particles were separated by ultracentrifugation in three media. The protein recovery rate of cesium chloride centrifugation was higher than those of Optiprep and sucrose density gradient centrifugation. However,the purity of protein purified by Optiprep centrifugation was higher than those by cesium chloride and sucrose density gradient centrifugations. Conclusion The separation effects of empty and solid viral particles by three density gradient centrifugations were preliminarily evaluated,which provided a reference for the separation and purification of poliovirus.
Keyword: Cesium chloride; Sucrose; Optipprep; Density gradient centrifugation; Empty particles; Solid particles; Purification;
在病毒研究过程中,病毒纯化方法一直是研究过程的难点,最常用的方法一般为密度梯度离心法[1,2]。区带离心又分为差速区带离心和平衡区带离心。两种区带离心法均需先在离心管中用某种低分子溶质(如蔗糖溶液)调配好密度梯度,在密度梯度之上加入待处理的料液后进行离心操作。区带离心是将样品加在惰性梯度介质中进行离心沉降或沉降平衡,在一定的离心力下将颗粒分配至梯度中某些特定位置上,形成不同区带的分离方法。该方法优点为:(1)分离效果好,可一次获得较纯颗粒;(2)适应范围广,可同差速离心法一样分离沉降系数差的颗粒,又可分离具有一定浮力密度差的颗粒;(3)颗粒不会挤压变形,能保持颗粒活性,并防止已形成的区带由于对流而引起混合。其最常用的介质为氯化铯、蔗糖和多聚糖,在流感病毒、狂犬病病毒、脊髓灰质炎(简称脊灰)病毒以及EV71等肠道病毒的分离中应用比较广泛[3,4,5,6,7,8]。但也有文献报道,使用Optiprep(碘克沙醇溶液)分离效果好[9]。
脊灰病毒属于小核糖核酸病毒科肠道病毒属[10]。病毒颗粒核衣壳为立体对称的二十面体,无包膜,有60个壳微粒,病毒中心由单股RNA组成,外围由60个壳粒拷贝组成,壳粒中含4种结构蛋白,分别为VP1、VP3和由VP0分裂而成的VP2和VP4。VP1为主要的外露蛋白,至少含2个表位,可诱导中和抗体产生[11]。因此,蛋白进行电泳时,实心颗粒会出现VP1、VP2、VP3、VP4这4种结构蛋白,但VP4一般含量较少,不易出现。而空心颗粒会出现VP0、VP1、VP3这3种结构蛋白[12]。
因此,脊灰疫苗在生产过程中进行质量控制的关键是进行D抗原(实心颗粒)含量的检测[13]。目前国内外绝大部分生产商采用ELISA法检测脊灰D抗原[14]。一般是基于单抗、多抗的单用或两者的联用。理想的检测抗体应该是能够特异性识别脊灰D抗原而不识别C抗原(空心颗粒)的抗体。因此,在筛选过程中必须使用尽可能纯化的D抗原及C抗原。
基于此,本研究初步比较了蔗糖密度梯度离心、氯化铯密度梯度离心、Optiprep密度梯度离心3种方法对脊灰病毒空心颗粒、实心颗粒的分离效果。
1 、材料与方法
1.1、 病毒
脊灰Sabin株Ⅰ型病毒原液(蛋白含量为4.52 mg/mL)由武汉生物制品研究所有限责任公司肠道疫苗室提供。
1.2 、主要试剂及仪器
Optiprep(60%)购自美国Sigma公司;蔗糖购自国药集团化学试剂有限公司;氯化铯购自生工生物工程(上海)股份有限公司;Pierce BCA定量分析试剂盒、蛋白质marker购自美国Thermo Fisher公司;蛋白电泳仪购自美国BioRad公司;超离管购自美国Beckman公司;超滤离心管购自美国Millipore公司。
1.3、 氯化铯密度梯度离心
配制密度为1.34 g/cm3的氯化铯溶液,将其中1份用PBS定容至13.5 mL,另外1份加入已超滤浓缩的病毒液3.5 mL(总蛋白含量为15.82 mg),PBS定容至13.5 mL,加至超离管中,热封,4℃,680 000×g离心18 h;暗室抽取蛋白条带,加至超滤离心管中,加入PBS至超滤管管口处,4℃,3 000×g离心10 min;待超滤管中液体减少至1.5 mL后,重复该过程5次,最后1次离心结束后,收集超滤离心管中的溶液。
1.4 、蔗糖密度梯度离心
配制成梯度为15%、25%、35%、45%、55%的蔗糖溶液,依次从低浓度到高浓度铺蔗糖密度梯度。在顶端液面上加入3.5 mL浓缩病毒液(总蛋白含量为15.82 mg),480 000×g离心3.5 h;暗室抽取蛋白条带,加至超滤离心管中,PBS稀释,4℃,3 000×g离心10 min;重复该过程5次,最后1次离心结束后,收集超滤离心管中的溶液。
1.5 、Optiprep密度梯度离心
从低到高配制成梯度为15%、25%、35%、45%、55%的Optiprep溶液。在顶端液面上加入3.5 mL浓缩病毒液(总蛋白含量为15.82 mg),4℃,480 000×g离心3.5 h;暗室抽取蛋白条带,加至超滤离心管中,PBS稀释,4℃,3 000×g离心10 min;重复该过程5次,最后1次离心结束后,收集超滤离心管中的溶液。
1.6 、蛋白含量检测
采用BCA法。标准品蛋白浓度设为1、2.5、5、10、20、40、200μg/mL,绘制标准曲线。具体操作按Pierce BCA定量分析试剂盒说明书进行。
1.7、 纯度分析
采用12%SDS-PAGE分析。加入4×SDS还原型上样缓冲液,混匀,100℃煮10 min;上样,非预染蛋白质marker 10μL/孔,样品20μL/孔,120 V恒压电泳;恒温染色3 h;脱色至背景干净。利用Quantity One软件分析结果。
1.8、 病毒颗粒的透射电镜观察
将样品稀释至10~20μg/mL,取1滴于薄膜手套上,将铜网正面置于其中5 min;取出铜网,待自然干燥后,将铜网正面置于磷钼酸液滴中5 min;取出铜网,自然晾干,送中国科学院武汉病毒研究所进行透射电镜分析。
2 、结果
2.1 、超速离心分离条带的观察
结果显示,病毒液经3种介质超速离心分离条带后,离心管里均可见3条条带,其中氯化铯和Optiprep的条带较浓,蔗糖的条带稍微弥散,见图1。
2.2 、3种方法纯化后的蛋白回收率
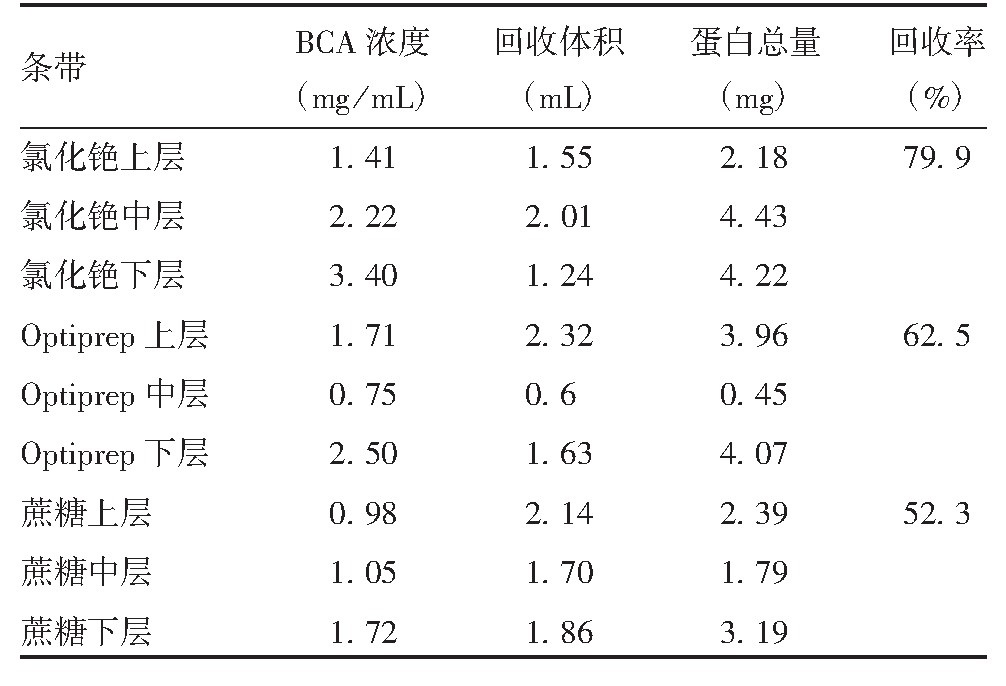
获得的标准曲线方程为y=0.012 4 x-0.010 8,蛋白浓度与对应的A562具有良好的线性关系,R2=0.999 7,见图2。氯化铯、Optiprep及蔗糖密度梯度离心法蛋白回收率分别为79.9%、62.5%和52.3%,见表1。
2.3 、3种方法纯化后的蛋白纯度
12%SDS-PAGE分析显示,Optiprep、氯化铯及蔗糖密度梯度离心法纯化后的蛋白纯度分别为97.27%、95.75%和93.27%,见图3。
图1 病毒液经3种介质超速离心分离条带

Fig 1.Separation of poliovirus particles by ultracentrifu-gation in three media
A:蔗糖;B:氯化铯;C:Optiprep。
图2 BCA法检测蛋白含量标准曲线
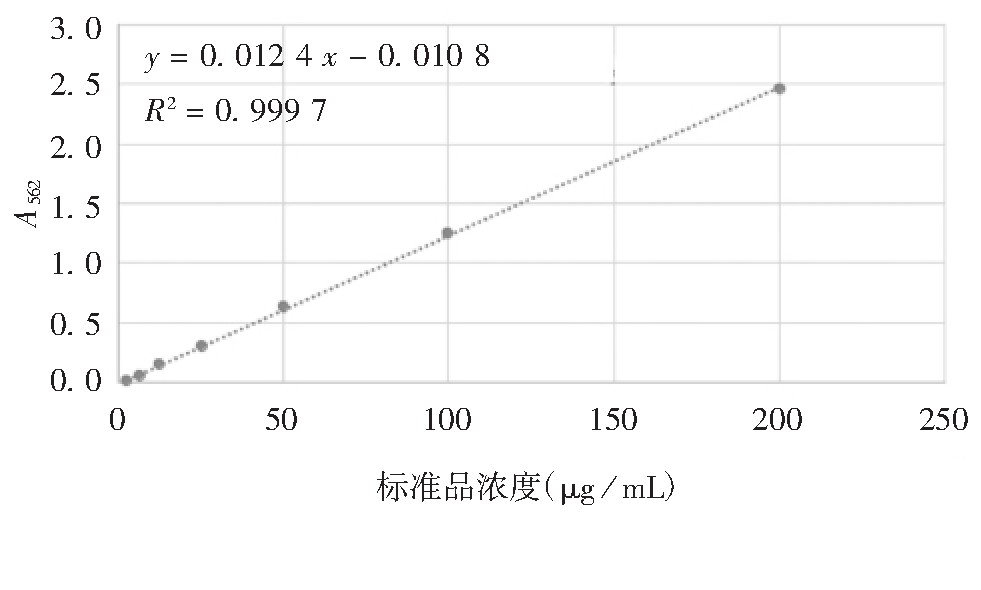
Fig 2.Standard curve for determination of protein content by BCA
表1 病毒液经3种方法纯化后蛋白含量及回收率的比较
2.4 、病毒液的透射电镜观察
选择Optiprep密度梯度离心法分离的上、中、下层病毒液进行透射电镜观察,结果显示,上层、中层为不完整的病毒颗粒,即空心颗粒,下层为完整的病毒颗粒,即实心颗粒,且病毒颗粒纯度较高,见图4。
图3 3种介质纯化后蛋白的SDS-PAGE分析
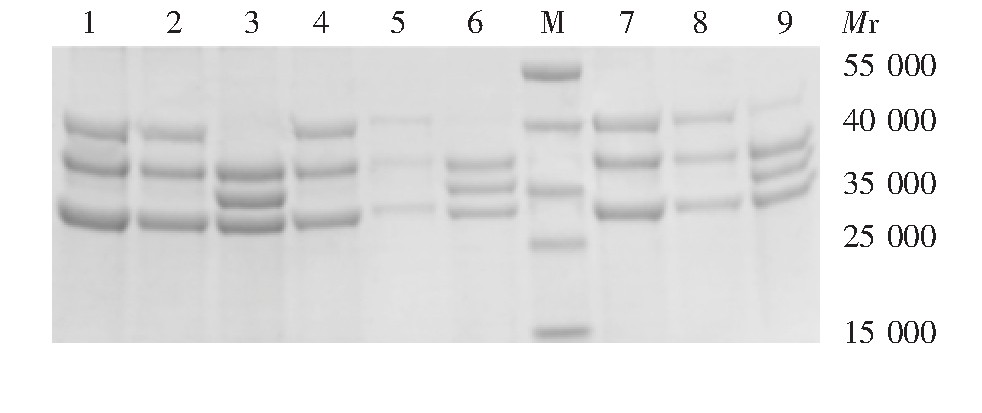
Fig 3.SDS-PAGE profile of protein purified by ultracentri-fugation in three media
M:预染低分子量蛋白质marker;1~3:依次为氯化铯分离后的上、中、下三层条带;4~6:依次为Optiprep分离后的上、中、下三层条带;7~9:依次为蔗糖分离后的上、中、下三层条带。
图4 Optipre分离后的空心颗粒(A)及实心颗粒(B)的透射电镜观察
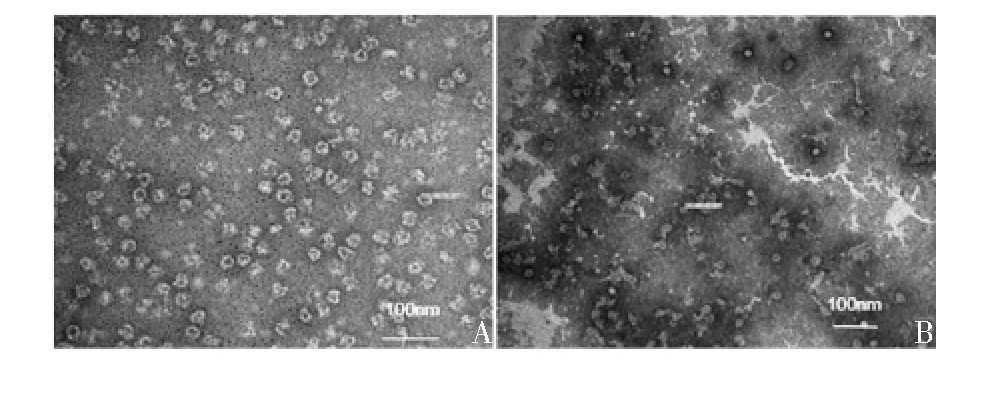
Fig 4.Electron microscopy of empty(A)and solid(B)viral particles after Optipre density gradient centrifugation
3、 讨论
本实验目的在于分离出纯度尽可能高的空心病毒颗粒,作为筛选抗脊灰I型病毒D抗原单克隆抗体中的实验材料。基于此,在动物免疫过程中需要大量的免疫原时,后续试验可选用氯化铯作为密度梯度离心的介质;而对于单克隆抗体筛选用的抗原时,则选用Optiprep作为密度梯度离心的介质。
密度梯度离心方法中,目前最常用的介质仍然是氯化铯、蔗糖等。这两种介质在病毒纯化过程中能满足绝大多数的需求。但根据纯化病毒的目的不同,应选择不同的介质。如果想获得大量的分离后的病毒颗粒时,最好选用氯化铯密度梯度离心法进行分离纯化,该方法能保证病毒蛋白的回收率;如果想尽可能分离出纯度更高的空心颗粒及实心颗粒时,最好选用Optiprep密度梯度离心法;如果对这两点要求均不高,则可以选择蔗糖密度梯度离心法,因蔗糖成本低,易获取。总之,这3种方法各有各的优点,可以根据目的不同选择不同的介质。
参考文献
[1]LEE K C,LIM D,WONG S M,et al.Purification,crystallization and X-ray analysis of hibiscus chlorotic ringspot virus[J].Acta Crystallogr D Biol Crystallogr,2003,59(8):1481-1483.
[2]PYKE A T,PHILLIPS D A,CHUAN T F,et al.Sucrose density gradient centrifugation and cross-flow filtration methods for the production of arbovirus antigens inactivated by binary ethylenimine[J].BMC Microbiol,2004,144(1):3.
[3]GU J Y,LIU X G,GUO Z L.Optimization of purification of influenza virus by sucrose density gradient centrifugation[J].Chin J Biologicals,2015,28(8):848-851.(in Chinese)顾建阳,刘旭光,郭占龙.蔗糖密度梯度离心法纯化流感病毒工艺的优化[J].中国生物制品学杂志,2015,28(8):848-851.
[4]ZHAO H,WEN Y,PENG S D.Expression and identification of poliovirus type 2 virus-like particles in Pichia pastoris[J].Prog Microbiol Immunol,2018,46(4):9.(in Chinese)赵辉,温晔,彭少丹.脊髓灰质炎2型病毒样颗粒在毕赤酵母内的表达与鉴定[J].微生物学免疫学进展,2018,46(4):9.
[5]LU H,DOU Z Y.Purification of hamster kidney cell rabies vaccine by density gradient centrifugation[J].Chin J Prevent Med,2000,34(2):1.(in Chinese)鲁宏,窦志勇.密度梯度离心纯化地鼠肾细胞狂犬病疫苗[J].中华预防医学杂志,2000,34(2):1.
[6]DONG L J,LI H,JIANG R J.Comparative study on different purification methods of human respiratory syncytial virus[J].JMed Res,2011,40(4):74-75.(in Chinese)董莉娟,李华,蒋蕊鞠.人呼吸道合胞病毒不同纯化方法的比较研究[J].医学研究杂志,2011,40(4):74-75.
[7]SUI Y J,YANG Q W.Comparison of three commonly used density gradient centrifugation methods for enrichment of nucleated red blood cells[J].Chin J Stereo Logy Image Analysis,2018,23(3):248-249.(in Chinese)随玉杰,杨麒巍.三种常用的密度梯度离心方法富集有核红细胞的比较[J].中国体现学与图像分析,2018,23(3):248-249.
[8]GAO S P,WU G H,YAN X M,et al.Purification of goat pox virus by sucrose density gradient centrifugation[J].Heilongjiang Animal Husbandry Veter,2018,253(11):52-54.(in Chinese)高顺平,吴国华,颜新敏,等.蔗糖密度梯度离心技术纯化山羊痘病毒的研究[J].黑龙江畜牧兽医,2018,253(11):52-54.
[9]ZHANG H,BI Y W,LI Z H,et al.Establishment of Optiprep continuous density gradient centrifugation method[J].Biotechnol Bull,2016,27(6):834-835.(in Chinese)张辉,毕研伟,李智华,等.Optiprep连续密度梯度离心方法的建立[J].生物技术通讯,2016,27(6):834-835.
[10]EHRENFELD E,DOMINGO E,ROOS R.The Picornaviruses[N].Washington,DC:ASM Press,2010.
[11]HOGLE J M,CHOW M,FILMAN D J.Three-dimensional structure of poliovirus at 2.9 A resolution[J].Science,229:1358-1365,1985.
[12]Center for Disease Control and Prevention(CDC).Progress toward global eradication of poliomyelitis,2002[J].Expert Rev Vaccine,2003,52(16):366-369.
[13]BOMPART F.Vacciation strategies for the last stages of Global Polio Eradication[J].India Pedialr,2005,42(2):163-169.
[14]REZAPKIN G,DRAGUNSKY E,CHUMAKOV K.Improved ELISA test for determination of potency of inactivated poliovirus vaccine(IPV)[J].Biologicals,2005,33:17-27.





