复合人工骨对兔骨缺损的修复作用(2)
时间:2016-01-22 来源:未知 作者:学术堂 本文字数:4999字2.2拉伸应力实验。
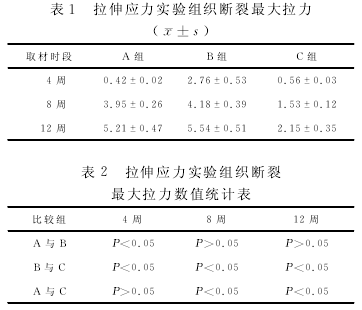
各组在10 mm/s的速度下,断裂时所承受的拉力值,见表1,用SPSS 14.0统计软件包处理数据,将同一时段各组平均分值分别进行配对t检验,见表2.
2.3光学显微镜。
观察实验A组:术后4周,骨膜下可见大量成骨细胞和软骨细胞,并可见少量成纤维细胞和新生毛细血管,植入的骨基质和原有骨组织之间有成骨细胞出现;术后8周,植入的骨基质周围出现原始骨痂,骨膜下可见新生骨小梁,骨小梁周围可见大量成骨细胞,骨膜下新生骨组织连成片状,在其表面可见栅栏状排列的成骨细胞;术后12周骨膜下新生骨组织连成片状,在其表面可见少量成骨细胞,骨折端和骨膜下成骨过程基本完成。试验B组:术后4周,骨折端的间充质细胞向成软骨细胞转化,并可见少量成纤维细胞和新生毛细血管,可见大量软骨细胞和成骨细胞;术后8周,骨膜下可见新生骨小梁,骨小梁周围可见大量成骨细胞;术后12周,骨折端和骨膜下成骨过程基本完成,成骨细胞逐渐减少。试验C组:术后4周,骨折端可见少量新生骨小梁,骨膜周围可见大量纤维结缔组织、炎性细胞、脂肪细胞和少量的软骨细胞、成骨细胞;术后8周,可见少量排列紊乱的骨小梁,周围分布大量纤维结缔组织、脂肪细胞、炎性细胞、少量的成骨细胞;术后12周,新生骨小梁完成,骨组织呈紊乱无序排列,骨小梁间间隙宽大数量多,未见成骨细胞。
2.4免疫组化。
观察实验A组:术后4周,BMP-2染色后骨折端可见胞浆棕黄色的阳性细胞出现。镜下见原始骨痂内大量阳性细胞,骨膜下有胞浆深棕色的成骨细胞;术后8周,BMP-2染色后镜下可见膜内成骨区骨小梁连接成片,可见骨膜下棕色的成骨细胞;术后12周,BMP-2染色后骨基质的成熟骨细胞中阳性的细胞减少且染色变浅。对照B组:术后4周,BMP-2染色后骨折端可见胞浆棕黄色的阳性细胞出现。镜下见原始骨痂内大量阳性细胞,骨膜下有胞浆深棕色的成骨细胞;术后8周,BMP-2染色后骨基质的成熟骨细胞中阳性的细胞减少且染色变浅,成熟骨细胞染色变浅呈浅棕色;术后12周,BMP-2染色后骨基质和骨膜下几乎看不到染色阳性的各种细胞。对照C组:术后4~12周,骨折端少量成骨细胞阳性表达,骨细胞染色浅。空白对照组:用PBS代替一抗,骨基质和细胞无阳性表达,表明BMP-2抗体特异性强。
2.5统计学分析。
应用FR-988生物显微图像分析系统将免疫组化染色切片经显微镜拍照后输入计算机。将胞浆内出现棕黄色颗粒者计为阳性表达细胞,系统软件自动对目标图像染色区灰度值进行分割、测量、计算和统计。对各取材时段实验侧和对照侧的免疫组化片所测得的平均灰度值以(x珚±s)表示;用SPSS14.0统计软件包处理数据,将同一时段各组平均灰度数值分别进行配对t检验。图像分析结果表明:术后4周:实验A组BMP-2平均灰度值与对照B组比较有统计学意义(P<0.05),与对照组C组比较有统计学意义(P<0.05),对照B组与对照C组比较有统计学意义(P<0.05)。术后8周:实验A组BMP-2平均灰度值与对照B组比较无统计学意义(P<0.05),与对照组C组比较有统计学意义(P<0.05),对照B组与对照C组比较有统计学 意义 (P<0.05)。术 后12周:实验A组BMP-2平均灰度值与对照B组比较无统计学意义(P<0.05),与对照组C组比较有统计学意义(P<0.05),对照B组与对照C组比较有统计学意义(P<0.05)。在实验A组和对照B组该值明显增高。
3讨论。
在中国,因各种原因造成骨缺损或功能障碍患者超过300万人[4].骨移植已成为仅次于输血的需求量最大的移植物[5].我们采用组织工程学方法,以脱细胞骨基质为细胞载体,以骨髓基质干细胞为种子细胞,制成细胞-载体复合物,用于修复兔桡骨骨缺损,观察修复效果[6].生物安全性、加工的可控性、生物相容性等性能是支架材料具备[7].组织工程支架材料用于基质干细胞来源的软骨细胞有:人工合成可降解高分子聚合物、胶原、藻酸钙水凝胶、透明质酸海绵等生物源性材料[8].有较好的生物相容性、来源丰富、能提供一定的初始强度、可降解为无毒的体内代谢产物排出体外和加工的可控性强是高分子可降解材料的特点,被广泛应用。可塑性强,但初始强度不够是凝胶类材料特点[9].多种材料的复合是目前研究的重点,可以弥补材料间的不足。
孔隙性支架材料PCL/PLA可以作为MSC诱导成软骨的载体[10,11].PCL和PLA按不同比例共孵育,可以加快PCL降解。Guo等用PLYS的聚PDLLA仿生基质材料,修复关节骨缺损[13],发现该材料具有更好的表面相容性和生物学活性,及具有良好的生物相容性和结构,解决了细胞-基质材料之间存在的界面不相容问题。但是这些移植材料都不同程度存在着以下问题:(1)高分子材料填充作用明显,但由于分子量较大不易降解吸收。(2)抗原性很强,组织排异性明显,植入后多数发生全身和局部的免疫排斥反应,严重影响愈合效果。本实验以脱细胞骨基质为细胞载体,以骨髓基质干细胞为种子细胞,制成细胞-载体复合物,很好的解决了以上问题。优点有:(1)脱细胞骨基质抗原性小,免疫排斥反应轻微;(2)骨基质脱细胞,同时将骨中的钙等无机物脱除,质地变软,分子量小,受移植体容易降解吸收[14].在本实验中通过免疫组织化学研究发现骨髓基质干细胞有和自体骨修复基本相同的修复效果[15].
考虑有以下原因:(1)骨髓基质干细胞具有多向分化能力,在骨折区域多种细胞因子的共同作用下,向成骨细胞转化,产生大量成骨细胞,同时这些成骨细胞又会产生多种促进骨折愈合的细胞因子如BMP-2,这两种因素相互影响促进,缩短了骨缺损愈合时间。(2)骨髓基质干细胞和脱细胞骨基质抗原性小,产生轻微免疫排斥反应,不会影响愈合进程。同时我们观察到自体骨移植较干细胞组愈合时间较短,考虑与下述机制相关:(1)同种异体BMSC抗原使其早期炎性排斥反应的出现,致使移植进去的工程骨及周围组织出现坏死现象,抑制了早期BMP-2等细胞因子的产生和成骨细胞的产生。(2)宿主炎性排斥反应消退后组织血管化反应的增强,移植物内开始有新生血管长入,材料中移植成骨细胞可分泌BMP-2等相关细胞因子,同时新骨形成与支架材料吸收较为旺盛。至术后12周时,新骨替代大部支架材料份,血管化现象较前有所减弱。所以骨髓基质干细胞移植后早期落后于自体骨移植,但在8周后已经基本没有差别,12周时骨缺损愈合情况完全相同。
综上所述,复合骨组织材料有利于兔成骨细胞的增殖、粘附和分化。复合骨组织材料能促进成骨细胞在体外成骨的能力。复合骨组织材料在体内可降解且具有较好的骨传导能力。本实验研究结果表明这一复合体生物活性行为较为显着。尤其是当其植入体内后能接受局部力学环境与各种细胞因子刺激并快捷地表现出成骨活力。这也说明骨髓基质干细胞具有活跃的成骨能力可以作为组织工程构建骨组织的种子细胞,通过模拟实验发现,通过结合MSC与脱细胞骨基质的组织工程技术获得的骨组织再生其生物学指标可以达到真正意义上的修复作用。
[参 考 文 献]
[1]Einhorn T A.Enhancement of fracture-healing[J].J BoneJoint Surg(Am),1995,77:940.
[2]Ballas CB,Zielske SP,Gerson SL.Adult bone marrowstemcells for cell and gene therapies:implications forgreater use[J].J Cell Biochem Suppl,2002,38:20-28.
[3]FriedensteinAJ,Chailakhyan RK,Gerasimov UV.Bonemarrowosteog enicstem cells:invitrocul tivation andtrans plantationindiff usionch ambers[J].Cell Tissue Kinet,1987,20:263-272.
[4]Kverborg M,Flyvbjerg A,Eriksn EF,et al.Transforming-growth factor-I and insulin-like growth factor binding pro-tein-3in human bone marrow strowal osteoblast progenitors[J].En-docrinology,2001,169(3):549-561.
- 相关内容推荐





