2 结果
2. 1 大鼠 NSCs 细胞的培养及鉴定 原代细胞接种于培养瓶后,光镜下呈单细胞悬浮状态,边界清楚。2 ~3 d 后,逐渐分裂成小细胞球,悬浮生长,随着时间增加,细胞球逐渐增大,大多成球状。培养至7 d 左右,部分细胞球中心出现颜色变暗,折光性差。遂进行传代培养,传代后细胞球形态与原代相似(图 1A)。将第 2 代培养 7 d 的细胞球后行免疫荧光染色,结果示贴壁细胞中大多表达 Nestin 阳性细胞(图 2A)。
2. 2 大鼠 NSCs 分化培养及分化后鉴定 第 2 代培养 7 d 的 NSCs 球接种于 0. 1% 多聚赖氨酸包被的载玻片后,细胞球逐渐贴壁,6 h 后即可见部分细胞球形态已发生改变,外周有细胞迁出现象(图1B) .迁出细胞很快发生分化,并随着培养时间延长,突触逐渐增多、增长,与周围细胞交织成网状。
分化至第 7 天,光镜下示细胞球向周边放射状生长,交织更紧密,间隙更窄(图 1C、D)。免疫荧光可见 GFAP 阳性的星形胶质细胞(图 2B)、MBP 阳性的少突胶质细胞(图 2C)及 MAP-2 阳性的神经元细胞(图 2D),该结果也进一步说明培养出了具有多向分化功能的干细胞。

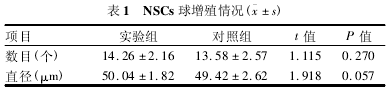
2. 3 大鼠 BMSCs 条件培养基在增殖情况下对大鼠 NSCs 增殖的影响 接种 NSCs 悬液于 96 孔板后,分别在培养 1、3、5 d 时,每次每组取 6 孔行MTT 检测,绘制细胞生长曲线。见图 3.大鼠 BM-SCs 条件培养基在增殖情况下对大鼠 NSCs 增殖无明显抑制作用,差异无统计学意义(实验组与对照组相比第 1 天: t = 0. 297,P = 0. 781;第 3 天:t =0. 561,P = 0. 605;第 5 天:t = 2. 283,P = 0. 085) .实验组细胞 24 h 后贴壁并逐渐有突起伸出,而对照组细胞一直呈悬浮状态生长。见图 4.另外,实验组与对照组培养 5 d 后行 NSCs 球数目及直径统计,利用 Image J 软件进行图像处理,结果显示镜下( ×100) 实验组细胞球数量及直径均略大于对照组,但两组间差异均无统计学意义,见表 1.
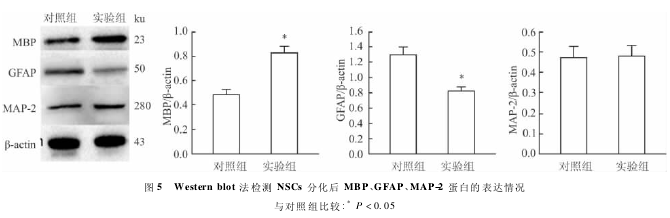
2. 4 大鼠 BMSCs 条件培养基在分化情况下对大鼠 NSCs 分化的影响 第 2 代培养 7 d 的 NSCs 球放入 6 孔板中分化 1 周后,提取蛋白行 Western blot法检测,结果提示实验组少突胶质细胞特异性蛋白MBP 表达量高于对照组( t = 7. 906,P < 0. 05),而星形胶质细胞特异性蛋白 GFAP 表达低于对照组(t =5. 652,P < 0. 05 ),两组神经元表面特异性蛋白MAP-2 的表达的差异无统计学意义( t = 1. 502,P =0. 272),见图 5.
3 讨论
该实验通过 MTT 法对细胞增殖及 Western blot法对特异性蛋白的检测及差异性分析,结果表明BMSCs 条件培养基对 NSCs 的增殖无明显抑制作用;但能够促进 NSCs 向少突胶质细胞分化,抑制其向星形胶质细胞分化,并对向神经元分化无明显影响。
MTT 法是经典的评估细胞增殖的方法,通过测定实验组与对照组分别在第 1、3、5 天的 OD 值,描绘出细胞增殖曲线并通过统计学分析得出实验组与对照组差异无统计学意义,从而说明 BMSCs 条件培养基对 NSCs 增殖无明显抑制作用。而通过形态学发现,24 h 后实验组开始贴壁并有突起伸出,但对照组仍呈悬浮状态,说明 BMSCs 条件培养基中可能含有某种成分能干预 NSCs 球的稳定,使干细胞能迁移出来[6].培养 5 d 后,测量两组细胞球数目及直径大小,分析得出二者差异仍无统计学意义,更进一步说明 BMSCs 条件培养基对 NSCs 的增殖无明显抑制作用。因此,可以推测 BMSCs 条件培养基与NSCs 共移植治疗脊髓损伤时,可能会促进 NSCs 球的解聚使干细胞迁移出来到达神经损伤处更好的发挥作用而不影响 NSCs 的增殖[6].
NSCs 移植治疗脊髓损伤时,NSCs 的分化方向也同样起到了重要作用,并参与决定了细胞移植治疗的效果[7].已有文献[1 -2]报道,NSCs 主要分化为神经元细胞、少突胶质细胞和星形胶质细胞,而其中对脊髓损伤治疗起主要作用的是神经元细胞和少突胶质细胞[7].神经元细胞能有效地修复损伤的脊髓组织,重新建立神经间的连接,而少突胶质细胞是中枢神经系统髓鞘形成细胞,在 NSCs 自然分化中所含比例最少[8],其主要作用是形成髓鞘包绕轴突促进电传导,对神经损伤的修复亦有重要作用[9].相反,星形胶质细胞虽然是中枢神经系统中含量最多的一种细胞,但由于其一方面抑制其他细胞分化,另一方面导致脊髓损伤处瘢痕组织的增生[10],从而使得其他细胞如少突胶质细胞不能充分发挥作用。
该实验通过对分化后蛋白行 Western blot 法检测,结果表明 BMSCs 条件培养基在分化条件下能够促进 NSCs 向少突胶质细胞分化,减少星形胶质细胞分化,而对神经元分化无明显作用,与 Li et al[11]研究结果较一致。
该实验收集的培养基中完全去除 BMSCs,排除了 BMSCs 本身的干扰,从而更加直接的研究 BMSCs条件培养基的对 NSCs 的影响,但作用机制仍不清楚。Rivera et al[12]指出 NSCs 可能先分化为神经元细胞和 A2B5 阳性祖细胞,A2B5 阳性祖细胞再分化为少突胶质细胞及星形胶质细胞,BMSCs 条件培养基中可能存在一种或多种细胞因子能够促进 A2B5阳性祖细胞内少突胶质细胞化生长基因 Olig 的表达而降低抑制其生长的 Id2 基因的表达[13],从而导致少突胶质前体细胞含量增加,这也可能是实验组与对照组神经元标志蛋白 MAP-2 表达量差异无统计学意义的原因。另外,研究[14]进一步表明 BMSCs条件培养基还能继续促进少突胶质前体细胞内少突胶质细胞成熟转录因子 GTX/Nkx6. 2 的表达而使得少突胶质细胞含量增加,且实验显示现睫状生长因子有类似作用,但具体机制仍不清楚。
综上所述,BMSCs 条件培养基为 NSCs 的增殖与分化提供了一个合适的微环境,而此种微环境不但能够促进 NSCs 向少突胶质细胞分化与成熟[15],而且能够促进 NSCs 球的解离迁移[6],这可能也是NSCs 和 BMSCs 条件培养基共培养体系治疗脊髓损伤的原因之一。本实验虽然证明了 BMSCs 条件培养基发挥上述作用,但具体何种因子及其发挥作用的机制仍不清楚,需后期实验进行研究。另外,本实验结果表明 BMSCs 条件培养基在体外对 NSCs 的增殖与分化产生了上述作用,但脊髓损伤后内环境错综复杂,共培养体系在体内能否产生上述积极作用,还需下一步动物实验证明。
参考文献
[1] Tarasenko Y I,Gao J,Nie L,et al. Human fetal neural stem cellsgrafted into contusion - injured rat spinal cords improve behavior[J]. J Neurosci Res,2007,85(1):47 -57.
[2] Dobkin B H. Recommendations for publishing case studies of celltransplantation for spinal cord injury[J]. Neurorehabil Neural Re-pair,2010,24(8):687 - 91.
[3]Neuhoff S,Moers J,Rieks M,et al. Proliferation,differentiation,and cytokine secretion of human umbilical cord blood-derived mono-nuclear cells in vitro[J]. Exp Hematol,2007,35(7):1119 - 31.
[4]Bai L,Caplan A,Lennon D,et al. Human mesenechymal stemcells signals regulate neural stem cell fate[J]. Neurochem Res,2007,32(2):353 - 62.
[5] 宋旆文,徐 鹏,申才良,等。 条件培养基培养神经干细胞的体外实验研究[J]. 安徽医科大学学报,2014,49(5):598 -602.
[6] 陈 玉,吴秦浩,李舍予,等。 人骨髓间充质干细胞对小鼠神经干细胞增殖与分化培养的影响[J]. 四川大学学报,2009,46(1):211 - 6.





