摘 要: 目的 综述聚多巴胺在肿瘤纳米药物递送中的应用现状与进展。方法 查阅近年来国内外关于聚多巴胺应用于肿瘤纳米药物递送的相关文献,并对其进行归纳、整理与总结。结果聚多巴胺有着一系列特有的性质,如强黏附性、良好的生物相容性、简单易行的功能化、优异的光热转换性和pH敏感性等,在用于肿瘤治疗的多功能纳米材料的制备中发挥了重要的作用,在肿瘤纳米药物递送中得到了广泛的应用。结论 聚多巴胺在肿瘤纳米药物递送中有着广阔的应用前景。
关键词: 药剂学; 多功能纳米材料; 综述; 聚多巴胺; 肿瘤治疗;
Abstract: Objective To review the application status and progress of polydopamine in tumor nano-drug delivery. Method The domestic and foreign literatures on the application of polydopamine for targeted nano-drug delivery in recent years were reviewed, sorted and summarized. Result Polydopamine has a series of unique properties, such as strong adhesion, good biocompatibility, simple and easy functionalization, excellent light-to-heat conversion and pH sensitivity. Polydopamine has played an important role in the preparation of multifunctional nanomaterials and has been widely used in tumor nano-drug delivery. Conclusion Polydopamine has broad application prospects in tumor-targeted nano-drug delivery.
Keyword: pharmaceutics; multifunctional nanomaterials; review; polydopamine; tumor treatment;
近年来,多功能纳米材料在合成上取得了巨大的进步,在肿瘤纳米药物递送上取得了优异的成绩。聚多巴胺(polydopamine,PDA)作为一种受贻贝启发的聚合物,在碱性条件下具有很高的自聚合能力和在各种材料上的沉积能力,引起了表面修饰的广泛关注。PDA具有一系列独特的理化性质,能赋予纳米材料特定的功能。因此,基于对PDA的最新研究成果,本文首先简要介绍了多巴胺的结构与聚合,再从PDA的性质出发,借助PDA应用于肿瘤治疗的多功能纳米材料时的不同应用方式(如功能化涂层、纳米粒、介孔纳米粒和纳米空心胶囊等),总结了近年来PDA在肿瘤纳米药物递送中的应用,旨在为研究人员提供通过各种基于PDA设计的平台获得有效抗肿瘤的方法。
1 、聚多巴胺
1.1 、多巴胺的结构与聚合
1.1.1、 多巴胺的结构
多巴胺(dopamine,DA)是一种儿茶酚胺类生物神经递质,对于治疗帕金森氏病及阿尔茨海默氏症有着很好的疗效,结构如图1所示。
图1 多巴胺的结构式
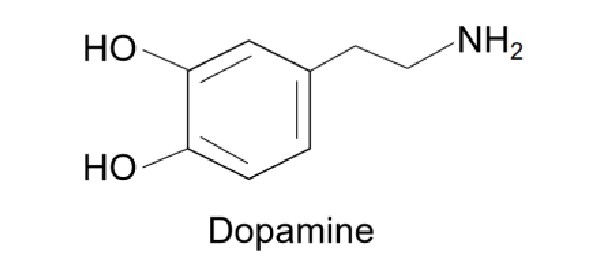
Fig.1 The structural of dopamine
1.1.2、 多巴胺的聚合
DA能在碱性条件下(p H=8.5)氧化自聚合形成聚多巴胺PDA。Lee等[1]将基材简单地浸入多巴胺的稀水溶液中,缓冲至典型海洋环境的p H值(将2 mg盐酸多巴胺溶解在10 m M Tris缓冲液中,p H 8.5),会自发沉积一层PDA薄膜。
1.2 、聚多巴胺的理化性质
1.2.1 、强黏附性
聚多巴胺具有很强的黏附性,几乎可以黏附在所有类型材料的表面上,如金属(Au、Ag、Pt、Pd、Cu、不锈钢和Ni Ti形状记忆合金)、金属氧化物(Ti O2、Si O2、Al2O3和Nb2O5)、半导体(Ga As和Si3N4)、玻璃、陶瓷、聚合物(PS、PE、PC、PET、PTFE、PDMS和PEEK)等[1,2,3]。
1.2.2、 良好的生物相容性
聚多巴胺具有良好的生物相容性。在聚多巴胺表面培养的哺乳动物细胞,例如成纤维细胞、成骨细胞、神经元和内皮细胞均显示出正常的增殖而没有细胞毒性[3]。聚多巴胺涂层起着生物相容性层的作用,能减轻由基材的内在特性引起的不良生物学反应,能减少接触组织或血液的生物材料的体内毒性[4]。
1.2.3、 简便易行的功能化
多巴胺是一种含有邻苯二酚和胺官能团的生物分子,在碱性p H下聚合形成薄的黏附性聚多巴胺薄膜,对胺和硫醇基团具有潜在的反应性,通过亲核试剂和聚多巴胺表面之间的反应将生物分子共价固定在表面上,可以实现材料表面的进一步功能化[5]。与其它表面改性方法相比,PDA功能化的过程简便易行且可控。
1.2.4、 优异的光热转换性
近红外(NIR)区域的吸光度和光热转换(PTC)效率是决定光热转换剂功效的两个关键参数。由于PDA具有很强的近红外吸收率和较高的PTC效率(40%),在NIR激光照射(808 nm)下,PDA可将能量转换为热量以增加肿瘤区域的温度并杀死癌细胞,因此PDA已被用作光热疗法研究中的有效PTC剂[6]。
1.2.5、 p H敏感性
由于酸性肿瘤微环境的存在,p H响应药物平台可以将化疗药物特异性地定位于肿瘤部位。PDA可以在酸性条件下缓慢溶解,使其成为p H值控制的药物递送平台的理想材料[7]。
2、 聚多巴胺在肿瘤纳米药物递送中的应用
2.1 、功能化涂层
功能化涂层是PDA应用于肿瘤治疗的多功能纳米材料的最常见方式,PDA涂层可以进行靶向修饰,也可以通过p H敏感性控制药物释放,还可以发挥优异的光热转换特性。毕冬冬等[8]制备了以阿伦磷酸钠(ALN)为靶头的聚多巴胺羟基喜树碱(10-HCPT)纳米晶。在碱性环境下使盐酸多巴胺氧化自聚合生成PDA包覆在10-HCPT纳米晶表面,在PDA涂层上通过迈克尔加成或席夫碱反应连接上ALN,制备得ALN-PDA-HCPT纳米晶,达到靶向修饰的目的。PDA在酸性环境下容易溶解,因此还赋予ALN-PDA-HCPT纳米晶以p H敏感性,当ALN-PDA-HCPT纳米晶通过胞吞作用进入肿瘤细胞后,在溶酶体酸性环境下药物可以大量释放。盛晓丹等[9]通过溶液吸附法和聚合法制备了聚多巴胺修饰的载榄香烯介孔二氧化硅纳米粒(D/MSN-ELE)。经PDA修饰后的纳米粒能有效封堵孔道,提高药物利用率,载药量较高;能响应肿瘤微环境p H,实现p H控制的药物靶向释放;还能掩蔽MSN带有的正电荷,有效减轻细胞毒性;此外,由于PDA的修饰,细胞对D/MSN-ELE的内吞作用加强,因此抗肿瘤作用增强。Wu等[10]报告了一种简便易行的方法来构建用于光动力和光热疗法的纳米治疗剂。这种纳米治疗剂(Zn O@Ce6-PDA)以Zn O纳米颗粒为核、光敏剂二氢卟酚e6(Ce6)为中间层以及聚多巴胺为外层。由于存在Ce6,Zn O@Ce6-PDA可以在660 nm激光照射下有效产生单线态氧(1O2)。此外,因为在780 nm激光照射下PDA涂层具有极高的光热转换效率,Zn O@Ce6-PDA可以用作光热剂。实验结果表明,纳米治疗剂在660 nm和780 nm的激光照射下具有优异的光毒性。由此也证明了Zn O@Ce6-PDA是一种有前途的光动力/光热双峰纳米治疗剂,可用于增强癌症治疗。
2.2、纳米粒
多巴胺小分子不仅可以在基材表面进行修饰形成黏附性的聚多巴胺层,也可以通过自聚合过程形成聚多巴胺粒子。
PDA纳米粒子作为具有高稳定性的载体,既能产生功能化修饰的作用,又能发挥光热转化特性以及p H敏感性。Yan等[11]合成了一种基于PDA的载体,该载体经过了叶酸(FA)的修饰,目的是靶向肿瘤表面上过度表达的叶酸受体。使用这种载体加载阳离子酞菁型光敏剂(Pc),并生成了PDA-FA-Pc纳米药物。PDA-FA-Pc纳米药物在正常生理条件下表现出高稳定性,但是可以在酸性条件下特异性释放光敏剂,例如癌细胞中的肿瘤微环境和溶酶体。另外,与健康细胞系相比,PDA-FA-Pc纳米药物在癌细胞系中表现出更高的细胞摄取和光毒性。此外,体内成像数据表明在人类癌症异种移植小鼠中PDA-FA-Pc纳米药物具有出色的肿瘤靶向特性。最后,作者发现PDA-FA-Pc纳米药物可在两种人类癌症异种移植小鼠模型中显着抑制肿瘤生长。该研究不仅证明了PDA-FA-Pc纳米药物是一种高效且特异性的抗癌药,还提出了解决临床光敏剂代谢和特异性问题的策略。Chen等[12]制备了一种新型的基于核-壳聚多巴胺(PDA)的治疗剂(PDA@TA-Fe)。在808 nm和1.064×103 nm激光分别照射下,该试剂分别显示出29%和41%的高光热转换效率。内吞进入肿瘤细胞后,PDA@TA-Fe的TA-Fe壳在弱酸性肿瘤微环境(TME)中逐渐崩解,并释放出TA为酸性活化剂,可将Fe3+还原为Fe2+。随后,产生的Fe2+通过Fenton反应与H2O2反应生成有毒的羟基自由基(OH),从而诱导肿瘤细胞凋亡并实现了化学动力学治疗(CDT)。光热疗法(PTT)产生的热量加速了OH的产生,从而实现了CDT/PTT的协同作用。
PDA纳米颗粒可直接作为光热转换剂,与抗肿瘤药物一同装入中空聚合物微球中,发挥光热疗法与化学疗法的协同作用。Ni等[13]开发了一个中空的可生物降解的聚合物微球,其中的中空空间中装有聚多巴胺纳米颗粒和盐酸阿霉素(DOX·HCl),外壳层是可生物降解的聚合物聚丙交酯-乙交酯(PLGA)。使用同轴电喷雾技术生产这些微球,用于增强局部化学-光热联合疗法。这些尺寸均匀的微球具有高的光热转化效率和高的光稳定性。当将这些微球体瘤内注射到荷瘤小鼠中后,立即在肿瘤部位使用近红外光照射,这些微球体中的PDA纳米颗粒立即产生局部热疗作用。同时,由于光热作用和扩散到细胞中,负载的DOX·HCl迅速释放。与静脉内注射的纳米药物相比,肿瘤中DOX·HCl的含量极高,在瘤内注射微球体后6 h达到约22%。因此,光热疗法与化学疗法之间的协同作用将加速肿瘤细胞凋亡,显着增强治疗功效并减少对正常组织的副作用。肿瘤内使用治疗剂比全身化疗具有更多优势。
2. 介孔纳米粒
介孔PDA纳米粒是通过常规PDA纳米粒改性得到的,除了具有与常规PDA纳米粒相同的一些性质外,还具有较高的药物负载量。Zhang等[14]通过乳液诱导的界面组装策略成功获得了具有介孔结构的PEG改性聚多巴胺纳米颗粒(MPDA-PEG)。随后,Zhang等通过溶液吸收法将溶解在丙酮中的紫杉醇(PTX)加载到MPDA-PEG纳米颗粒的中孔通道中。开发了用于光热疗法(PTT)和化学疗法相结合的MPDA-PEG-PTX纳米平台。合成的MPDA-PEG纳米粒子在NIR激光照射下具有很大的光热效应,并且随着粒径的增大而增强。同时,MPDA-PEG纳米颗粒还具有较高的PTX负载量,并且由于光热效应而升高温度可以大大促进PTX的释放。MPDA-PEG-PTX纳米平台可以在NIR照射下完全抑制肿瘤的生长,且副作用最小,并且比单一化疗和PTT具有更好的治疗效果。Wang等[15]提出了一种设计合理的纳米系统,以解决光热疗法和基因疗法相结合时,基因有效载荷、光热转化剂(PTCA)的简便整合和受控代码传递的问题。该系统是由杂化介孔聚多巴胺纳米粒子(MPDA)构成的,纳米粒子的尺寸小于100 nm,光热转换效率高达37%。通过PDA的迈克尔加成/席夫碱反应,用叔胺修饰了颗粒的表面,以实现高的si RNA负载能力(10 wt%)。此外,在阳离子纳米颗粒上成功构建了磷酸钙(Ca P)涂层,以阻止si RNA的过早释放。Ca P涂层在弱酸性亚细胞条件(溶酶体)中经历了生物降解。叔胺和邻苯二酚部分在随后暴露的表面上的协同整合被证明通过大大增强的界面黏附和相互作用,对模型细胞膜具有去稳定/破坏能力。因此,实现了溶酶体膜的足够的渗透性,进而实现了高的溶酶体逃逸效率,然后通过足够的胞质传递si RNA导致了高基因沉默效率。与单一疗法相比,当有效敲低(65%)生存素(一种凋亡蛋白抑制剂)与随后的光热消融相结合时,在体内和体外均观察到明显更高的治疗效率。该系统可能有助于为利用生物粘附表面来为光热和基因治疗相结合提供新的途径。
2.4 、纳米空心胶囊
多巴胺通过氧化聚合不仅可构建功能化纳米粒子,在一定条件下也可得到性能新颖的PDA纳米材料,如PDA纳米空心胶囊。Shang等[16]报告了由模板法制得的基于胶体聚多巴胺/金(PDA/Au)空心胶囊的新型治疗药物。胶体聚苯乙烯(PS)球用作依次具有PDA外壳和Au纳米颗粒涂层的模板,随后用三氯甲烷将其除去,从而形成PDA/Au胶体空心胶囊。胶体PDA/Au空心胶囊在超声成像中表现出出色的对比度增强效果,并且可以用作NIR光吸收剂,在体外用于对4个T1乳腺癌细胞进行有效的光热消融,而对活细胞的细胞毒性较小。Zhou等[17]开发了一种快速简便的方法,可使用聚多巴胺空心胶囊(PHC)作为药物纳米载体来增强奥利司他的治疗效果。由于聚多巴胺层对p H值极为敏感,因此其可以极好的控制奥利司他的释放。包装在PHC中的奥利司他可以被内吞到细胞中,与游离奥利司他相比在短时间内显着提高了对癌细胞的细胞毒性。研究结果表明负载奥利司他的PHC对于癌症治疗具有很好的应用前景。
3 、结语
基于PDA的平台具有多种优势,例如强黏附性、良好的生物相容性、简便易行的功能化、优异的光热转换性和p H敏感性等,这对于开发靶向药物递送系统具有巨大的潜力。
然而,值得注意的是,在对PDA的进一步研究或临床应用中仍然存在几点需要克服的挑战。首先,由于PDA形成过程过于复杂,PDA的聚合机理和中间体的确切比例尚无定论,这仍需要进一步的细胞研究来支持。其次,多巴胺作为一种神经递质,具有与神经药物相似的作用和抗癌作用,其生物降解性直接影响PDA的体内释放,从而影响细胞和生物体。因此,有必要进一步探索基于PDA系统的可生物降解和毒性机理[7]。而且,PDA作为中间层提高基底材料与功能分子之间结合力的应用中,需考虑PDA如何控制功能分子的释放。通过共价结合时,需考虑接枝后的功能分子是否仍具有其本身的功能化作用[18]。
参考文献
[1]Haeshin L,Shara M D,William M M,et al.Mussel-Inspired Surface Chemistry for Multifunctional Coatings[J].Science,2007,318:426-430.
[2]Sook H K,Chan B P.Human endothelial cell growth on mussel-inspired nanofiber scaffold for vascular tissue engineering[J].Biomaterials,2010,31:9431-9437.
[3]Sook H K,Jungki R,Seon K H,et al.General functionalization route for cell adhesion on non-wetting surfaces[J].Biomaterials,2010,31:2535-2541.
[4]Seonki H,Keum Y K,Hwang J W,et al.Attenuation of the in vivo toxicity of biomaterials by polydopamine surface modification[J].Nanomedicine,2011,6(5):793-801.
[5]Haeshin L,Junsung R,Phillip B.Facile Conjugation of Biomolecules onto Surfaces via Mussel Adhesive Protein Inspired Coatings[J].Advanced Materials,2009,21:431-434.
[6]LIU Y,AI K,LIU J,et al.Dopamine-Melanin Colloidal Nanospheres:an Efficient Near-Infrared Photothermal Therapeutic Agent for In Vivo Cancer Therapy[J].Adv.Mater,2013,25:1353-1359.
[7]XIAO Y,CHEN L,CHEN X L,et al.Current strategies to enhance the targeting of polydopamine-based platforms for cancer therapeutics[J].Journal of Drug Targeting,2020,28(2):142-153.
[8]毕冬冬,赵磊,齐晓宇.基于聚多巴胺的羟基喜树碱纳米晶的制备及其抗骨肿瘤作用[J].中国新药杂志,2018,27(13):1549-1554.
[9]盛晓丹,刘臻,罗砚曦.聚多巴胺修饰的载榄香烯介孔二氧化硅纳米粒的制备及其靶向抗肿瘤活性研究[J].中草药,2020,51(10):2745-2754.
[10]WU R,WANG H Z,HAI L,et al.A photosensitizer-loaded zinc oxide-polydopamine core-shell nanotherapeutic agent for photodynamic and photothermal synergistic therapy of cancer cells[J].Chin.Chem.Lett,2020,31(1):189-192.
[11]YAN S F,HUANG Q Q,CHEN J C,et al.Tumor-targeting photodynamic therapy based on folate-modified polydopamine nanoparticles[J].International Journal of Nanomedicine,2019,14:6799-6812.
[12]CHEN Q,SHAN X R,SHI S Q,et al.Tumor microenvironment-responsive polydopamine-based core/shell nanoplatform for synergetic theranostics[J].The Royal Society of Chemistry,2020:1211-1222.
[13]NIA G L,YANG G,HE Y,et al.Uniformly sized hollow microspheres loaded with polydopamine nanoparticles and doxorubicin for local chemo-photothermal combination therapy[J].Chemical Engineering Journal,2019,379:122317.
[14]ZHANG L R,YANG P,GUO R R,et al.Multifunctional Mesoporous Polydopamine With Hydrophobic Paclitaxel For Photoacoustic Imaging-Guided Chemo-Photothermal Synergistic Therapy[J].International Journal of Nanomedicine,2019,14:8647-8663.
[15]WANG Z Q,WANG L C,Neeraj P,et al.Ca P coated mesoporous polydopamine nanoparticles with responsive membrane permeation ability for combined photothermal and si RNA therapy[J].Acta Biomaterialia,2019,86:416-428.
[16]SHANG B,ZHANG X Z,JI R,et al.Preparation of colloidal polydopamine/Au hollow spheres for enhanced ultrasound contrast imaging and photothermal therapy[J].Materials Science&Engineering C,2020,106:110174.
[17]ZHOU X Q,CHANG T L,CHEN S,et al.Polydopamine-Decorated Orlistat-Loaded Hollow Capsules with an Enhanced Cytotoxicity against Cancer Cell Lines[J].Mol.Pharmaceutics,2019,16:2511-2521.
[18]刘宗光,屈树新,翁杰.聚多巴胺在生物材料表面改性中的应用[J].化学进展,2015,27(2/3):212-219.





