
肾上腺皮质细胞移植对治疗各种原因引起的肾上腺皮质功能不全具有广阔的应用前景,但研究中发现皮质细胞再生不完全,产生的皮质激素也不能完全满足生理需要。内皮素(ET)-1是最强的缩血管物质之一,具有促进多种组织细胞增殖与分泌的作用,在体内可增加大鼠肾上腺自体移植物的增殖和分泌。本文通过研究ET-1对体外培养的大鼠肾上腺皮质细胞增殖与分泌的影响,进一步探讨大鼠肾上腺细胞体外培养时的生长特性,以期优化肾上腺皮质细胞体外培养方案,为肾上腺细胞移植提供最适宜的条件。
1、材料与方法
1.1材料
2周龄SD大鼠(汕头大学医学院实验动物中心提供)30只,胶原酶I型(Sigma公司,美国),DNA酶I型(LABEST公司,北京),DMEM∕F-12培养基、胎牛血清,原代消化液(DMEMF-12培养基配制,内含1mg/mL胶原酶I型、5μg/mLDNA酶I型),培养瓶、培养皿、手术器械,ET-1(Enzo公司,美国),鼠抗人PCNA单克隆抗体(武汉博士德生物技术有限公司,中国),SP-9002免疫组化染色试剂盒(北京中杉金桥公司,中国),皮质酮放免法试剂盒(中国原子能研究院同位素研究所,中国)。
1.2原代培养大鼠肾上腺皮质细胞
取大鼠肾上腺,剪碎后置于消化液(1g/L胶原酶I型,5mg/LDNA酶I型)中消化,并接种于培养皿中原代培养,12d后传代。取传代培养对数生长期大鼠肾上腺皮质细胞,制成细胞悬液,等浓度接种于96、12孔板,分别进行MTT法及免疫组化实验。
1.3ET-1对细胞增殖与分泌的影响
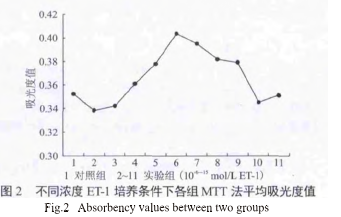
MTT法:取对数生长期细胞,调整细胞浓度为5×104/mL,每孔100μL接种于96孔板中,共接种88孔,分11组(10个实验组,1个对照组),每组8孔。过夜后弃上清液,10个实验组分别加入含10倍浓度(10-6~-15mol/L)梯度的ET-1培养基,对照组8孔换不含ET-1培养基。继续培养36h后以MTT法检测各孔吸光度值。
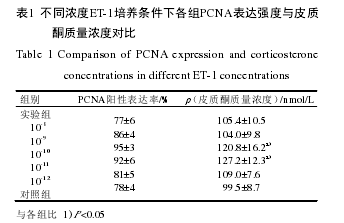
实验重复5次,计算各组平均吸光度值。免疫组化及放射免疫法:等细胞浓度传代培养于12孔板中,培养板各孔预先放置无菌玻片。一次接种2个培养板,共24孔,分6组(5个实验组,1个对照组),每组4孔。培养箱中过夜后弃上清液,5个实验组分别加入含10倍浓度(10-8~-12mol/L)梯度ET-1培养基,对照组4孔换不含ET-1培养基。完成后每天显微镜观察各孔细胞生长状况,或有无明显生长速度差别。于第5d终止培养,吸取各孔培养液留EP管,以放射免疫法检测各孔皮质酮浓度,计算各组均值。吸出培养液后取出各孔玻片,以细胞爬片免疫组化检测细胞增殖因子(PCNA)的表达,图像软件分析染色的阳性细胞个数,以平均光密度值来表示细胞染色的阳性率。
1.4统计学处理
采用SPSS19.0统计软件包进行统计学处理,实验数据以x±s表示。各组间吸光度值以及皮质酮浓度比较采用方差分析及两两比较的SNK检验,细胞PCNA阳性率采用卡方检验。
2、结果
2.1大鼠肾上腺皮质细胞原代培养
两组肾上腺细胞原代培养的细胞形态相似,胞体呈圆形或多角形,胞体大,细胞质透亮,内有许多大小较为规则的颗粒。实验观察在同批次等细胞浓度接种条件下,ET-1浓度10-10~-12mol/L组比对照组增殖速度更快,传代时间更短(图1,封1)。
2.2MTT法检测ET-1对细胞增殖的影响
随着培养液中ET-1浓度的升高,接种于96孔板中的10组细胞,吸光度值呈一单峰波形。在第6组(10-10mol/LET-1)处取得最高值,单因素方差分析结果显示各组间差异有统计学意义(P<0.01)。采用SPSS软件行SNK各组均数间的多重比较,发现处于波峰的6、7组(10-10~-11mol/L组)吸光度值与1~4,8~10组比差异有统计学意义(P<0.05)(图2)。
2.3PCNA的表达及培养液中皮质酮浓度
接种于24孔板的6组细胞,免疫组化检测的PCNA表达率与放射免疫法检测的皮质酮浓度呈大体一致的升降趋势(表1),在10-10~-11处取得最高峰值,单因素方差分析结果显示各组间差异有统计学意义(P<0.01)。采用SPSS软件行SNK各组均数间的多重比较,发现10-10~-11组与各组比差异均有统计学意义(P<0.05)。细胞免疫组化图像见图3(封1)。
3、讨论
肾上腺细胞体外培养是研究肾上腺细胞移植的第一步。在体外培养条件下可观察细胞生长、增殖及分泌的特性。本实验对大鼠肾上腺细胞进行原代培养,培养过程中观察到加或不加ET-1,细胞增殖及生长速度呈一定差异。进一步研究不同浓度ET-1对细胞的影响,分组检测细胞增殖因子PCNA的表达,及培养液中皮质激素的浓度,发现在10-10~-11mol/L时,细胞增殖与分泌最旺盛,而且仅在此适宜浓度下才具刺激细胞增殖的作用,在较高或较低浓度下均对细胞增殖无明显影响。
在体外培养条件下,ET-1能促进在正常情况下分裂增殖能力极弱的黑素细胞的增殖。也可促进大鼠骨髓内皮前体细胞的增殖,促进细胞向s期和G期转化。在体内试验中,VENDEIRA等发现ET-1可使肾上腺自体移植大鼠的血浆醛固酮和皮质酮浓度在短时间内显著增加,结缔组织被膜下分泌醛固酮的细胞显著增生,提示其可能具有促进皮质细胞增生的作用。ROSSI等研究发现,人体肾上腺皮质细胞表达ET-1的两种受体(ETA、B)。ET-1通过作用于这两种受体,可明显促进糖、盐皮质激素的分泌,通过ETA受体可促进球状带细胞的增殖。而人体肾上腺能以自、旁分泌的形式产生少量ET-1,对肾上腺皮质细胞的功能进行调节。在体外培养条件下,ET-1只有在接近皮质细胞体内正常生理浓度时,才能发挥作用。
这与其他多肽类激素在受体饱和前浓度越高效果越显著的特点不一样。这也解释了这次实验为什么ET-1只有在适宜浓度(10-10~-12mol/L)时才具促进皮质细胞增殖与分泌的作用。因此,可以认为ET-1是肾上腺皮质细胞生长代谢的重要调节激素,加入接近体内条件下的ET-1,可有效促进体外培养时皮质细胞的增殖及分泌功能,增加皮质细胞的活力,更有利于后期肾上腺细胞移植的进行。同时其促进球状带细胞增殖的作用,有望改善移植后球状带细胞不足、盐皮质激素水平低下的情况。
参考文献:
[1] 李伟,张孝斌,张杰,等. 同种异体肾上腺细胞移植[J]. 武汉大学学报:医学版,2003,24(2):157-160.
[2] DUNN J C,CHU Y,LAM M M,et a1.Adrenal cortical celltransplantation[J].J Pediatr Surg,2004,39(12):1856-1858.
[3] VENDEIRA P,NEVES D,MAGALIIA M M,et a1.Modulation of autotransplanted adrenal gland by endothelin-l:a morphological and biochemical study[J].Anat Rec,1996,246(1):98-106.
[4] YANIGASAWAM,KURIHARAH,KIMURAS,et a1.Anovel potent vasoconstricter peptide produced by vascularendothelial cells[J].Nature,1988,332:41.
[5] HIROBE T,HASEGAWA K. Effects of fibroblast-derivedfactors on the proliferation and differentiation of humanmelanocytes in culture[J].J Dermatol Sci,2013,71(1):45-57.
[6] 朱坚勇,吕中法. 碱性成纤维细胞生长因子和内皮素-1体外协同培养正常人黑素细胞[J]. 中国皮肤性病学杂志,2011,25(7):535-537,541.
[7] VENDEIRA P,PIGNATELLI D,NEVES D,et a1.Newinsights into zonal differentiation of adrenal autotransplantsin the rat:an immunohistochemical study[J].J Endocrinol,1996,149(3):497-502.
[8] VENDEIRAP,PIGNATELI D,NEVES D,et a1. Effects ofprolonged infusion of basic fibroblast growth factor andIGF-I on adrenocortical differentiation in the autotransplan-ted adrenal:an immunohistoehemical study[J]. J Endoc-rinol,1999,162(1):21-29.
[9] ROSSI G P,ANDREIS P G,COLONNA S,et al.Endothelin-1[1-31]:a novel autocrine-paracrine regulator ofhuman adrenal cortex secretion and growth[J]. J ClinEndocrinol Metab,2002,87(1):322-328.
[10] MAZZOCCHI G,ROSSI G P,MALENDOWICZ L K,et al. Endothelin-1 acting as an ETA-receptor selectiveagonist , stimulates proliferation of cultured rat zonaglomerulosa cells[J]. FEBS Lett,2000,487:194-198.





