
CD4 是 T 细胞表面抗原分子,当 T 细胞被激活时会出现磷酸化和细胞内化作用[1].传统观点认为,通过抗原递呈细胞(antigen-presenting cells,APC)的激活作用,CD4+T 细胞主要分化为 Th1 或 Th2 细胞,产生不同的细胞因子[2]. 2006 年,Veldhoen 等又发现了新的 Th 细胞亚群---Th17 效应 T 细胞和调节性 T细胞(regulatory T,Treg),它们的出现让人们对 T 细胞的分群和功能有了新的认识[3-5]. 滤泡辅助性 T 细胞(T follicular helper cells,Tfh)最早在人扁桃体中被发现,是 CD4+T 细胞的又一新亚群,主要对 B 细胞诱发体液免疫和长寿命浆细胞的形成提供帮助[6]. Tfh细胞特征性标记为趋化性细胞因子受体 CXCR5+、免疫共抑制分子 PD-1、诱导共刺激分子ICOS 和趋化因子受体 CCR7-, 同时表达转录因子 Bcl -6 (B -celllymphoma-6)。 这些特征使 Tfh 细胞明显区别于其他Th 细胞亚群,故 Tfh 细胞被划分为 Th 细胞的一个新亚群[7].
且有研究表明,Tfh 细胞与某些免疫性疾病的发生有一定关系。 例如系统性红斑狼疮(systemic lupuserythematosus , SLE ) 、 风 湿 性 关 节 炎 ( rheumatoidarthritis,RA)、免疫缺陷病和淋巴瘤等[8-10]. 这些研究都凸显出 Tfh 细胞在机体免疫中的重要作用。
1 Tfh 细胞的分化
Tfh 细胞作为 CD4+T 细胞亚群,其来源尚有争议,但一般认为机体内存在 Tfh 前体细胞。 初始的CD4+T 细胞在二级淋巴器官的 T 细胞区,通过 T 细胞受体(TCR)与树突状细胞Ⅱ型组织相容性复合体(MHC-Ⅱ)-抗原肽相互作用,被活化并发生第 1次分裂。 通常活化后的 CD4+T 细胞,高表达 CD69 和CXCR5 趋化因子,低表达 S1PR1 趋化因子[11]. 一部分分化为其他亚群的 T 细胞会下调 CXCR5 并再次高表达趋化因子受体 S1PR1,离开淋巴器官到达炎症部位发挥作用; 另一部分 Tfh 前体细胞则继续高表达CXCR5,迁移到 T-B 细胞的交界区域,在那里接受众多细胞因子的刺激,同时与 B 细胞相互作用[12],进一步分化为成熟的 Tfh 细胞,迁移至滤泡区与 B 细胞形成生发中心(germinal center,GC)。 据报道,此过程中只有那些与 MHC-Ⅱ有高亲和力的 T 细胞才能分化成为 Tfh 细胞[13].
如同 IL-12 和 IFN-γ 促进 Th1 细胞的分化,IL-4 促进 Th2 细胞的分化,IL-6、IL-1、IL-23 促进 Th17细胞的分化,转化生长因子(TGF-β)促进 Treg 细胞分化一样,Tfh 细胞也有相应的细胞因子促进其分化。 不同的 CD4+T 细胞亚群有其各自专一性转录因子介导它们分化。有试验证明,转录因子 Bcl-6 是 Tfh细胞出现的充要条件,而 Blimp-1 能抑制 Tfh 细胞的分化,正是由于 Bcl-6 与 Blimp-1 之间的相互拮抗作用保证了 Tfh 细胞的正常表达[6]. 除了 IL-21、Bcl-6和 Blimp-1,体内实验显示其他共刺激分子对 Tfh 细胞的分化也有非常重要的作用。ICOS 缺失的小鼠,或者 常 见 变 异 型 免 疫 缺 陷 病 (common variableimmunodeficiency,CVID) 患者, 因为 ICOS 突变,其Tfh 细胞缺失,GC 形成障碍,B 细胞产生 IgM 抗体也明显减少[14],GC 中 CXCR5+CD4+T 细胞被认为是真正的 Tfh 细胞[15]. 在 GC 反应完全消散后,局部淋巴滤泡中仍存在记忆 CXCR5+CD69+Tfh 细胞,这说明 Tfh细胞在免疫记忆上可能与其他 T 细胞亚群明显不同。 综上所述,Tfh 细胞是 CD4+T 细胞的一个新的亚群,具有独立的分化调控机制和传导通路,如图 1.
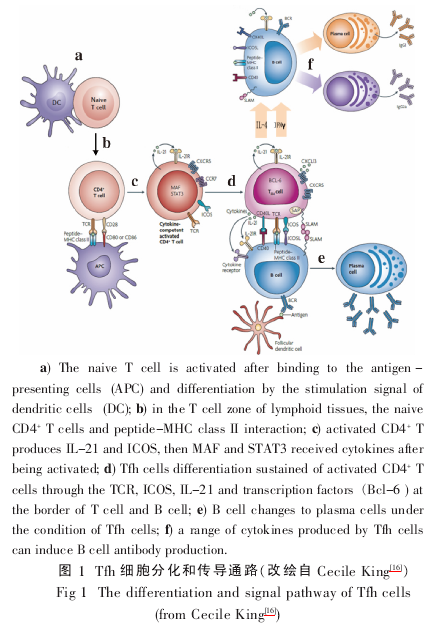
2 Tfh 细胞与其他 Th 细胞亚群之间的相互联系
Tfh 细胞产生 IL-4、IL-10、IL-17、IL-21、IFN-γ等细胞因子,促进 B 细胞的发生、增殖和分化,与 Th细胞亚群相互联系。
2.1 Tfh 细胞和 Th2 细胞 Th2 细胞最早被认为是辅助 B 淋巴细胞产生抗体的 T 细胞亚群,但是 IL-4 基因敲除小鼠并不影响抗体的产生,说明 IL-4 本身对抗体的产生不是必需的,是 Tfh 细胞而非 Th2 细胞起辅助 B 细胞的作用[17]. Tfh 细胞与 Th2 细胞的主要区别是:Tfh 细胞高表达 CXCR5 和 Bcl-6,而 Th2 则高表达 CCR4 和 GATA-3. 两者之间也有诸多共同点:比如 MaF、ICOS 和 IL-21 受体基因敲除都会导致这2 种细胞分化的缺陷,Tfh 细胞也表达 IL-4[18]. 但究竟是由于 Th2 细胞迁移到 B 淋巴滤泡区并再次分化,还是 Th2 和 Tfh 细胞本身就共享一个共同的前体,并不清楚。
2.2 Tfh 细胞和 Th1 细胞 通过分别表达 CXCR5 和CXCR3,可以区分 Tfh 细胞与 Th1 细胞。另外,研究表明 Tfh 细胞也可以表达 Th1 细胞的转录因子 T-bet[16].
2.3 Tfh 细胞和 Th17 细胞 Tfh 细胞和 Th17 细胞有一个共同的特点:分泌 IL-21,通过自分泌作用可以进一步促进细胞的分化。 在体内,IL-21 对于 Tfh 和Th17 细胞的分化都是必不可少的, 然而,Tfh 细胞不表达 RORγt 但也能产生 IL-17[19]. Th17 细胞的功能是由分泌的 IL-17、IL-21 和 IL-22 来介导完成的[20],既然 Th17 细胞高表达 IL-21, 提示它有可能对 B 细胞的增殖分化起到一定的辅助作用, 由于不表达CXCR5 而表达 CCR4 和 CCR6,导致 Th17 很可能只会迁移到炎症部位而无法进入 B 细胞区。
2.4 Tfh 细胞和 Treg 细胞 研究发现 Tfh 细胞可以由 Treg 细胞进一步分化而来, 打破了 Tfh 和 Treg 细胞是不同细胞亚群的传统观点。 通过 FOXP3 报告小鼠发现,在 Peyer 氏淋巴结中,Tfh 细胞主要由FOXP3阳性而不是阴性的 T 细胞分化而来。 在脾脏和外周淋巴结中没有发现这种现象,说明 Peyer 氏淋巴结中独特的微环境促进 Treg 细胞向 Tfh 细胞分化[21].
3 Tfh 细胞与临床疾病
Tfh 细胞在辅助 B 细胞执行免疫应答中起着至关重要的作用,打破了人们认为的 Th2 细胞是辅助 B细胞免疫应答的主要 T 细胞亚群的观点。 目前,已经很明确,Tfh 细胞才是真正负责辅助 B 细胞的 T 细胞亚群[22],Th2 细胞只起到调节作用[23]. Tfh 细胞不仅可以迁移到 B 淋巴滤泡,辅助 B 细胞产生抗体,其功能失调也参与多种疾病的发生。 Tfh 细胞必须受到严格调控,过度的活化和耐受将引起自身免疫性疾病或者免疫缺陷病。
3.1 Tfh 细 胞 与 自 身 免 疫 性 疾 病 器 官 中 CD4+CXCR5+T 细胞的含量影响机体自身免疫调节,最新研究证明,Tfh 细胞对 SLE 的发病机制有一定的影响[10]. 绝大多数 B 细胞功能依赖于 T 细胞的辅助,如果缺乏这种辅助,则 B 细胞会发生凋亡,无法分化成抗体细胞。 因此,T 细胞功能的调控障碍都对抗体的产生和特异性选择有显着影响。 在 SLE 患者中,自身反应性 B 细胞能够在 GC 存活,并分化成为浆细胞和记忆性细胞。 实验证实,患者中发现过度表达“CD4+CXCR5+PD-1hi和 ICOShi或者 ICOShiT” 的 Tfh 细胞,导致 GC 自身反应性 B 细胞失常[24]. 另外,血清中 IL-21 和 CXCL13 的含量过高也会促进 Tfh 细胞参与自身反应性抗体的产生。
Tfh 细胞还能够促进慢性炎症,例如 RA. 典型的Tfh 细胞定位于淋巴结中的 B 细胞滤泡, 能够表达CXCR5. 这是区分于 Th17 细胞的主要特征,但在免疫反应调控障碍时,Tfh 细胞被识别为非淋巴样组织,Tfh 细胞和 Th1 细胞均表达高水平的 ICOS. Tfh细胞功能障碍则在非淋巴样部位产生大量的 IL-21,促进 T 细胞介导性自身免疫性炎症,包括促进 Th17细胞分化[25].
另外,Tfh 细胞功能障碍还能导致其他的自身免疫性疾病,例如,重症肌无力(myasthenia gravis)、自身免疫性甲状腺病(autoimmune thyroid disease)、青少年型皮肌炎(juvenile dermatomyositis)、史蒂文斯-约翰逊综合征(stevens-johnson syndrome,SJS)等[26-29].
3.2 Tfh 细胞与免疫缺陷性疾病 免疫缺陷性疾病是指免疫系统中任何一个环节或其组分因先天发育不全或后天因素所致损伤,使免疫活性细胞的发生、分化、增殖和代谢异常而引起的免疫功能不全综合征。显然,Tfh 细胞辅助 B 细胞产生抗体的功能失败会导致体液免疫性缺陷。
X 连 锁 淋 巴 增 殖 性 疾 病 (X -linkerlymphoproliferative disease,XLP),患者会发生进行性低免疫球蛋白血症,GC 形成受损,无法产生记忆性 B细胞,因此,形成体液免疫缺陷[30]. CVID 和高 IgM 综合征也是由于 Tfh 细胞相关因子的缺失出现的自身免疫缺陷性疾病。 主要是由于 Tfh 细胞在 GC 出现功能障碍,造成 CD45RO+和 CD4+CXCR5+T 细胞减少[31-32].
感染猿猴免疫缺陷病毒(simian immunodeficiencyvirus,SIV)的个体,抗原激活 CD4+T 细胞,对 Tfh 细胞的产生具有协同作用,在 Tfh 细胞中高表达 IL-6R, 在 HIV 感染过程中,IL-6 促使 CD4+T 细胞向Tfh 细胞分化[30].IL-2 也可以促进 Tfh 细胞的分化。 所以导致 SIV 感染个体中 Tfh 细胞增加。
人 类 免 疫 缺 陷 病 ( human immunodeficiencyvirus,HIV)和 Tfh 也有一定的联系 . CD4+T 细胞是HIV 感染的靶细胞 ,在 HIV 感染个体中 ,其含量减少,相反的,HIV 感染者体液免疫的功能增强。在慢性HIV 感染个体的淋巴结中发现 Tfh 细胞积聚,其含量比记忆和效应 CD4+T 细胞高,对 HIV 患者进行体液免疫大有裨益。 抗逆转录病毒疗法证实,可以减少Tfh 细胞的数量,证明 HIV 患者体内 Tfh 细胞的增多也是由慢性病毒引起的[25]. HIV 感染患者体内 Tfh 细胞的增多,导致 HIV 特异性抗体的产生。
3.3 Tfh 细胞与其他疾病 有文献报道了 Tfh 细胞和淋巴瘤之间有一定关系[9]. 恶性血管免疫母细胞性 T细胞淋巴 瘤(angioimmunoblastic T cell lymphoma,AITL)细胞与 Tfh 细胞非常类似,是一种高表达 BCL-6、CXCR5、CD40L、OX40 和 PD1 的 CD4+T 细胞,并且高表达 CXCL13, 但 CD10 是 AITL 很独特的标记[33].AITL 患者表现为 B 细胞活化,高丙球蛋白血症,在淋巴结中有增生的 B 细胞滤泡,推测恶性 Tfh 细胞产生大量的 CXCL13 和组织性表达 CD40L,持续产生 IL-21,不仅促进募集 B 细胞到淋巴滤泡,而且使 B 细胞发生过度活化,产生大量免疫球蛋白[34].
随着 CD4+T 细胞研究的深入,其在免疫反应中的作用越来越被人们熟知。 有实验探究 CD4+T 细胞在乳腺癌中发挥的作用, 其结果表明,CD4+Tfh 细胞在乳腺癌的免疫调控中发挥着非常重要的作用,是癌症预后的重要因素[35].
Tfh 细胞在过敏反应中主要是影响 IgE 抗体的产生,包括过敏性哮喘,主要是 IL-4 和 CD40-CD40L的相互作用引起的。 IgE 的转变可能发生在 B 细胞发育的各个过程中,而 Tfh 细胞产生的 IL-21 可以抑制IgE 同型转变。 因此,在 IgE 抗体的产生中,Tfh 细胞起到了重大作用[36].
4 问题与展望
Tfh 细胞是 CD4+效应 T 细胞的一种新的亚群。因其表达 CXCR5、Bcl-6 和 IL-21 使得其存在于淋巴滤泡中,并辅助 B 细胞的活化和分化。 尽管人类对 Tfh的研究时间相对较短,但是越来越多的研究证明其在GC 的形成、浆细胞和记忆性 B 细胞的形成中都有关键作用,是正常机体免疫所必需的。 其功能失调会导致免疫性疾病的发生,有关 Tfh 细胞的许多重要问题还有待进一步深入研究。 例如:何为 Tfh 细胞分化的触发器?其他 CD4+T 细胞亚群与 Tfh 细胞之间是否可以相互转化? 在以小鼠为动物模型的试验中得到的有关 Tfh 细胞的结论, 可否应用到人类免疫系统中?
如何通过控制 Tfh 细胞的效应因子来治疗自身的免疫性疾病?这些都期待我们对 Tfh 细胞的形成及功能做进一步的研究。
【参考文献】
[1] Shin J, Doyle C, Yang Z, et al. Structural features of thecytoplasmic region of CD4 required for internalization [J].EMBO J, 1990, 9(2): 425-434.
[2] Liu X, Nurieva RI, Dong C. Transcriptional regulation offollicular T-helper (Tfh) Cells[J]. Immunol Rev, 2013, 252 (1):139-145.
[3] Veldhoen M, Hocking RJ, Atkins CJ, et al. TGF beta in thecontext of an inflammatory cytokine milieu supports denovo differentiation of IL -17 -producing T cells [J].Immunity, 2006, 24(2): 179-189.
[4] Bettelli E, Carrier Y, Gao W, et al. Reciprocaldevelopmental pathways for the generation of pathogeniceffector TH17 and regulatory T cells [J]. Nature, 2006,441 (7090): 235-238.





