摘 要: 目的 分析我国黄热减毒活疫苗的均匀性。方法 采用重量法测定同批疫苗的装量差异;空斑法测定同批号10支疫苗之间的病毒滴度差异;挑取20个病毒空斑,分析这20个空斑病毒亚克隆株的生长特点和空斑形态的一致性,并选取其中4个亚克隆株进行全基因组序列测定,比对分析不同亚克隆株的基因突变情况。结果 同批黄热减毒活疫苗装量差异为-3. 4%~2. 83%;同批号10支疫苗的病毒滴度几何均数为5. 12 LgPFU/mL,SD为0. 16 LgPFU/mL,CV为3%;20个空斑病毒均在传代后第5天引起的细胞病变;同一时间收获的20个空斑病毒的病毒滴度均大于7. 0 LgPFU/mL,CV为2%;20个空斑病毒亚克隆株所形成的空斑与疫苗空斑形态相似;2个空斑病毒未发生任何有义突变,1个空斑病毒发生了1个有义突变(NS5),1个空斑病毒发生了5个有义突变,其中4个位于非结构蛋白,1个位于C蛋白。结论 无论是从装量差异、病毒滴度差异、疫苗不同空斑病毒亚克隆株表型和基因型的差异,我国黄热减毒疫苗均表现出了良好的均匀性。
关键词: 黄热减毒活疫苗; 装量; 病毒滴度; 空斑; 全基因组序列; 均匀性;
Abstract: Objective To analyze the homogeneity of live attenuated yellow fever vaccine in China. Methods The difference in filling volumes of vaccine of the same batch was determined by gravimetric method,while that in the virus titers of 10 containers of vaccine of the same batch by plaque method. Twenty viral plaques were selected and analyzed for the growth characteristics of subclones and the morphology,from which four subclones were selected for complete genome sequencing. The gene mutations of various subclones were compared. Results The difference in filling volumes of live attenuated yellow fever vaccine of the same batch was-3. 4% ~ 2. 83%. The geometric mean of viral titers of 10 containers of vaccine was 5. 12 LgPFU/mL,with a SD of 0. 16 LgPFU/mL and a CV of 3%. All the 20 plaque viruses caused cytopathic changes of on the 5 th day after subculture. All the viral titers of 20 plaque viruses harvested at the same time were more than 7. 0 LgPFU/mL,with a CV of 2%. The plaques formed by the 20 subclones of plaque virus were similar in morphology to those by the vaccine. No sense mutations were observed in two plaque viruses,while one sense mutation(NS5) was observed in one plaque virus. However,five sense mutations were observed in one plaque virus,of which four were located in non-structural protein and one in C protein. Conclusion The live attenuated yellow fever vaccine in China showed good homogeneity in terms of filling volume,virus titer as well as phenotype and genotype of different plaque virus subclones.
Keyword: Live attenuated yellow fever vaccine; Filling volume; Virus titer; Plaque; Whole genome sequence; Homogeneity;
黄热病是由黄热病毒(yellow fever virus,YFV)引起,主要通过伊蚊叮咬传播的自然疫源性传染病,以高热、头痛、黄疸、蛋白尿和出血等为主要临床表现。全球约有45个非洲和南美洲国家总计超过9亿人口处于黄热病疫区内,每年黄热病病例估计有20万。2016年,黄热病疫情在安哥拉暴发,并很快向全球播散,亚洲、欧洲和美洲均出现了输入性病例[1],我国也首次出现了输入型黄热病病例[2]。
疫苗接种是目前唯一经济有效的黄热病防治措施,尤其对于控制疫区黄热病流行和预防旅行者感染十分重要。17D疫苗是世界范围内广泛使用的也是唯一的黄热病疫苗,全世界所有用于黄热病疫苗生产的毒种均来自野毒株Asibi株。将该病毒经腹腔接种、蚊子叮咬、皮下接种、感染蚊子悬液注射等方法在猴体内连续传54代,再在鼠全胚中传18代,鸡全胚中传58代,去除脑和脊髓的鸡胚中连续传代至第180代,获得17D原始减毒疫苗株[3]。随后该减毒株继续在鸡胚中连续传代,不同代次水平的毒种流传到不同国家用于黄热病疫苗生产。目前,用于黄热病疫苗生产的17D毒株为17DD、17D-204以及WHO选用毒株17D-213[4]。
我国黄热减毒活疫苗生产用毒株为17D-204衍生株,为我国着名学者汤飞凡院士于1947年从美国洛克菲勒基金会带回,后在鸡胚中连续传54代,作为工作毒种。相比其他黄热病疫苗生产毒株,我国黄热疫苗生产毒株代次要高50代左右。黄热病疫苗为减毒活疫苗,多次传代可能会引起核苷酸突变增多,病毒株的纯度也可能会降低,甚至可能会出现毒力相关位点的回复突变,疫苗株毒力返祖的情况。《中国药典》对疫苗生产用毒种采用三级库管理,对疫苗毒种代次要求极为严格,尤其是减毒活疫苗。我国黄热减毒活疫苗质量标准以及WHO TRS978均要求对疫苗生产用工作种子批进行全基因组测序或至少关键蛋白基因测序[5,6]。
本研究对我国黄热减毒活疫苗的均匀性、一批疫苗中是否存在突变毒株、突变毒株的生物学性状是否改变及其对该批疫苗安全性的影响进行分析,现将结果报道如下。
1、 材料与方法
1.1、 疫苗及细胞
黄热减毒活疫苗(批号:20180402)由北京生物制品研究所有限责任公司提供;Vero细胞为中国食品药品检定研究院虫媒病毒疫苗室保存。
1.2、装量差异测定
随机抽取10支黄热减毒活疫苗,逐支除去标签、铝盖,一一标记后,小心开启胶塞,使容器内外气压平衡,盖紧后,分别置于万分之一天平内精密称量瓶与内容物的总重量(W1)。倾出内容物,用水清洗容器,置于烤箱内干燥后,再分别一一精密称量容器的重量(W2)。计算每支疫苗的装量(W)(W1-W2)及10支疫苗的平均装量。将每支疫苗装量与平均装量相比较,计算同批次疫苗的装量差异。
1.3、 病毒滴度差异测定
随机抽取10支黄热减毒活疫苗,采用空斑法测定每支疫苗的病毒滴度。将Vero细胞按8×104个/m L的密度接种6孔细胞培养板,每孔4 mL,37℃,5%CO2培养箱中培养48 h;将10支黄热减毒活疫苗分别按照标示量复溶后,进行4倍系列稀释,取1∶1 024、1∶4 096、1∶16 384、1∶65 536稀释度的疫苗,接种于长满单层Vero细胞的6孔板中,每孔0.4 mL,每个稀释度接种2孔,37℃,5%CO2吸附60 min;加入甲基纤维素覆盖物,4 mL/孔,37℃,5%CO2孵箱内培养7 d;吸弃6孔板中的覆盖物,加结晶紫染色液,每孔1 mL,染色15~20 min;弃去染色液,用流水冲洗培养板,计数每支疫苗每个稀释度每孔的蚀斑数,计算疫苗的病毒滴度。
1.4、 病毒株空斑病毒亚克隆的挑选
将Vero细胞按8×104个/m L接种6孔细胞培养板,每孔4 mL,37℃,5%CO2培养箱中培养48 h;将黄热减毒活疫苗4倍系列稀释,取1∶1 024、1∶4 096、1∶16 384、1∶65 536稀释度的疫苗接种于长满单层Vero细胞的6孔板中,每孔0.4 mL,每个稀释度接种4孔,37℃,5%CO2孵箱内吸附1 h;加入甲基纤维素覆盖物,4 mL/孔,37℃,5%CO2孵箱内继续培养7 d;在生物安全柜内去除板孔中的甲基纤维素,肉眼挑取板孔中单个独立的病毒空斑,共计20个,分别编号为YFV1~YFV20。
1.5、 空斑病毒亚克隆株的培养及生长特性初步观察
将挑取的20个空斑病毒亚克隆各经1 mL病毒稀释液重悬混匀后,分别接种至已长成单层的Vero细胞(T25细胞培养瓶)上,继续于37℃,5%CO2孵箱内培养,逐日观察并记录每个亚克隆的细胞病变(CPE)情况。当CPE出现莘时,收获相应的亚克隆病毒株,于-70℃冻存备用。
1.6 、20个空斑病毒亚克隆株的病毒滴度测定
将收获的20个空斑病毒亚克隆株分别进行4倍系列稀释,各取1∶1 024、1∶4 096、1∶16 384、1∶65 536四个稀释度的亚克隆株,按1.3项方法测定病毒滴度。染色后,计数每个亚克隆病毒株、每个稀释度、每孔的蚀斑数,计算每个亚克隆株的病毒滴度。
1.7、 4个空斑病毒亚克隆株的全基因组序列测定及比对
选取编号为YFV5、YFV10、YFV15、YFV20的4个亚克隆病毒株,按表1中引物序列及扩增条件,将全基因组序列分9段扩增,PCR产物回收后送英潍捷基(上海)贸易有限公司测序。利用DNASTAR软件中的SeqMan模块进行每个亚克隆株的全基因组序列拼接,并用其中的MegAlign模块进行4个亚克隆株的全基因组序列比对。引物由英潍捷基(上海)贸易有限公司合成。
表1 黄热减毒活疫苗毒株全基因组测序用引物序列

2、 结果
2.1 、同批次疫苗的装量差异
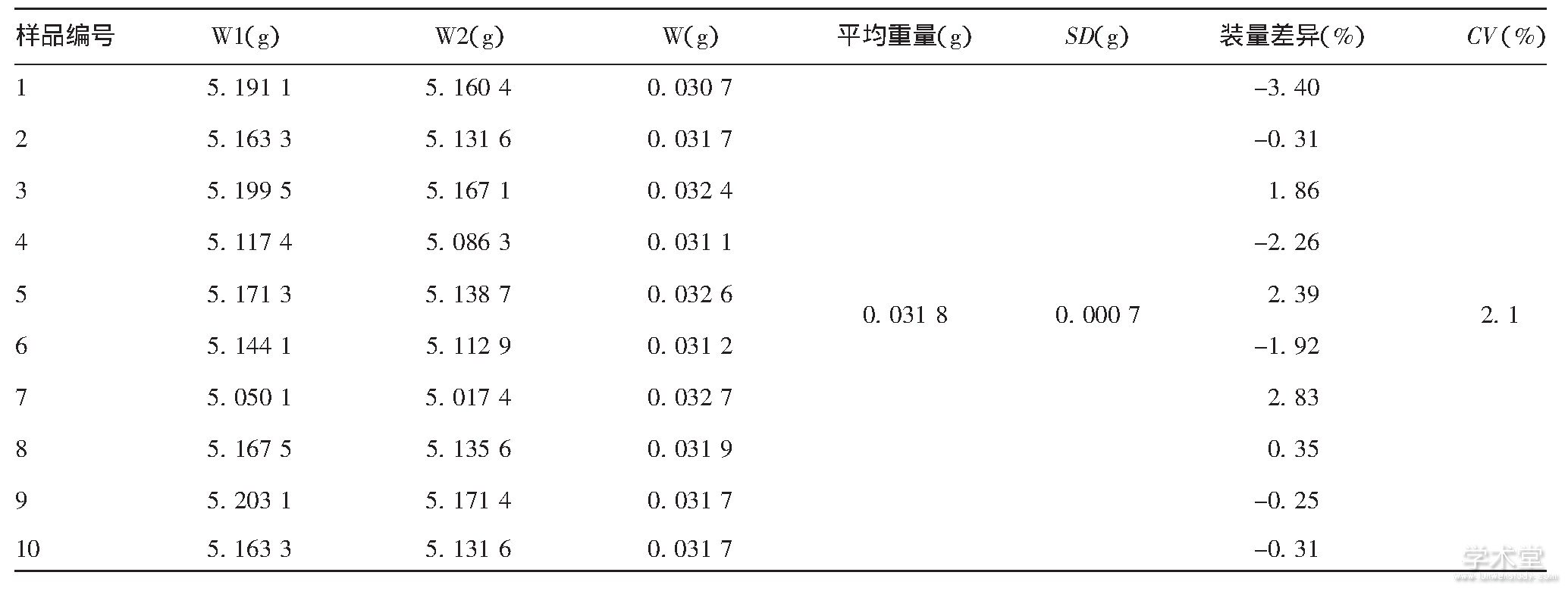
该批次黄热减毒活疫苗的平均重量为0.031 8 g,标准差(SD)为0.000 7 g,变异系数(CV)为2.1%,装量差异为-3.4%~2.83%。最小重量与最大重量的差值为0.002 g,见表2。
2.2、 同批次疫苗的病毒滴度差异
10支同批次黄热减毒活疫苗的病毒滴度分别为5.00、4.90、5.05、5.28、5.31、5.37、5.06、5.12、5.20、4.97 LgPFU/mL,几何均数为5.12 LgPFU/mL,SD为0.16 LgPFU/m L,CV为3%。病毒滴度最大值与最小值之差为0.47 LgPFU/mL。
2.3、 20个空斑病毒亚克隆株的培养及收获
CPE效应观察发现,第3天有12个亚克隆株CPE达+,第4天CPE可达+~荻,第5天20个亚克隆株的CPE均达莘。因此,于第5天收获挑取的20个天坛株亚克隆株。
表2 10支同批次黄热减毒活疫苗的装量差异
2.4、 20个空斑病毒亚克隆毒株的病毒滴度及空斑形态
20个亚克隆株的病毒滴度分别为7.16、7.37、7.20、7.28、7.06、7.19、7.28、7.11、7.14、7.45、7.42、7.46、7.26、7.15、7.43、7.57、7.13、7.39、7.23、7.44 LgPFU/mL,几何均数为7.28 LgPFU/mL,SD为0.15,CV为2%,最高滴度与最低滴度的差值为0.51 LgPFU/mL。20个空斑病毒亚克隆株所形成的空斑形态相似:空斑较小,边缘清晰,大小均匀。其中,YFV5、YFV10、YFV15、YFV20四个亚克隆株所形成的空斑形态见图1。
图1 天坛株亚克隆株的空斑形态图
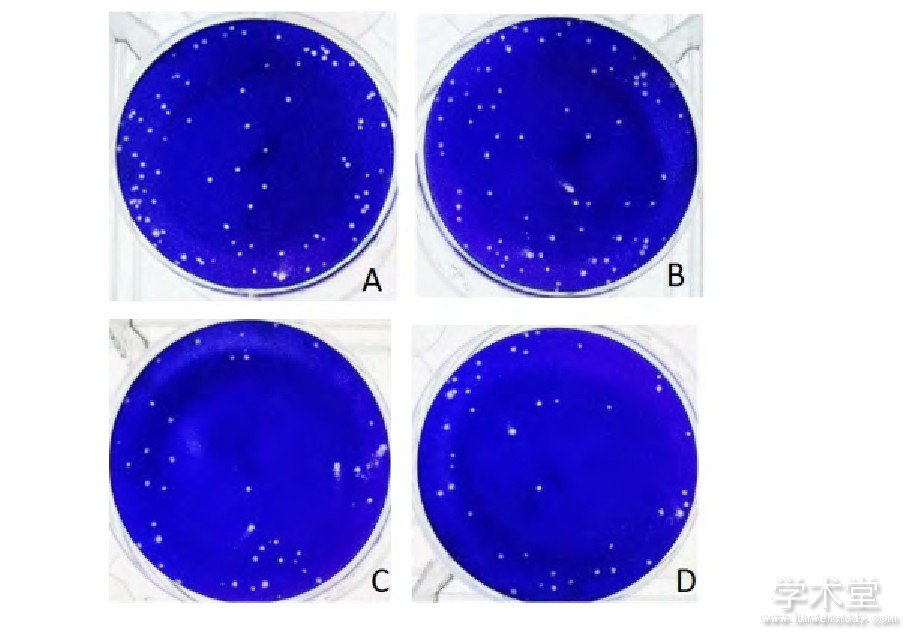
Fig 1.Plaque morphology of subclones of Tiantan strain
A~D:分别为YFV5、YFV10、YFV15、YFV20亚克隆株的空斑。
2.5、 4个空斑病毒亚克隆株的全基因组序列及与疫苗株的比对分析
YFV5、YFV10、YFV15、YFV20四个亚克隆株分9段进行PCR扩增,均扩增出目的基因片段,见图2。与GenBank中提交的该疫苗株基因序列(FJ654700)相比,YFV15与YFV20亚克隆株未发生有义突变;YFV5亚克隆有5个有义突变,1个有义突变在C蛋白上,其他4个有义突变均在非结构蛋白;YFV10亚克隆株仅有1个有义突变,在非结构蛋白NS5上。见表3。
图2 空斑病毒亚克隆株全基因组分段扩增电泳图
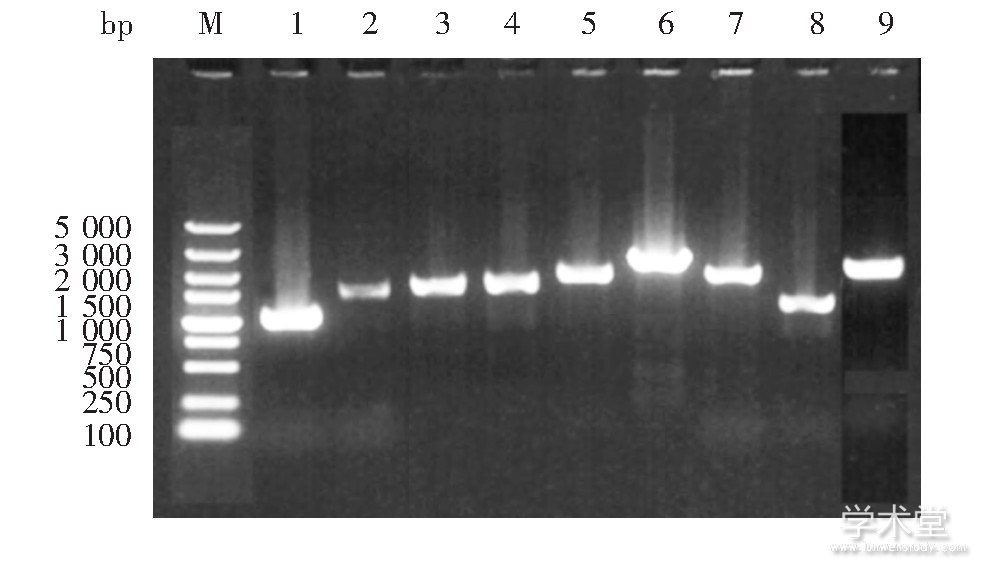
Fig 2.Electrophoretic profile of segmental amplification product of whole genome of plaque virus subclones
M:DNA marker;1~9:9段PCR扩增产物。
表3 4个空斑病毒亚克隆株与疫苗株的全基因组序列比对分析
注:粗体处为突变的核苷酸。
3、 讨论
17D疫苗是世界范围内广泛使用的也是唯一的黄热病疫苗,被认为是迄今为止最安全有效的疫苗之一。目前用于黄热病疫苗生产的3个17D亚株17DD、17D-204以及WHO选用毒株17D-213,实际为经不同传代方式获得的不同代次的17D株,是未经蚀斑纯化的,均为含有不同大小蚀斑毒株或基因变异株的异源性亚群[7]。17D疫苗的蚀斑变异株的相对比率随着传代培养而变化[8]。
虽然我国黄热疫苗生产毒株相比其他黄热病疫苗生产毒株代次要高50代左右,但从近70年100多万剂的使用情况来看,无严重不良反应报道,疫苗的安全性值得信赖。为了更好地评价我国黄热减毒活疫苗的安全性,本研究对该疫苗的均匀性进行了分析。
装量均匀性良好,是一批疫苗质量均匀的基础。从最基本的装量差异结果来看,同批疫苗装量的CV仅为2.1%,对平均重量仅为0.031 8 g的疫苗产品来说,我国黄热减毒活疫苗装量均匀性良好,这也为同批疫苗不同支间的滴度均匀奠定了良好的基础。采用经典的黄热病疫苗滴度测定方法—空斑法测定了10支同批次黄热减毒活疫苗的病毒滴度,结果显示,CV仅为3%,最大值与最小值之差仅为0.47 LgPFU/mL,表明病毒滴度均匀性良好。为进一步研究疫苗中黄热病病毒的表型和基因型的均匀性,挑取20个病毒空斑进行生长趋势及空斑形态初步分析,结果显示,20个空斑病毒的生长趋势基本一致,均可在传代后的第5天引起莘的细胞病变,而同一时间收获的20个空斑病毒的病毒滴度均大于7.0 LgPFU/mL,CV为2%,且20个空斑病毒亚克隆株所形成的空斑形态相似,与疫苗空斑形态基本一致。对其中4个空斑病毒亚克隆株进行全基因组序列测定比对分析,结果有2个空斑病毒亚克隆株未发生任何有义突变;而发生有义突变的两个亚克隆株,共6个有义突变,其中有5个有义突变在非结构蛋白上,仅1个在结构蛋白—C蛋白上。该基因序列比对结果也基本印证了空斑病毒的表型一致性。由此可见,虽然我国黄热减毒活疫苗代次偏高,但无论从装量差异、病毒滴度差异、疫苗不同空斑病毒亚克隆株表型和基因型的差异,我国黄热减毒疫苗株均表现出了良好的均匀性。17D疫苗株的高遗传稳定性也再一次被印证。该结果也与XIE等[9]的研究结果一致,他们分析了自17D-204疫苗接种者体内分离的17D病毒株的基因序列,发现结构基因无变异发生,仅NS5发生2个有义突变;分离并分析猴体脑内接种17D-204疫苗12 d后血清所得的病毒株,未发现有义突变。
与其他逆转录病毒相比,17D疫苗株具有较高的遗传稳定性,这也是单一病毒株(17D)这么多年来能够发挥疫苗作用的关键所在。但17D疫苗株是未经蚀斑纯化的异源性亚群,17D疫苗为准种混合制剂,同源序列分析证明,17D疫苗存在12个氨基酸的异质性,包括结构性和非结构性基因以及3′端编码区域[10]。但也有研究认为,基因型和表型的异源性改变可能不会影响17D疫苗的安全性,对疫苗可能具有积极作用[11]。无论怎样,均需密切关注黄热病疫苗的均匀性,尤其要关注生产用毒株的异质性变异,表型和基因型的变化,从多方面进行疫苗毒株的安全性研究,提高疫苗毒株的质量控制标准,切实保障黄热病疫苗的使用安全。
参考文献
[1] WILDER-SMITH A,MONATH T P. Responding to the threat of urban yellow fever outbreaks[J]. Lancet Infect Dis,2017,17(3):248-250.
[2] LING Y,CHEN J,HUANG Q,et al. Yellow fever in a worker returning to China from Angola,March 2016[J]. Emerg Infect Dis,2016,22(7):1317-1318.
[3] LLOYD W,THEILER M,RICCI N I. Modification of the virulence of yellow fever virus by cultivation in tissues in vitro[J].Transact Royal Soci Trop Med&Hyg,1936,29(5):481-529.
[4] ROBERTSON S E. The immunological basis for immunization. 8.Yellow fever[M]. Geneva:WHO Document WHO/EPI/GEN/93.18,1993.
[5]国家药典委员会.中华人民共和国药典2015年版第一增补本[S].北京:中国医药科技出版社,2018:323-325.
[6] WHO. Recommendations to assure the quality,safety and efficacy of live attenuated yellow fever vaccines[J]. WHO TRS,2010,978:267.
[7] GOULD E A,BUCKLEY A,CANE P A,et al. Use of a monoclonal antibody specific for wild-type yellow fever virus to identify a wild-type antigenic variant in 17D vaccine pools[J]. J General Virol,1989,70(7):1889.
[8] LIPRANDI F. Isolation of plaque variants differing in virulence from the 17D strain of yellow fever virus[J]. J General Virol,1981,56(2):363-370.
[9] XIE H,RYMAN K D,CAMPBELL G A,et al. Mutation in NS5 protein attenuates mouse neurovirulence of yellow fever17D vaccine virus[J]. J General Virol,1998,79(4):1895-1899.
[10] PUGACHEV K V,OCRAN S W,GUIRAKHOO F,et al. Heterogeneous nature of the genome of the ARILVAX yellow fever17D vaccine revealed by consensus sequencing[J]. Vaccine,2002,20(7):996-999.
[11] BARRETT ADT. Yellow fever vaccines[J]. Biologicals,1997,25(1):17-25.





