摘 要: 衣原体是一类专一细胞内寄生的人兽共患病病原体 , 所引起的动物及人类疾病相当广泛。本文以亚单位疫苗及DNA疫苗为重点 , 对衣原体疫苗的研究状况做了简要的介绍
关键词: 衣原体; 亚单位疫苗; DNA疫苗;
衣原体是一类专一细胞内寄生、不能合成ATP且具有独特发育周期的革兰氏阴性杆菌。它是人兽共患病病原体, 引起的人类疾病相当广泛[1]。它还是一些致病原的辅助因子, 例如可以使Ⅰ型人类免疫缺陷病毒的传播变得更加容易。衣原体感染动物后也可引起一系列反应, 如导致牛、羊流产, 致使母鸡不能正常产卵, 从而对养殖、畜牧业造成很大危害, 因而衣原体疫苗的研制具有很重要的意义。在衣原体疫苗研究的过程中有突破, 也存在许多问题。现以分子疫苗为重点, 将国内外这方面的研究进展综述如下。
1、 减毒或灭活衣原体
其实, 早在50年代就开始了对衣原体疫苗的研究, 人们首先想到的是用灭活或减毒的衣原体来制备疫苗。胎盘提取或鸡胚卵黄囊培养的鹦鹉热衣原体经福尔马林灭后注射到羊体内, 可引起母羊对地方性羊流产病 (OEA) 的抗性。用皮试检测细胞介导的免疫反应, 用ELISA的方法研究体液免疫反应, 结果表明, 灭活的鹦鹉热衣原体可以使羊在接种活的鹦鹉热衣原体后不出现OEA的临床症状或者不分泌衣原体[2]。随着细胞实验技术的发展, 人们开始用细胞来培养衣原体, 其原体经纯化后灭活, 效果也较好。在此基础上形成的疫苗产物使用了几十年。
但是这种衣原体疫苗还存在很多问题。比如尽管这种不经肠胃的免疫法在人身上取得了一些成功, 但是所获得的保护性是短暂的, 效果也不尽相同[3], 而且在许多实验中出现迟发型超敏反应, 由于超敏反应有些还引发了更严重的疾病, 因而去除致敏原是衣原体疫苗研究中的一个重要课题。另外由于减毒或灭活疫苗需用细胞培养或鸡胚卵黄囊培养, 技术要求高, 培养周期长, 大批量生产困难, 且在人体上的应用尚存在较多限制, 因而随着分子生物技术的发展, 人们逐渐地将研究重点转移到亚单位疫苗上来[4]。
2、 亚单位疫苗
在亚单位疫苗的研究中, 确定保护性表位是很重要的一步, 方法之一就是利用具有中和性的单克隆抗体来鉴定结构或表位[5]。
主要外膜蛋白 (Major outer membrane protein, MOMP) 。衣原体外膜蛋白在感染过程中起着非常重要的作用, 如衣原体宿主细胞的粘附、摄入、或许还包括阻止溶酶体与包涵体的融合[6]。在自然感染的患者和动物模型中可出现高效价的MOMP血清抗体, Zhang及其合作者发现如果某单克隆抗体可识别MOMP暴露在衣原体表面的表位, 则该单抗可中和衣原体的感染力。因而主要外膜蛋白就成了衣原体亚单位疫苗研制的首要候选者, 也是八、九十年代衣原体疫苗研究的重点。
Mauro Campos等人[7]以野外捕捉的猕猴为感染动物对MOMP产生的保护性进行了研究。沙眼衣原体血清型C/TW-3的原体 (EB) 经密度梯度离心后得到纯化, 利用非离子去垢剂辛基-β-D-吡喃葡糖苷 (OGP) 及二硫苏糖醇可将MOMP从EB中抽提出来, 免疫途径为眼部感染、口服及肌肉注射, 佐剂分别为霍乱毒素、弗氏不完全佐剂和弗氏完全佐剂, 感染前14天做最后一次免疫。整个过程可归纳为表1:
表1 利用OGP提取的MOMP及佐剂在5周内对一组猕猴进行免疫的方案
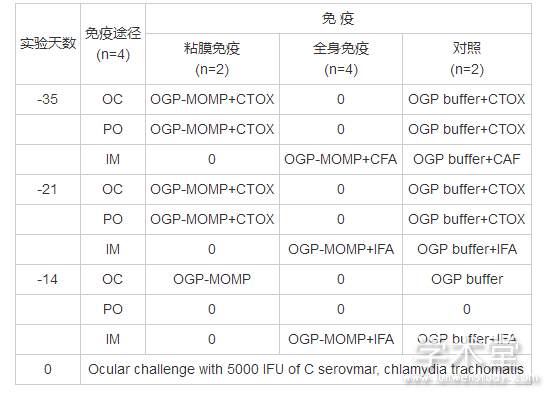
OC:眼部, 20 μg;PO:口服, 100 μg; IM:肌肉注射, 100 μg;OGP:辛基吡喃葡糖苷;MOMP:主要外膜蛋白;CTOX:霍乱毒素;CFA:弗氏完全佐剂;IFA:弗氏不完全佐剂
感染后连续6周对所有的猕猴进行临床检查及收集标本, 并进行淋巴细胞功能分化检测、血清学检验、SDS-PAGE、免疫印迹及统计分析, 结果表明, 在血清及粘膜中出现了IgG特异抗体, 粘膜中出现了IgA, 并且发生了细胞介导的免疫反应。
由于MOMP来源、提取方式、免疫途径等的不同, 免疫效果也有所不同。表2[8]归纳了近年来以MOMP为基础的疫苗的研究情况。
表2 MOMP疫苗在衣原体感染动物模型中产生的保护性
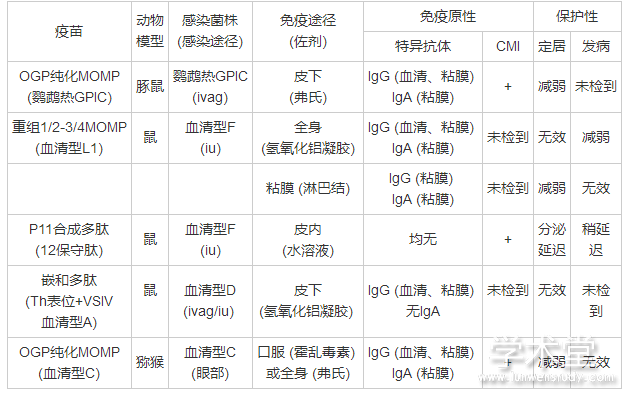
CMI:细胞介导的免疫;GPIC:豚鼠结膜炎包涵体;GT:生殖道;iu:子宫内;ivag:阴道内;OGP:辛基-β-D-葡糖苷
除MOMP外, 60 kD半胱氨酸富含蛋白 (Cysteine-rich proteins , Crps) 、90 KD蛋白家族及衣原体热休克蛋白 (C-hsp60) 也受到人们的重视, 人们对其免疫原性及作为抗原的可能性进行了研究。从目前来看, 还没有十分成功的衣原体亚单位疫苗例证, 这或许是因为亚单位疫苗的免疫原所引发的保护性细胞和体液免疫反应不能被衣原体上的天然表位重新激发[3], 另外, 即使有部分的保护性也是短暂的。
3、 DNA疫苗
DNA免疫法是一种新的方法, 它可以刺激机体产生针对传染性疾病的保护性免疫。与以蛋白或者多肽为基础的亚单位疫苗不同, DNA免疫法是通过外源蛋白在宿主的内源性表达而获得免疫保护性的, 这种抗原提呈方式更类似于病毒或者其他细胞内致病原的自然感染。
Zhang Dong-ji[3]等人试验了衣原体DNA疫苗。将MOMP基因扩增、酶切后连入真核表达载体质粒pcDNA3, 质粒通过电击法转入大肠杆菌DH5 α中, 扩增后提取并溶解于盐水中。
在0、3、6周用质粒DNA对4~5周龄的BALB/c小鼠进行肌肉注射 (200 μg, 四头肌) , 阴性对照小鼠用盐水或空白质粒载体来免疫。第三次免疫后两周检验发现产生了明显的MOMP特异的迟发型超敏反应及抗体, 并且在用沙眼衣原体鼠肺炎株 (MoPn) 经密度梯离心后获得的纯化EB感染小鼠肺部后 (鼻内接种) , 可明显抑制MoPn的生长高峰, 且与对照小鼠相比, 体重减轻较少。
Robert[9]等人所做实验与上述实验很相似, 同样利用pcDNA3做载体, 肌肉注射或鼻内接种或者口服MOMP DNA转染的沙门氏菌。免疫后的小鼠进行肺部感染, 发现在20~200 μg范围内, 随着MOMP DNA量的增加, 保护性也随之提高。除抗原特异迟发型超敏反应外, 淋巴细胞增殖及干扰素γ分泌也被激发。同时还发现, 粘膜免疫比肌肉注射效果要好, 这或许是因为沙眼衣原体感染主要局限在粘膜表面, 在粘膜 (肠道) 进行局部免疫接种, 也可以令较远处粘膜获得保护性。
Sukumar Pal等人[10]构建了四个不同的质粒, 分别携带MOMP或可变区相对应的DNA序列。免疫后小鼠产生了较弱的体液及CMI反应, 但是对生殖道感染无明显的保护作用, 与上述实验结果有明显的差异。Sukumar Pal将其归结为质粒载体上起筛选作用的抗生素基因、所用DNA量及免疫途径的不同。
总之, DNA免疫法是衣原体免疫预防中很有前景的一种新方法, 尽管在应用到人身上之前, 其效能及安全性需要进一步的研究, 但目前这些结果是很令人鼓舞的, 我们也应该对其进行更深入的讨论和研究, 如引入编码免疫调节细胞因子的DNA, 或者在多MOMP基因的基础上设计多价疫苗, 这可能会提高保护性免疫的水平。
参考文献
[]〔1〕 刘钢 , 衣原体及其相关疾病研究新进展〔J〕 .国外医学·儿科学分册 1998, (5 ) :2 5 1 2 5 5 .
〔2〕 WinlsmoreA .J.DawsonM .TrowerC .J , etal.Ovineenzooticabortion :Fieldobservationsonnaturallyacquiredandvaccine eliciteddelayedtypehypersensitivitytoChlamydiapsittace (ovis〔J〕 .VetRec 1986Mar, 118 (12 ) :3 13 3 3 2 .
〔3〕 ZhangDong ji, YangXi, BettyJody .etal.DNAvaccinationwiththemajoroutermembraneproteingeneinducesacquiredimmunitytochlamydiatrachomatis (MousePneumonitis) inffection〔J〕 .TheJournalofinfectiondiseases 1997, 176:10 3 5 40 .
[4] 〕 JuliusSchachter .Overviewofchlamydiatrachomatisinfectionandtherequirementforavaccine〔J〕 .RevInfectDis 1985Nov , 7 (6) :713 6.
〔5〕 EllenaM .Peterson , LuisM .DELAMaza , LoreBrade , etal.Characterizationofaneutralizingmonoclonalantibodydirectedatthelipopolysaccharideofchlamydiapneumoniae〔J〕 .InfectionandImmunity 1998Aug , :3 848 3 85 5 .
〔6〕 DavidLongbottom , MaryRussell, SusannaM .Dunbar , etal.Molecularcloningandcharacterizationofthegenescodingforthehighlyimmunogenicclusterof 90 Kilodaltonenvelope proteinsfromthechlamydiapsittacisubtypethatcausesabortioninsheep〔J〕 .InfectionandImmunity 1998Apr :13 17 13 2 4.
〔7〕 MauroCampos, SukumarPal , TerrenceP .O’brien , etal.AChlamydialMajorOuterMembraneproteinExtractasaTrachomaVaccineCandidate〔J〕 .InvestigativeOphthalmology&VisualSci ence 1995July , Vol 3 6, No .8:14 77 14 91.
〔8〕 AndrewJ.Stagg .VaccinesagainstChlamydia :approachesandprogress〔J〕 .MolecularMedicineToday 1998April:166 173 .
〔9〕 RobertConradBrunham , MD , andDong jiZhang , etal.Trans geneasvaccineforchlaydia〔J〕 .AmericanHeartJournal 1999Nov , Vol, 13 8, No .5 , pat 2 :5 5 19 5 5 2 2 .
[]〔10〕 SukumarPal, KerryM .Barnhart , Qunwei, etal.VaccinationofmicewithDNAplasmidscodingfortheChlamydiatrachomatismajorouterembraneproteinelicitsanimmuneresponsebutfailstoprotectagainstagenitalchallenge〔J〕 .Vaccine 1999, 17:45 9 465





