血液内科论文第三篇:血液肿瘤患者的大剂量甲氨蝶呤使用情况探析
摘要:目的:了解某三级甲等医院 (以下简称“该院”) 血液内科大剂量甲氨蝶呤治疗血液肿瘤的情况。方法:收集2015年4月至2017年4月该院血液内科使用注射用大剂量甲氨蝶呤患者的电子病历, 设计临床数据统计观察表 (纸质版) 并录入患者的临床数据, 利用Epidata 3.1软件建立电子数据库并进行数据转录, 最后使用Excel软件统计数据。对患者基本情况、治疗信息、用药前评估、碱化情况、水化情况、亚叶酸钙解救及漱口水治疗、治疗药物监测与不良事件等各临床指标进行统计分析。结果:共纳入19例患者 (31例次) , 所有患者都进行了碱化、亚叶酸钙解救及治疗药物监测;化疗期间水化覆盖率为87.1% (27例次) ;93.5% (29例次) 的患者使用了漱口水进行口腔黏膜炎的预防和治疗;2例患者发生严重肾损伤, 1例患者发生严重肝损伤;恶心、非预期呕吐、口腔黏膜炎和4级骨髓抑制的发生率分别为22.6% (7例次) 、12.9% (4例次) 、25.8% (8例次) 和48.4% (15例次) 。结论:血液内科大剂量甲氨蝶呤的使用总体较规范, 相关治疗环节需进一步完善。药师可使用多种方法优化大剂量甲氨蝶呤的使用。
关键词:大剂量甲氨蝶呤; 应用现状; 治疗药物监测; 不良事件;
Analysis of High-Dose Methotrexate in the Treatment of Hematological Malignancies
TAN Zhiyuan CHEN Ken LIU Wei WAN Wei HU Kai ZHAO Rongsheng
Dept.of Pharmacy, Peking University Third Hospital Pharmacy Administration and Clinical Pharmacy, Peking University Pharmaceutical Science Dept.of Hematology, Peking University Third Hospital
Abstract:OBJECTIVE: To investigate the current status of high-dose methotrexate in the treatment of hematological malignancies in a grade Ⅲ level A hospital (hereinafter referred to as “the hospital”) . METHODS: Electronic medical records of patients with high-dose methotrexate for injection in the department of hematology of the hospital from Apr. 2015 to Apr. 2017 were collected. The clinical data observation table (paper version) was designed and the clinical data were recorded. Epidata 3.1 was used to establish the electronic database and transcribe the data. Patients' basic information, treatment information, pre-medication evaluation, alkalization, hydration, calcium folic acid rescue and mouthwash treatment, therapeutic drug monitoring and adverse events were statistically analyzed. RESULTS: A total of 19 patients (31 case-times) were enrolled, and all patients underwent alkalization, calcium folic acid rescue and therapeutic drug monitoring. During chemotherapy, the hydration coverage rate was 87.1% (27 case-times) . And 93.5% (29 case-times) used mouthwash for the prevention and treatment of oral mucositis. There were 2 patients developed severe kidney injury and 1 patient developed severe liver injury. The incidences of nausea, undesired vomiting, oral mucositis, and grade Ⅳ myelosuppression were 22.6% (7 case-times) , 12.9% (4 case-times) , 25.8% (8 case-times) , and 48.4% (15 case-times) . CONCLUSIONS: The use of high-dose methotrexate in the department of hematology is generally standardized, and relevant treatment links need to be further improved. Pharmacists can use a variety of methods to optimize the use of high-dose methotrexate.
甲氨蝶呤 (methotrexate, MTX) 为临床常用的叶酸拮抗剂, 小剂量 (≤50 mg/m2) 时应用于免疫相关疾病如类风湿关节炎。当给药剂量>500 mg/m2应用时为大剂量甲氨蝶呤 (high-dose methotrexate, HDMTX) , 可单独应用或与其他化疗药联合应用, 适用于急性白血病、高风险淋巴瘤 (中枢、睾丸侵犯或难治者) 、骨肉瘤和支气管肺癌等[1]。目前, HDMTX的应用面临着如下问题: (1) 个体差异较明显。血药浓度受诸多因素影响, 如患者的年龄、肝肾功能、尿的酸碱度、肿瘤类型、联合用药情况及其他体质因素等, 且相关代谢酶的基因存在基因多态性, 故理论上需要进行治疗药物监测 (therapeutic drug monitoring, TDM) 。 (2) 用药风险极高。HDMTX治疗指数低, 毒性较大, 可能引发肾毒性、肝毒性、黏膜毒性、胃肠道损伤、肺毒性、血液毒性、神经毒性、皮肤毒性和超敏反应等严重药品不良事件 (adverse drug event, ADE) 。 (3) 用药较复杂。HDMTX应用时的随行医嘱较多, 涉及水化、碱化、尿液pH监测、输注时间、血药浓度监测、亚叶酸钙解救及出入量记录等。由此可见, HDMTX的给药相关环节复杂, 在给药前后均需密切监测。文献检索结果显示, 目前的临床研究主要集中于血药浓度/基因型与疗效、不良反应发生风险之间的关系[2,3,4,5]以及HDMTX个体化给药模型构建[6,7,8]等, 尚无针对药物使用全流程进行完整分析的相关研究。本研究对某三级甲等医院 (以下简称“该院”) 血液肿瘤患者的HDMTX使用情况进行回顾性分析, 以期对HDMTX用药全流程进行更高效的管理, 规范HDMTX用药前评估、辅助用药、常规给药方法、TDM与解救等, 提高HDMTX及其辅助药物临床应用的有效性及安全性。
1 资料与方法
1.1 资料来源
研究对象为2015年4月至2017年4月该院血液内科的住院患者。纳入标准:病理诊断为血液系统恶性肿瘤 (需有细胞形态学、免疫组织化学、细胞遗传学或分子生物学诊断) , 中枢淋巴瘤/白血病患者需有明确的肿瘤中枢侵犯证据 (如脑脊液检出肿瘤细胞、正电子发射计算机断层显像提示中枢存在高代谢病灶等) ;接受HDMTX单药治疗或联合化疗。本研究对象不限年龄及种族。
1.2 方法
1.2.1 设计研究的病例报告表 (case report form, CRF) :
按照患者基本情况、治疗信息、用药前评估、碱化及维生素B、水化、亚叶酸钙解救、TDM和ADE等8个模块设计CRF, 初稿经血液内科临床医师和临床药师审定修改, 并随机选取3例患者的治疗信息进行预填, 确定CRF终稿。
1.2.2 填写CRF:
从血液内科临床药师工作记录中获取使用HDMTX治疗的患者病历号及姓名, 在医院信息系统 (hospital information system, HIS) 中调取患者住院病历。采用单人录入 (谈志远) 、双人核对 (陈恳、谈志远) 的方式填写CRF。如有争议, 寻求第三者 (刘维) 解决。
1.2.3 设计并录入电子数据库:
采用Epidata 3.1软件建立HDMTX治疗血液肿瘤回顾性研究电子数据库, 信息记录内容与CRF一致, 变量类型包括数值型、字符型和布尔逻辑。单人录入 (谈志远) CRF中的内容, 在进行双人审核 (陈恳、谈志远) 校对后, 保存, 锁定。录入完毕后, 数据导出为Excel表格。
1.2.4 数据统计与分析:
按照病例基本信息、治疗信息、用药前评估、碱化水化、亚叶酸钙解救及漱口水、复合维生素B使用情况、TDM情况以及ADE情况, 分模块统计该院血液内科HDMTX应用现状。
2 结果
2.1 患者的基本信息及治疗方案
本研究共纳入19例 (31例次) 患者, 年龄12~69岁, 中位年龄40岁;男性患者14例 (占73.7%) 。HDMTX共使用31例次, MTX输注剂量范围为0.81~3.36 g/m2, 10例次 (占32.3%) 达到了原化疗方案要求的MTX剂量;18例次 (占58.1%) 采用24 h持续输注, 其中15例次使用了负荷剂量;另外, 10例次 (占32.3%) 采用3 h持续输注。患者的基本信息及治疗方案见表1。
表1 患者的基本信息及治疗方案
2.2 用药前评估
19例患者中, 12例 (占63.2%) 进行了基因检测。其中, 亚甲基四氢叶酸还原酶 (5, 10-methylenetetrahydrofolate reductase, MTHFR) 677及1298位点均为野生型的病例数为0;MTHFR 677野生型1例, 占8.3%;MTHFR 1298野生型8例, 占66.7%;ATP结合盒B亚家族成员1转运蛋白基因 (ATP-binding cassette subfamily B member 1, ABCB1) 3435 CC型3例, 占25.0%。所有化疗周期的患者均非胸腹水蓄积的病例;5例次 (占总例次数31例次的16.1%) 在化疗前或化疗期间使用了维生素C;所有患者在化疗前或化疗周期内均未使用磺胺类药物、非甾体抗炎药、环丙沙星、奥美拉唑或青霉素类抗菌药物。
2.3 碱化及水化
2.3.1 碱化:
所有化疗周期的患者都在化疗前和 (或) 化疗期间进了碱化处理;96.8% (30例次) 的化疗周期都持续碱化至MTX消除完毕。31例次患者中, 29例次 (占93.5%) 在化疗当日 (D1) 使用了静脉碳酸氢钠;21例次 (占67.7%) 在MTX给药前1日 (D0) 开始碱化。碱化合格的标准是D1及化疗期间尿液pH≥7.0, 在此标准下, 共15例次患者 (占48.4%) 在D1测定了pH, 达标11例次, 达标率为73.3%;D1后, 共2例次患者 (占6.5%) 出现尿液pH异常。
2.3.2 水化:
31例次患者中, 27例次 (占87.1%) 在化疗前和 (或) 化疗期间执行了医嘱记录出入量, D0记录出入量4例次 (占12.9%) 。水化合格的标准是D0至MTX清除完毕期间日入量应≥2.5 L/m2。对于未记录出入量的患者, 日入量按照其静脉入量+饮食摄入液体量2 L计算。12例次患者 (占38.7%) 在D1至MTX清除完毕期间水化量达标, 1例次患者 (占3.2%) 在D0水化量达标。
2.4 亚叶酸钙解救及漱口水使用情况
2.4.1 亚叶酸钙解救:
31例次患者在HDMTX给药后接受了亚叶酸钙解救;其中, 21例次 (占67.7%) 在给药后36 h内解救, 7例次 (占22.6%) 在给药后24 h内解救, 1例次 (占3.2%) 在给药后16 h内解救;30例次 (占96.8%) 起始时采用静脉亚叶酸钙解救;20例次 (占64.5%) 解救达标;28例次 (占90.3%) 持续至MTX消除完毕。
2.4.2 漱口水使用情况:
29例次患者 (占总例次数31例次的93.5%) 使用了漱口水预防和治疗口腔黏膜炎, 其中28例次 (占96.6%) 的漱口水配方中都使用了亚叶酸钙, 仅1例次 (占3.4%) 的漱口水中加入了粒细胞-巨噬细胞集落刺激因子。
2.5 TDM情况
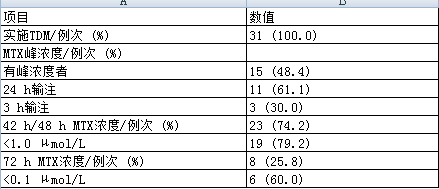
31例次使用HDMTX的患者都进行了TDM, 15例次患者 (占48.4%) 监测了MTX峰浓度;24 h输注患者峰浓度监测比例为61.1% (11/18) , 3 h为30.0% (3/10) ;24 h输注后的MTX中位峰浓度为25.26 μmol/L (9.20~38.72 μmol/L) , 3 h输注后的MTX中位峰浓度为260 μmol/L (260~298 μmol/L) , 见表2。需要说明的是, 23例次患者在开始给药后42或48 h进行了血药浓度监测, 其中19例次MTX血药浓度≤1 μmol/L, 由于另有1例次患者未测定42或48 h血药浓度, 而其60 h时MTX血药浓度>1 μmol/L, 故48 h时MTX血药浓度达标率为79.2% (19/24) ;8例次患者在开始给药后72 h进行了血药浓度监测, 其中4例次MTX血药浓度≤0.1 μmol/L, 由于另有2例次患者在42/48 h的MTX血药浓度就已≤0.1 μmol/L, 且未测定72 h血药浓度, 故72 h时MTX血药浓度达标率为60.0% (6/10) 。
表2 TDM情况
2.6 ADE发生情况
ADE发生情况见表3。
表3 ADE发生情况
注:“—”表示肝毒性及骨髓抑制指标不单一, 不同指标不能合并统计
Note:“—”means that indicators of hepatotoxicity and myleosuppression are not single, and different indicators cannot be combined for statistics.
3 讨论
大量研究结果表明, MTHFR 677基因突变与不良反应风险增加相关[9]。本研究中, 仅8.3%的患者MTHFR 677为野生型, 提示大部分患者存在突变, 临床应用HDMTX时需密切监测肝肾功能及口腔黏膜炎情况。
对于24 h持续输注, 推荐采取负荷剂量, 可以更快地达到稳态血药浓度以发挥效应[9]。本研究中, 24 h持续输注的患者中, 83.3% (15例次/18例次) 的患者使用了负荷剂量。由于给予负荷剂量在临床上较容易实现, 故后期应进一步提高24 h持续输注时负荷剂量的使用率。
本研究中, 在HDMTX给药前, 4项血常规指标均正常的患者占41.9%;5项肝功能指标均正常的患者占51.6%, 指标异常的患者均为轻度异常。HDMTX具有血液毒性和肝脏毒性[1], 应在血常规及肝功能指标正常后再进行给药。
酸性药物影响HDMTX的排泄[10], 故HDMTX应避免与该类药物合用。本研究中, 5例次患者在使用HDMTX过程中联合应用了注射用维生素C或水溶性维生素, 但未见联合应用其他影响HDMTX排泄的药物 (如质子泵抑制剂[11]、左乙拉西坦[12]及复方磺胺甲■唑[13]等) , 可能的原因是维生素C在化疗患者中使用广泛, 易被医护人员忽视。因此, 在使用HDMTX化疗期间应加强对于维生素C或水溶性维生素使用的关注。
本研究中, 所有的病例都进行了碱化且96.8%的患者持续至MTX消除完毕, 93.5%的患者在D1使用了静脉碳酸氢钠, 但仅67.7%的病例在D0使用了碳酸氢钠。尿液pH是判断碱化效果的指标, 但在给药前51.6%的患者未进行尿液pH检测, 进行检测的15例次患者中, 达标率为73.3%。可见, 在D0的碱化以及给药前尿液pH的测定等方面仍需要加强。本研究结果显示, 87.1%的患者进行了出入量的监测, 但仅38.7%的患者在化疗期间水化量达标, 仅1例患者在D0水化量达标。最终发生急性肾损伤的2例患者中, 1例患者在D0未进行水化, 另1例患者在D2—D3水化量不达标。故在HDMTX使用过程中, 应从D0开始加强水化并记录出入量。
本研究结果显示, 亚叶酸钙解救率达100%, 其中96.7%的患者起始采用静脉亚叶酸钙解救, 90.3%的患者在24~36 h内进行了解救, 但仅64.5%的患者解救剂量达标;漱口水使用率为93.5%, 其中90.3%的患者使用的漱口水中含亚叶酸钙, 但从D1即开始使用漱口水的患者仅占12.9%, 故应协助临床医师提高D1漱口水的医嘱开具率。
监测42/48 h及72 h MTX血药浓度的意义在于提示MTX是否清除完毕[1]。很多患者没有在上述时间点监测MTX血药浓度, 其原因在于上述时间点在非工作日, 无法及时监测MTX血药浓度。因此, 建议优化MTX给药时间, 确保能够及时获得MTX血药浓度数据。
4 结论
本研究结果提示, 血液内科临床药师在HDMTX使用过程的多个环节均应进行更多的主动干预, 如维生素C的联合应用、碱化时机、水化时机与水化量、尿液pH监测、出入量监测、漱口水使用时机及血药浓度监测等。
本研究收集了HIS系统中HDMTX相关患者数据, 但仍存在样本量较小的问题;部分指标获取存在困难, 如口腔黏膜炎、恶心及呕吐的常见不良反应事件评价标准分级缺乏数据支持;未针对不同干预措施对患者结局指标的影响进行统计和分析。未来应运用真实世界研究的方法, 收集更多患者的治疗信息, 并开展队列研究和病例对照研究, 为国内患者合理应用HDMTX提供更多的科学依据。
目前, HDMTX的规范使用在国内外没有定论, 尽管各医院均有相应的院内用药规范, 但外推性欠佳。因此, 为进一步规范HDMTX的临床合理应用, 确保HDMTX的疗效与安全性, 药师不仅应加强临床实践能力, 更应使用诸多方法进一步优化, 如针对该类用药复杂的医嘱制订医嘱模板, 甚至承担起药物相关临床指南制定的责任 (如本课题组已在中国药理学会TDM研究专业委员会牵头下制定HDMTX临床用药指南) , 将证据与临床实践有机结合, 最大程度改善患者的临床结局。
参考文献
[1] LaCasce AS.Therapeutic use and toxicity of high-dose methotrexate[DB/OL].Wolters Kluwer.2018.[2018-01-31] (2019-02-14) .https://www.uptodate.com/contents/therapeutic-use-and-toxicity-of-high-dose-methotrexate?search=Therapeutic%20use%20and%20toxicity%20of%20high-dose%20methotrexate&source=Out%20of%20date%20-%20zh-Hans&selectedTitle=1~68.
[2] 魏盈盈, 焦溦溦, 程思, 等.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的血药浓度与不良反应的相关性[J].中国医院药学杂志, 2014, 34 (22) :1915-1918.
[3] 贾锐.大剂量甲氨蝶呤治疗儿童白血病血药浓度与疗效的关系[J].当代医学, 2018, 24 (31) :161-162.
[4] Hegyi M, Arany A, Semsei AF, et al.Pharmacogenetic analysis of high-dose methotrexate treatment in children with osteosarcoma[J].Oncotarget, 2017, 8 (6) :9388-9398.
[5] Wang CP.Monitoring and Treatment of Acute Kidney Injury in Chil-dren with Acute Lymphoblastic Leukemia After High Dose Metho-trexate Chemotherapy[J].Iran J Pharm Res, 2016, 15 (4) :957-961.
[6] 张峻, 杨龙, 唐薇, 等.大剂量甲氨蝶呤在急性淋巴细胞白血病患儿中的群体药动学[J].中国医院药学杂志, 2007, 27 (8) :1061-1065.
[7] 汪洋, 张华年, 李思婵, 等.应用人工神经网络评估大剂量甲氨蝶呤化疗后的骨髓抑制[J].中国现代应用药学, 2017, 34 (6) :881-887.
[8] Mei S, Li X, Jiang X, et al.Population Pharmacokinetics of High-Dose Methotrexate in Patients With Primary Central Nervous System Lymphoma[J].J Pharm Sci, 2018, 107 (5) :1454-1460.
[9] Ettinger LJ, Chervinsky DS, Freeman AI, et al.Pharmacokinetics of methotrexate following intravenous and intraventricular administra-tion in acute lymphocytic leukemia and non-Hodgkin's lymph-oma[J].Cancer, 1982, 50 (9) :1676-1682.
[10] Hande KR, Balow JE, Drake JC, et al.Methotrexate and hemodialysis[J].Ann Intern Med, 1977, 87 (4) :495-496.
[11] Suzuki K, Doki K, Homma M, et al.Co-administration of proton pump inhibitors delays elimination of plasma methotrexate in high-dose methotrexate therapy[J].Br J Clin Pharmacol, 2009, 67 (1) :44-49.
[12] 曲艳凝, 江滨, 王宇航, 等.大剂量阿糖胞苷、甲氨蝶呤静脉滴注后药物浓度检测及相互作用研究[J].中华血液学杂志, 2012, 33 (12) :1049-1051.
[13] Thomas MH, Gutterman LA.Methotrexate toxicity in a patient rec-eiving trimethoprim-sulfamethoxazole[J].J Rheumatol, 1986, 13 (2) :440-441.
点击查看>>血液内科论文(优秀范文8篇)其他文章







