
微生态制剂是指运用微生态学原理,采用有益微生物或其代谢产物,经特殊加工工艺制成的类型不同的生物制剂[1]。水产用微生态制剂按照用途一般分为两类:一类用于养殖水质改良,主要包含光合细菌、硝化细菌、反硝化细菌、芽孢杆菌等微生物;一类用于养殖对象肠道微生物组成改良,主要包含乳酸菌、芽孢杆菌、酵母菌等益生菌或其代谢产物[2]。
淇河鲫(Carassius auratus in Qihe river),属鲤形目,鲤科,鲫属,自然分布于河南北部的淇河流域;淇河鲫胸鳍、尾鳍透明,背色浅褐,腹色银白,体宽背厚,俗称“双背鲫”;其以肉味鲜美、营养价值高而自古闻名;自20世纪80年代初,人们开始将淇河鲫移入池塘养殖,其经济和社会效益明显。本研究通过池塘泼洒EM菌及采用投喂添加酵母壁多糖的饲料养殖淇河鲫,旨在探索人工高密度养殖淇河鲫过程中,不同微生态制剂对淇河鲫生长和体成分的影 响,以 期 为 淇 河 鲫 的 健 康 养 殖 积 累 科 学资料。
1 材料与方法
1.1 试验材料
试验用鱼为自行培育的淇河鲫幼鱼;EM菌选用新乡市康大消毒剂有限公司生产的产品,产品液体状,主要含有乳酸菌、双歧杆菌、芽孢杆菌、酵母菌、光合细菌、硝化与反硝化菌等益生菌,有益菌群达6.0×109cfu/mL;酵母细胞壁多糖,粉状,由湖北安琪酵母有限公司提供,其中含β-葡聚糖20%~40%,甘露寡糖≥20%等。
1.2 试验饲料
试验用饲料有两种:一种是试验用基础饲料,编为Ⅰ号;另一种是在基础饲料配方的基础上添加4g/kg酵母细胞壁多糖,即酵母细胞壁多糖在饲料中的比例为0.4%,编为Ⅱ号。两种饲料分别经过充分混合后,制成粒径为3mm的硬颗粒饲料,干燥保存备用。
试验用基础饲料(Ⅰ号)的配方见表1。经测定,基础饲料的部分营养成分为:水分8.24%、粗蛋白31.80%、粗脂肪6.26%、粗灰分12.24%。【1】

1.3 试验过程与饲养管理
试验在新乡市金龙生态养殖有限公司养殖基地进行。选取约5000尾的淇河鲫幼鱼,统一暂养于室外水泥池,池子规格:7.2m×2.7m×1.5m,暂养期间水深70cm,投喂饲料为Ⅰ号饲料,投喂采用挂袋法,暂养时间为15d。
暂养结束后,选择体格健壮、规格一致的淇河鲫1200尾[平均规格:质量(3.38±0.13)g,体长(3.89±0.06)cm],随机分为4组,分别设为对照组、EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组,每组3个平行,每平行100尾试验鱼,分养于12个室外水泥池,水泥池规格3.6m×2.7m×1.5m。
对照组:试验期间养殖水体不泼洒EM菌;期间只投喂Ⅰ号饲料。
1mL/m3组:放养后第2d在养殖水体中泼洒一次EM菌,用量:
1mL/m3,15d后同样量再泼洒一次;期间只投喂Ⅰ号饲料。
4g/kg组:试验期间养殖水体不泼洒EM菌;期间只投喂Ⅱ号饲料。
1mL/m3+4g/kg组:放养后第2d在养殖水体中泼洒一次EM菌,用量:
1mL/m3,15d后同样量再泼洒一次;期间只投喂Ⅱ号饲料。
分组养殖共进行30d(2013年8月24日-9月23日);投喂采用挂袋法,每日9:00,按试验鱼体质量的8%投放饲料,翌日9:
00收集残饵,自然风干、称量质量,做好记录;养殖期间水深70cm;水温19~27℃,水体pH 7~8.5;氨氮≤0.15mg/L;亚硝酸盐氮≤0.012mg/L;溶氧量≥4mg/L。
分组养殖结束后,停食1d,分别取样测定生长指标及鱼体生化指标。
1.4 测定指标与方法
1.4.1生长性能指标测定养殖试验开始及结束时,停食1d,分别逐尾测量鱼体质量和体长。按下式计算生长率、饵料系数等。【2】
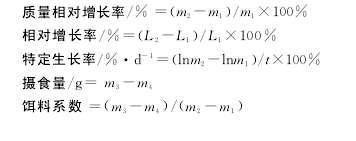
式中:
m1,淇河鲫初始质量 (g);m2,淇河鲫终末 质量(g)。
L1,淇河鲫初始体长(cm);L2,淇河鲫终末体长(cm)。
t,养殖天数(d)。
m3,总投料(g);m4,剩料(g)。
1.4.1体成分指标测定试验结束后,每平行取鱼30尾,每组计90尾;分别将鱼处死,去除内脏(在冰盘上操作),取鱼躯干部,剪碎、烘干,用于生化成分测定;每组样品各项指标均重复测定3次。各项生化指标分别按下列方法测定:水分:采用105℃恒温烘干失重法(GB/T 6435-2006)测定;粗蛋白:采用凯氏定氮法(GB/T 6432-1994)测定;粗脂肪:采用索氏抽提法(GB/T 6433-2006)测定;粗灰 分:采 用 马 福 炉 灼 烧 法 (GB/T 6438-2007)测定;氨基酸:采用Hetach L-8800氨基酸自动分析仪(GB/T 18246-2000)测定;脂肪 酸:采 用 重 量 法 (GB/T 17377-2008)测定。
1.5 数据分析与处理
试验数据用平均值±标准差表示,采用SPSS19.0软件对数据进行单因素方差分析,当差异显着(P<0.05)时,利用Duncan氏法进行多重比较。
2 方法
2.1 各试验组淇河鲫幼鱼摄食和生长情况
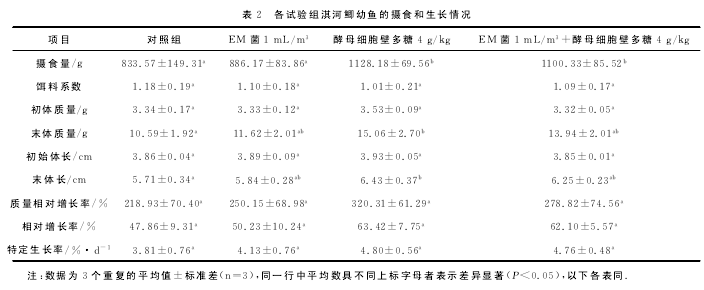
养殖试验进行30d后,各组淇河鲫幼鱼的摄食、生长情况见表2。
分析各组淇河鲫幼鱼的摄食、生长结果可见,与对照组相比,EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组淇河鲫幼鱼的摄食量均高于对照组,但EM菌1mL/m3组与对照组差异未达显着水平(P>0.05),而酵母细胞壁多糖4g/kg组和EM菌1mL/13+酵母细胞壁多糖4g/kg组则显着高于对照组(P<0.05)。与对照组相比,EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组淇河鲫幼鱼的饵料系数均低 于 对 照 组,但 差 异 均 未 达 显 着 水 平 (P>0.05)。与对照组相比,淇河鲫幼鱼的终末体质量和终末体长,EM菌1mL/m3组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组虽高于对照组,但差异不显着(P>0.05),酵母细胞壁多糖4g/kg组则显着增加(P<0.05)。与对照组相比,各组的质量增加率、增长率和特定生长率均呈现酵母细胞壁多糖4g/kg组>EM菌1mL/m3+酵母细胞壁多糖4g/kg组>EM菌1mL/m3组>
对照组的趋势,但各处理组与对照组均差异不显着(P>0.05)。【3】
2.2 各试验组淇河鲫幼鱼的体成分分析
2.2.1各试验组淇河鲫幼鱼常规体成分分析
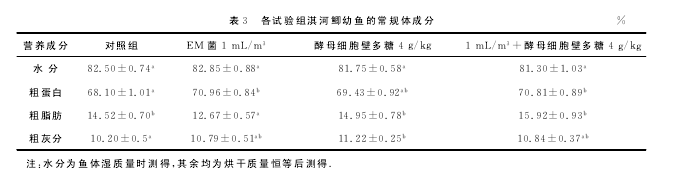
养殖试验进行30d后,各组淇河鲫幼鱼常规体成分分析结果见表3。
分析各组淇河鲫幼鱼常规体成分结果可见,与对照组相比,EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组淇河鲫幼鱼体成分的水分含量与对照组差异不显着(P>0.05)。与对照组相比,EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组淇河鲫幼鱼体成分的粗蛋白含量均高于对照组,但酵母细胞壁多糖4g/kg组与对照组差异不显着(P>0.05),而EM菌1mL/m3组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组则显着高于对照组(P<0.05)。与对照组相比,淇河鲫幼鱼体成分的粗脂肪含量,EM菌1mL/m3组显着低于对照组(P<0.05),而酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组则与对照组差异不显着(P>0.05)。
与对照组相比,淇河鲫幼鱼体成分的粗灰分含量,酵母细胞壁多糖4g/kg组显着高于对照组(P<0.05),EM菌1mL/m3组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组则与对照组差异不显着(P>0.05)。【4】
2.2.2各试验组淇河鲫幼鱼氨基酸组成
养殖试验进行30d后,各组淇河鲫幼鱼体成分氨基酸分析结果见表4。
对结果分析可见,与对照组相比,各单一氨基酸含量,EM菌1mL/m3组中谷氨酸、甘氨酸、丙氨酸、亮氨酸、赖氨酸显着高于对照组(P<0.05);酵母细胞壁多糖4g/kg组中甘氨酸、赖氨酸、精氨酸、脯氨酸显着高于对照组(P<0.05);EM菌1mL/m3+酵母细胞壁多糖4g/kg组中谷氨酸、甘氨酸、丙氨酸、亮氨酸、赖氨酸,组氨酸、精氨酸、脯氨酸显着高于对照组(P<0.05)。与对照组相比,呈味氨基酸、必需氨基酸和总氨基酸,EM菌1mL/m3组、酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组均显着高于对照组(P<0.05)。
2.2.3各试验组淇河鲫幼鱼部分脂肪酸的组成养殖试验进行30d后,各组淇河鲫幼鱼体成分部分脂肪酸的组成见表5。
试验测定了淇河鲫幼鱼体成分中的9种脂肪酸含量,其中饱和脂肪酸2种:棕榈酸即十六酸,硬脂酸即十八酸;单不饱和脂肪酸2种:油酸(十八碳烯酸)和二十碳一烯酸;n-6系列高不饱和脂肪酸2种:亚油酸和花生四烯酸;n-3系列高不饱和脂肪酸3种:亚麻酸、二十碳五烯酸和二十二碳六烯酸。
与对照组相比,EM菌1mL/m3组组淇河鲫幼鱼肌肉中花生四烯酸和二十二碳六烯酸的含量显着提高(P<0.05),酵母细胞壁多糖4g/kg组和EM菌1mL/m3+酵母细胞壁多糖4g/kg组淇河鲫幼鱼肌肉中各种脂肪酸含量均与对照组无显着性差异(P>0.05)
3 讨论
3.1 微生态制剂对养殖鱼类摄食和生长的影响
黄永春等[3]曾将EM菌作为饲料添加剂,加工饲料养殖建鲤(Cyprinus carpio var.Jian),试验显示,随着EM菌添加量(2%,4%,6%)的增加,建鲤质量增 长 率 分 别 比 对 照 组 提 高0.6%,9.2%和16.0%,而饵料系数却分别 降低1.3%,7.4%和22.9%。伍莉等[4]将EM菌添加到饲料中,也具有促进鲫鱼(Carassius auratus)生长的作用。
林东年等[5]将EM菌泼洒于饲养尼罗罗非鱼(Oreochromis niloticus)的土池中,改善了水质条件,显着提高了尼罗罗非鱼的质量增长率。本试验将EM菌泼洒于养殖淇河鲫幼鱼的水泥池中,通过30d的饲养,淇河鲫幼鱼的质量增加率、增长率分别提高31.22%和2.37%,而饲养淇河鲫幼鱼的饵料系数却下降6.78%。分析认为益生菌能提高水产动物的生长性能可能与其分解有机质、改善养殖环境,提供营养物质[6-7]及菌体分泌一些活性物质提高饲料利用率有关[8-9]。
Whittington等[10]认为β-葡聚糖等活性物质具有提高鱼类饲料利用率的作用。鱼类主要靠嗅觉和味觉觅食,其嗅囊上皮能接受水体中挥发性物质的刺激,味蕾可感受饲料中溶出的化学成分。本试验中也观察到投喂饲料中添加酵母细胞壁多糖的试验组,淇河鲫抢食迅速,食欲旺盛,表明酵母细胞壁多糖具有一定的诱食作用,且投喂饲料中添加酵母细胞壁多糖的试验组,鱼类的摄食量明显增加,也印证了相关推论。
3.2 微生态制剂对养殖鱼类体成分的影响
Abdel-Tawwab等[11]在罗非鱼饲料中添加1.0%~5.0%酵母菌,全鱼粗蛋白和灰分含量显着升高;Ghosh等[12]在观赏鱼类饲料中添加枯草芽孢杆菌(Bacillus subtilis),其鱼体粗蛋白和灰分呈升高趋势;王朝瑾等[13]在鲫鱼饲料中添加混合益生菌,鱼体蛋白质呈升高趋势,粗灰分显着升高,粗脂肪则显着降低。艾炎军等[2]将芽孢杆菌、光合细菌、EM菌以不同比例混合加入养殖水体,饲养泥鳅(Mis-gurnus anguillicaudatus)32d,鱼体粗蛋白含量显着升高,粗脂肪和粗灰分含量显着降低;本试验添加酵母细胞壁多糖组的鱼体粗灰分显示,其含量显着高于对照组。可见微生态制剂对养殖鱼类体成分的影响,明显与试验采用的微生态制剂类别、试验对象及其添加方式等密切相关。
氨基酸组成是反映蛋白质质量的一个重要指标,淡水鱼类的营养价值取决于肌肉的蛋白质含量,而蛋白质是由许多氨基酸组成的,氨基酸特别是必需氨基酸的组成和含量决定蛋白质的品质[14]。
本试验中各试验组总氨基酸含量、必需氨基酸含量均显着高于对照组,说明使用微生态制剂可以改善肌肉品质。肌肉中的天冬氨酸、谷氨酸、甘氨酸、丙氨酸均为呈味氨基酸,其组成和含量在一定程度上决定肌肉的鲜味和可口程度[15]。试验组中使用微生态制剂的各组淇河鲫其呈味氨基酸的含量均高于对照组,表明微生态制剂的使用对改善淇河鲫的品味具有一定的作用。
养殖鱼体中脂肪酸组成及含量取决于其所摄取的脂肪水平与脂肪酸组成[16],大多动物体内能够合成饱和脂肪酸和单不饱和脂肪酸,一般鱼体本身只能合成n-7、n-9系列不饱和脂肪酸,而不能合成n-3、n-6系列不饱和脂肪酸,因此,n-3、n-6系列不饱和脂肪酸被认为是鱼类的必需脂肪酸[17]。
本试验泼洒EM菌组淇河鲫体成分中的花生四烯酸、二十二碳六烯酸含量显着提高,而其他两组淇河鲫体成分中的各种脂肪酸含量和对照组无显着性差异,表明微生态制剂整体对饲养对象体成分中脂肪酸的影响不明显,而单独泼洒EM菌所引起养殖鱼类脂肪酸明显升高的原因,则有待深入探明。
养殖水体中泼洒EM菌,或在饲料中添加酵母细胞壁多糖,均能促进淇河鲫幼鱼的摄食、生长,改善幼鱼的肌肉品质,但其对养殖鱼类的影响,与微生态制剂的使用方法密切相关。试验认为饲料中添加酵母细胞壁多糖4g/kg,对促进淇河鲫幼鱼摄食和自身质量的增加作用明显;结合试验中的饲养成本分析,饲料中添加酵母细胞壁多糖4g/kg,成本增加远低于因添加微生态制剂降低饲料系数所节约的饲料投入。但对饲料中添加酵母细胞壁多糖的科学用量仍有待进一步研究。
参考文献:
[1] 何清明.动物微生态学 [M].北京:农业出版社,1994.
[2] 艾炎军,邹叶茂,汤文浩,等.微生态制剂对泥鳅生长性能、体 成 分 和 免 疫 活 性 的 影 响 [J].淡 水 渔 业,2013,43(1):82-84.
[3] 黄永春,王胜伦,黄志明,等.有效微生物制剂(EM)对建鲤生长和水质变化的影响 [J].集美大学学报,1999,4(1):41-46.





