
肝脏是鱼体内最大的实质性器官,其功能很强大,对来自体内外的许多非营养性物质,如各种药物、毒物以及体内某些代谢产物等有生物转化作用[1],具有很好的解毒功能和代谢功能,因此,肝脏更容易受到外环境、病毒、细菌等因素的影响。目前,随着集约化养殖的不断发展,难免会出现对鱼类日常管理的疏忽,如强化投饲和乱用药物,饲喂霉变饲料等[2],而这些因素会对鱼类肝脏造成比较严重的损害,出现以肝胆综合症为主要特征的鱼类疾病,即所谓的鱼类肝病( Theliver disease of fishes)[3]。关于本病,并没有有效地治疗药物,死亡率较高,且治疗主要是以西药为主,而西药容易出现药物残留等问题,会间接影响鱼的品质,进而影响到人类的健康,因此研究开发出绿色环保的中成药就显得迫在眉睫。
近年来,由于中草药具有绿色无污染、毒副作用小,以及能够提高机体的免疫和防御功能等特点[4],现已广泛的应用于水产动物的病害防治及健康养殖中[5 -6]。枸杞( Lycium chinense Mill-er) 为茄科枸杞属 ( Lycium Linn. ) 植物,含有多糖、粗蛋白、亚油酸等多种营养成分,而枸杞多糖( Lycium barbarum polysaccharide,LBP) 为枸杞中的主要活性成分之一[7]。现代药理研究表明,枸杞多糖具有护肝、保护生殖系统、降血脂、降血糖、免疫调节等多种功能[8 -11]。目前,关于枸杞多糖的研究报道主要有: 王远吉[12]研究发现,枸杞多糖可以提高鲫鱼血清溶菌酶活力,且与枸杞多糖呈浓度依赖性关系。宋毅等[13]研究发现,枸杞多糖可以增强机体非特异性免疫功能。然而,水产领域有关枸杞多糖的保肝作用却鲜有报道。
四氯化碳( CCl4) 作为一个评价天然药物保肝作用的肝毒性模型药物,已广泛应用于科学研究当中。本研究以化学药物 CCl4来进行造模,通过测定一些肝功能生化指标的变化来评价枸杞多糖对建鲤急性肝损伤的保护作用,为枸杞多糖在水产肝胆疾病的防治提供理论依据。
1 材料与方法
1. 1 材料
1. 1. 1 供试鱼
建鲤来自于中国水产科学院淡水渔业研究中心渔场,体质健康,6 月龄,大小规格基本一致,150 g 左右,饲养于循环水系统中,25oC,商品饲料( 40% 粗蛋白、10% 粗脂肪、10% 灰分、能量 21KJ·g- 1DM) 饲喂一周,每天投喂 2 次。
1. 1. 2 药品和试剂
枸杞多糖( Lycium barbarum polysaccharide,LBP) 购自南通四海植物提取有限公司。谷丙转氨酶( GPT) 、谷草转氨酶( GOT) 、乳酸脱氢酶( LDH) 、超氧化物岐化酶( SOD) 、过氧化氢酶( CAT) 、谷胱甘肽过氧化物酶( GSH-Px) 、丙二醛( MDA) 、白蛋白( Alb) 、谷胱甘肽( GSH) 及总抗氧化能力( T-AOC) 等试剂盒购自于南京建成生物工程研究所科技有限公司; 总蛋白( TP) 测定试剂盒购自于碧云天生物技术研究所。CCl4( 分析纯) 购于国药集团化学试剂有限公司。
1. 2 方法
1. 2. 1 枸杞多糖的提纯
枸杞多糖通过经典的水煮醇沉方法[14 -15]分离提纯: 取 300 g 粗枸杞多糖室温下浸润于 1 000mL 超纯水中过夜处理,然后加热煎煮 2 h 用定性滤纸过滤除去不溶杂质,上清液进行离心( 500 g,10 min) ,再用 0. 22 μm 的过滤器进行过滤,将上清液收集起来,用乙醇进行 3 次沉淀。
其间有絮状沉淀产生,静置 1 h,将静置后固形物依次以 95%乙醇、无水乙醇、丙酮洗涤除杂,待絮状沉淀分离出来后,转速 2 500 r·min- 1,离心时间 3 min,95%乙醇洗涤沉淀 3 次,在温度为80oC 的烘箱中烘干。
1. 2. 2 分组及处理
将循环水系统内饲养 1 周的建鲤随机分为 6组,分别设为空白对照组( CK) 、模型组( CCl4) 、枸杞多糖药物对照组( LBP CK) 、处理组( 枸杞多糖 0. 1,0. 5,1. 0 g·kg- 1组) ,其中 CK 组及 CCl4模型组: 饲喂普通商品饲料; 枸杞多糖药物对照组( LBP CK) : 饲喂含 1. 0 g·kg- 1枸杞多糖的饲料; 处理组: 分别饲喂含0. 1,0. 5,1. 0 g·kg- 1枸杞多糖的饲料。每天投喂 2 次,每次投喂量为试验鱼质量的 2%。饲喂 60 d 后,Ctrl 组及 LBP Ctrl组腹腔注射橄榄油,CCl4组及加药处理组经腹腔注射含 30% CCl4的橄榄油,每 10 g 鱼注射 0. 05mL,注射 72 h 后采肝组织及血样。
1. 2. 3 样品处理
( 1) 制备血清。所有试验鱼经尾部静脉采血后,血样于 5 000 r·min- 1离心 5 min,收集血清,- 20℃ 储藏备用,测定 TP、GOT、GPT、LDH、Alb等生化指标。
( 2) 制备肝组织匀浆。采血后试验鱼解剖取肝,置于预冷生理盐水中漂洗,滤纸拭干后按肝重∶ 生理盐水体积 =1∶ 9 的比例加入生理盐水后匀浆研磨,3 000 r·min- 1离心 10 min,收集上清,- 20℃ 储藏备用,测定 GSH、SOD、CAT、GSH-Px、T-AOC 及 MDA 等生化指标。
1. 2. 4 数据分析
试验数据采用平均值 ± 标准误差表示,采用SPSS 19. 0 软件包中的 One-way-ANOVA( 单因素方差分析) 进行分析处理。P < 0. 05 为显着差异; P <0. 01 为极显着差异。
2 结果与分析
2. 1 枸杞多 糖对 CCl4致建鲤肝损伤血清中GPT、GOT 及 LDH 的影响
如图 1 所示,建鲤经 CCl4作用后,血清内GPT、GOT 及 LDH 含量显着比空白对照组高 ( P< 0. 01) 。饲喂含三种不同浓度枸杞多糖饲料后,GPT、GOT 及 LDH 含量较 CCl4组降低,枸杞多糖 0. 1 g·kg- 1组作用不明显,0. 5 g·kg- 1组可显着抑制 GPT 酶活性,但对 LDH 及 GOT 活性降低没有显着作用; 枸杞多糖 1. 0 g·kg- 1对三种酶活性的降低都有显着作用,分别降低为 CCl4组的73. 4% ,65. 89% ,63. 13% 。 枸 杞 多 糖 对 GPT、GOT 及 LDH 酶活性的抑制作用呈现浓度依赖性,随着浓度的加大,呈现降低趋势。
2. 2 枸杞多糖对 CCl4致建鲤肝损伤血清中 Alb和 TP 的影响【1】
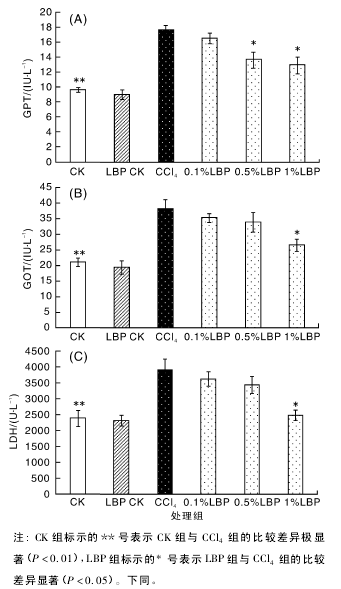
由图 2 可以看出,与空白对照组相比,血清中 TP 及 Alb 的含量因 CCl4的作用而显着降低( P <0. 05) ,饲喂 3 种不同浓度含枸杞多糖饲料后,TP 和 Alb 含量的降低趋势被抑制,且 TP 有随着药物浓度增加,含量呈现升高趋势。在图 2-A中,与 CCl4组相比,枸杞多糖 1. 0 g·kg- 1组,TP的降低趋势被明显的抑制( P < 0. 05) ,在图 2-B中,枸杞多糖 0. 5 g·kg- 1组对 Alb 的减少有显着抑制作用。【2】
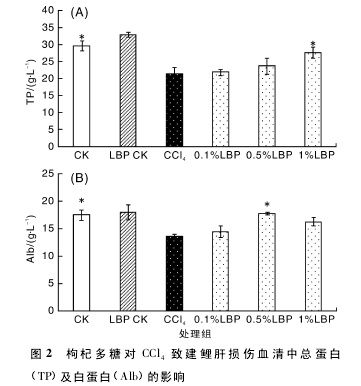
2. 3 枸杞多糖对 CCl4致建鲤肝损伤组织匀浆上清中 SOD、GSH-Px、MDA、GSH 的影响
如图 3-A,B 所示,与空白对照组相比,CCl4组抗氧化酶( GSH-Px、SOD) 含量显着降低( P <0. 05) 。饲喂含不同浓度枸杞多糖饲料后,这些抗氧化指标降低的趋势得到抑制,其中枸杞多糖三个浓度组对 SOD 的降低有显着的抑制作用,枸杞多糖 1. 0 g·kg- 1组对 GSH-Px 提高有显着作用。同时,枸杞多糖药物对照组与空白对照组相比,SOD 的活力显着提高。
如图 3-C,D 所示,与空白对照组相比,用CCl4-植物油腹腔注射建鲤 72 h 后,CCl4的损伤作用使得肝细胞受损,导致 MDA 大量的生成。【3】
饲喂含枸杞多糖的饲料后,MDA 的释放量得到有效的抑制。与 CCl4组相比,枸杞多糖 1. 0 g·kg- 1组对 MDA 的抑制作用显着( P <0. 05) 。肝组织受损也引起了 GSH 含量的显着降低。饲喂含枸杞多糖饲料后,GSH 的降低趋势被抑制,其中 1 g·kg- 1组对 GSH 含量的提高有显着作用( P <0. 05) 。
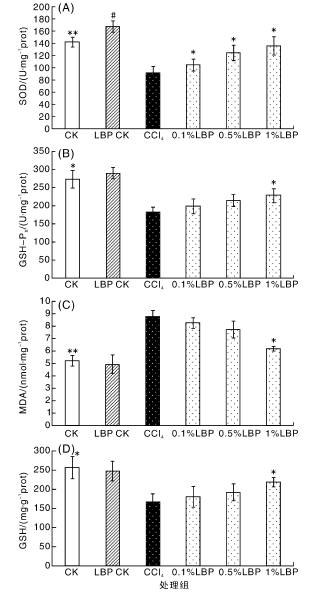
2. 4 枸杞多糖对 CCl4致建鲤肝损伤组织匀浆上清中 CAT 及 T-AOC 的影响
如图 4-A,B 所示,与空白对照组相比,CCl4作用后使得肝组织匀浆上清中 CAT 及 T-AOC 的含量显着降低。饲喂含枸杞多糖饲料后,这些指标的含量得到了不同程度的提高。其中,0. 5 g·kg- 1枸杞多糖对 CAT 及 T-AOC 均有显着的提高作用( P < 0. 05) ,1. 0 g·kg- 1组显着提高了 T-AOC 的含量( P < 0. 05) 。【4】
3 讨论
利用 CCl4来制备肝组织损伤模型是一种比较经典的损伤模型,常被用来筛选保肝药物。其造模机理主要是 CCl4进入机体内经细胞色素P450 酶进行代谢,产生三氯甲基自由基(·CCl3) ,三氯甲基自由基与氧反应生成氯甲基过氧化氢自由基(·CCl3O2) 等氧活性产物[13],这些自由基通过攻击生物膜脂发生不可逆共价结合,导致脂质过氧化反应和氧化应激,从而破坏细胞的膜结构[16 -19],造成了肝组织( 细胞) 的损伤与死亡。
肝脏是物质和能量代谢的重要器官,富含大量的代谢酶,具有解毒、代谢等功能,一旦机体受到损伤或药物等外界刺激,肝脏内相关指标就会发生一系列变化。LDH、GPT、GOT 作为评价CCl4致肝损伤的标志性指标,可评价 CCl4诱导的肝毒性及枸杞多糖的保肝作用[20]。由图 1 知,经 CCl4作用后血清内的 LDH、GPT、GOT 含量明显增加,枸杞多糖 1% 浓度组抑制了其含量的增加。表明枸杞多糖能显着抑制化学毒物引起的建鲤肝损伤。类似的结果在小鼠的肝损伤保护中也有报道,Daye Cheng 等[21]曾在枸杞多糖对酒精致小鼠氧化应激的影响研究中认为,枸杞多糖对酒精致肝损伤引起的 LDH 及转氨酶含量的增加有明显的抑制作用。这种抑制作用可能与枸杞多糖促进微粒体膜的活性,减少胞浆内转氨酶外渗,从而维持肝微粒体功能,保证细胞结构的完整性有关[22]。
建鲤肝组织经 CCl4作用后,TP、Alb 的含量出现明显下降,但用枸杞多糖饲喂的建鲤,这种降低被明显地抑制。邢雁霞等[23]也有相关类似的报道,枸杞多糖可以升高小鼠血清内 CCl4引起的蛋白含量降低。这种保护作用可能与枸杞多糖可以修复细胞内质网损伤,促进核糖体合成蛋白有关。
MDA 是膜脂质过氧化的重要产物,其含量高低是检测脂质过氧化的重要指标[24]。CCl4作用使得肝细胞受损,释放出大量 MDA。饲喂含枸杞多糖饲料后,MDA 含量明显减少,说明枸杞多糖可以减少 MDA 释放量,提高抗脂质过氧化的能力。甘璐等[22]也曾报道,枸杞多糖可显着提高荷瘤鼠免疫细胞的活力及降低脂质过氧化值。
这可能与枸杞多糖可以增强生物膜脂质的生物活性,降低自由基对细胞的亲脂攻击有关。
GSH 是一种低分子清除剂,在肝脏的生化代谢中发挥重要的作用,对自由基具有较强的清除作用,保护肝细胞功能正常。机体受到氧化损伤时,GSH 不断消耗,以致自由基不能及时被清除,形成自由基的损伤[25]。由图 3 数据显示,枸杞多糖显着的抑制了肝损伤造成的 GSH 含量的降低。
在对小鼠的研究中发现,枸杞多糖可以有效的抑制镉致大鼠肝氧化性损伤中 GSH 的降低[26],这可能与 GSH 通过与 GSH-Px 共同作用,从而抑制脂质过氧化的发展,来阻断新自由基的产生有关。
SOD、CAT、GSH-Px 存在于所有的氧化代谢细胞内,作为自由基清除系统可防止自由基对细胞的损害并且对损害的细胞进行修复[22]。由图3 和图 4 数据显示,枸杞多糖显着提高了这些抗氧化酶的活性。在小鼠体内试验表明,枸杞多糖可通过一系列的生理生化机制,活化机体抗氧化酶,提高机体的抗氧化能力,从而保护细胞免受自由基攻击。T-AOC 是反应机体抵御自由基攻击,抗氧化能力强弱的关键指标[27]。饲喂含枸杞多糖饲料后,总抗氧化能力显着提高。这可能是枸杞多糖可以修复受损内质网,加速蛋白的合成,促进抗氧化酶的活化或合成,从而消除自由基,保护肝细胞。
体内试验探究枸杞多糖对 CCl4致肝损伤的影响结果显示,枸杞多糖 0. 5 g·kg- 1,1 g·kg- 1浓度组对 CCl4致建鲤肝损伤都有一定的保护效果,1 g·kg- 1枸杞多糖保护效果最好,且呈剂量依赖性。由本试验推测,枸杞多糖对建鲤肝( 细胞) 保护作用与其提高抗氧化酶活性,促进蛋白合成,抑制转氨酶、LDH 活性及 MDA 的生成,降低膜的脂质过氧化等有关。





