
0、 引言
【研究意义】凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾,是迄今世界养殖产量最高的优良虾种,因其具有壳薄体肥、肉质鲜嫩、生长迅速、群体生长均匀、抗病力强等优点,深受国内外市场的青睐(林琼武等,2006;Aloise et al.,2011;彭金霞等,2013)。
开展繁殖生物学研究、完善苗种培育技术及制定人工育苗标准化操作规范,是实现凡纳滨对虾人工规模化繁育的有效途径;而确立不同温度下受精卵第一、第二极体释放时间,是开展凡纳滨对虾雌核发育诱导及后续细胞工程育种研究的重要基础。因此,有必要深入开展凡纳滨对虾的胚胎发育生物学研究。【前人研究进展】随着国内外对虾增养殖业的迅猛发展,以提升养殖产量和品质为主要目标的染色体组工程已成为对虾育种研究的重点领域(Garnica-Rivera et al.,2004;Sellars et al.,2010;Aloise et al.,2011)。目前,有关对虾胚胎及幼体发育的研究集中在形态描述(García-guerrero and Hendrickx,2009;栗治国等,2013),且发现水温变化是对虾繁殖和生长发育的关键因素(彭昌迪等,2002),在生长、存活、生理生化和能量代谢等方面均已得到证实(Chen andLai,1993;Wyban et al.,1995;Kumlu et al.,1995;李庭古等,2006)。国内已有学者对红螯螯虾、凡纳滨对虾、克氏原螯虾和脊尾白虾等的胚胎发育过程进行了观察和描述(孟凡丽等,2000;彭昌迪等,2002;吕建林等,2006;栗治国等,2013);国外学者则主要针对罗氏沼虾和长臂虾科4种对虾的胚胎发育进程及发育形态特征进行观察(Müller et al.,2004;García-guerrero andHendrickx,2009)。有关对虾雌核发育的研究国内外鲜见报道,仅见国内学者在20世纪90年代进行了一些试验性尝试(戴继勋等,1993;蔡难儿等,1995;陈本楠等,1997),但至今未获得对虾雌核发育诱导技术的突破。【本研究切入点】凡纳滨对虾卵子染色体加倍是雌核发育诱导的两大技术之一,而受精卵极体释放时间又是染色体加倍成功与否的关键,目前在国外虽有相关研究报道(Garnica-Rivera et al.,2004;Aloiseet al.,2011),但因品种和环境条件差异而尚无定论。【拟解决的关键问题】以广西水产科学研究院选育获得并拥有自主知识产权的国审水产新品种(登记号GS-01-001-2012)———凡纳滨对虾“桂海1号”为研究对象,对该品种不同温度下受精卵发育时序进行观察,旨在了解凡纳滨对虾胚胎发育的时序及特征,尤其是第一极体和第二极体排出的时间点,为其雌核发育诱导中染色体加倍最佳操作窗口的确定及人工苗种生产提供参考依据。
1、 材料与方法
1. 1 亲本来源及孵化用水处理
雌雄亲虾为广西水产科学研究院国家级SPF南美白对虾良种场车间内人工培育至性腺成熟的桂海1号,其中,雌虾体重60.47±1.79 g,体长20.27±0.64 cm;雄虾体重44.13±2.02 g,体长18.00±0.53 cm。自然海水经暗沉淀、砂滤,双层棉滤袋过滤两次后再用滤器过滤3次,并以甲醛和优乐碘分别杀菌,EDTA钠盐螯合重金属离子(彭昌迪等,2002)。
1. 2 胚胎发育观察
从雌虾池中挑选已成功交配贴荚的雌虾(背部暗红色性腺线条连续且清晰),置于500 L的玻璃圆桶内待产卵,水温控制在(30.0±0.5)℃,盐度28.6‰,避光,不充气,产卵后移走亲虾,并及时采集受精卵进行连续显微观察。具体操作:先在直径4 cm的细胞培养级平皿中用微吸管或枪头吸取1滴经净化消毒灭菌的海水(20.0 μL),保持液滴在平皿中不扩散,呈球形液滴,然后吸取细胞培养级矿物油将该海水液滴完全覆盖,使海水液滴完全包裹于矿物油中,防止挥发扩散。在解剖镜或光学显微镜下,用玻璃毛细管小心挑选吸出3枚正常的受精卵,将其小心移入海水液滴中,随后调整物镜,并设置拍照时间进行连续拍照,中途无需添加海水,但需定时观察确认显微镜物镜镜头是否正位,如移位则进行微调(孟凡丽等,2000)。
1. 3 不同水温下的受精卵孵化试验
将成功交配的雌虾每尾单独置于室内500 L的玻璃圆桶内,水温控制在(30.0±0.5)℃,促其产卵,试验用水为净化处理的洁净海水,盐度26.0‰~29.0‰,pH 8.1~8.5。当观察到雌虾产卵后,从桶内随机收集50枚受精卵,分别转入以水浴控温在28.0、29.0、29.5、30.0和30.5 ℃的500 mL玻璃烧杯中孵化,每个温度梯度重复3次。期间定时轻轻搅动水体,使卵子均匀悬浮分布,观察不同水温梯度受精卵的孵化情况(彭昌迪等,2002;林琼武等,2006)。
1. 4 统计分析
以Excel 2003和SPSS 17.0软件处理试验数据,并采用Duncan’s单因素方差分析法进行显著性分析。
2、 结果与分析
2. 1 凡纳滨对虾胚胎发育时序及形态特征
凡纳滨对虾受精卵在水温30.5 ℃、盐度28.6‰的条件下,经过11.5~11.8 h完成孵化,幼体陆续破膜而出,其胚胎发育过程详见表1。凡纳滨对虾的发育属于直接发育类型,体外受精,体外发育,整个胚胎发育都在卵膜内进行。根据胚胎发育的形态特征变化,可分为7个阶段:受精卵期、卵裂期、囊胚期、原肠期、肢芽期、膜内无节幼体期和出膜幼体期。
(1)受精卵期:成熟卵子为橙黄色,呈发散状从生殖孔排出,产出瞬间为游离态,但粘性很大,接触海水不久便聚集成团,且具沉性;卵子发生皮层反应,皮层中的周边体向外扩散,卵子逐渐由不规则变为圆形。周边体完全溶解消失后,围卵膜开始突起,瞬间卵子完成第一次成熟分裂,排出第一极体;随同围卵膜举起,1 min后即完成第二次成熟分裂而排出第二极体。
(2)卵裂期:卵子受精后的卵裂方式为完全卵裂,且有螺旋型卵裂的卵子在受精1.0~2.0 h就开始卵裂,先由1个细胞分裂成两个细胞,再由两个细胞分裂成4个细胞,以后按几何级数递增。
(3)囊胚期:当胚胎发育至32-细胞时,呈圆球形囊胚,植物极的分裂比动物极慢。
(4)原肠期:以内陷方式形成原肠,至64-细胞末期,两个内胚层母细胞内陷入囊胚中,不久中胚层细胞也出现在囊胚腔中。至128-细胞期 内陷更明显,背唇外作用最快,胚孔近似三角形,在受精后10.0 h左右形成原肠,胚孔闭合。
(5)肢芽期:胚胎依次出现第二触角原基、大颚原基及第一触角原基,此时的胚胎可观察到3对原基隆起。
(6)膜内无节幼体期:肢芽分化出内外肢,肢端生出刚毛,胚体前端腹面中央出现红色眼点,胚体在卵膜内逐渐转动,不久幼体破膜孵出。
(7)出膜幼体期:历时11.5~11.8 h,在胚体后期发育中卵黄大量损耗,卵黄囊大幅度缩小,孵化时大部分卵黄被吸收;幼体在膜内急剧运动,以身体附生刺和刚毛刺破卵膜,尾部在卵膜最薄处破膜而出,甩掉卵膜进入水中,成为自由生活的无节幼体。出膜后的幼体还含有卵黄囊,出膜32.0 h后幼体开始开口摄食。

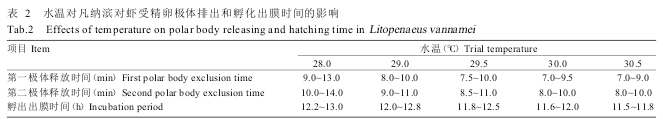
2. 2 不同温度下凡纳滨对虾的胚胎发育进程
由表2可知,水温变化对受精卵极体的排出和孵化时间有明显影响,水温为28.0~30.5 ℃时,受精卵的发育速度随水温升高而变快,当水温由28.0 ℃上升至30.5 ℃时,孵化时间从13.0 h缩短至11.5 h,即水温每升高1.0 ℃,孵化时间就缩短0.6 h。水温为28.0~30.5 ℃时,凡纳滨对虾受精卵第一极体释放时间为7.0~13.0min,第二极体释放时间为8.0~14.0 min。
试验过程中重点对29.5和30.5 ℃水温下凡纳滨对虾受精卵极体排出和第一次卵裂进行观察,结果发现,在30.5 ℃水温下凡纳滨对虾受精卵第一次成熟减数分裂(释放第一极体)的时间为7.0~9.0 min,第二次成熟减数分裂(释放第二极体)的时间为8.0~10.0 min,第一次卵裂(有丝分裂)的时间为20.0~23.0 min,而在29.5 ℃下各发育阶段的时间略有延迟。
2. 3 发育异常受精卵的形态观察
本研究过程中可观察到部分异常的受精卵(图2-1)及停滞发育于多细胞期(图2-2)、肢芽期(图2-3)或膜内幼体期的受精卵(图2-4),还发现有未受精卵发生皮层反应后发生卵裂行为,但形成的分裂球大小不等、形状各异,即不均等分裂的未受精卵(图2-5)和停滞发育于原肠胚期的未受精卵(图2-6)。一般情况下,受精卵是进行正常的完全均等卵裂行为,分裂球界限分明,而未受精卵通常在完成第二次卵裂后即停止发育,且分裂球界限模糊不清。

3、 讨论
彭昌迪等(2002)以人工培育成熟的凡纳滨对虾为材料,观察并描述胚胎发育过程,发现在水温29.5 ℃、盐度28‰的条件下,从其卵子产出受精至孵化过程可分为卵裂、原肠胚、肢芽期和膜内幼体等4个阶段,整个胚胎发育过程需12 h左右。本研究观察发现,凡纳滨对虾的受精卵呈豆绿色,直径0.28~0.30 mm,其发育属于直接发育类型,体外受精,体外发育,整个胚胎发育都在卵膜内进行;根据胚胎发育的形态特征变化(孟凡丽等,2000;吕建林等,2006),可分为7个阶段:受精卵期、卵裂期、囊胚期、原肠期、肢芽期、膜内无节幼体期和出膜幼体期,与彭昌迪等(2002)的研究结果基本一致。
凡纳滨对虾属变温动物,水温高低决定其新陈代谢的速度,同样胚胎发育速度也直接受水温影响。彭昌迪等(2002)报道不同水温对凡纳滨对虾受精卵孵化出膜的时间有显著影响,水温从29.5 ℃下降至26.8 ℃,孵化时间从11.3 h增加到15.0 h;最适孵化水温为28.0~30.0 ℃;在水温29.5 ℃、盐度28‰的条件下其受精卵第一、二极体释放时间分别为7和8 min。栗治国等(2013)报道,在19.0~31.0 ℃的水温范围内脊尾白虾受精卵均可正常发育孵化出幼体,且高温可明显加快胚胎发育速率,缩短各期胚胎发育持续时间。由于研究方法和对虾品种的差异,本研究结果与彭昌迪等(2002)、栗治国等(2013)的研究结果有所不同,但所表现出的变化趋势基本一致,当水温由30.5 ℃下降至28.0 ℃,孵化时间从11.5 h增至13.0 h,即水温每下降1.0 ℃,孵化时间需增加0.6 h;在28.0~30.5 ℃的水温范围内,凡纳滨对虾受精卵第一极体释放时间为7~13min,第二极体释放时间为8~14 min,胚胎发育需11.5~13.0 h。可见,在确保受精卵正常发育的前提下,适当调低培育水温能延迟胚胎发育速度,为人工诱导卵染色体加倍创造较充足的操作窗口期。
本研究观察发现有部分发育异常的受精卵,可能由于操作机械损伤或卵过于集中缺氧等,而导致受精卵破裂溶解或停滞发育在多细胞期、肢芽期、膜内幼体期等胚胎发育阶段。此外,本研究还发现未受精卵发生皮层反应后发生卵裂行为,但形成的分裂球大小不等、形状各异,且到达相同分裂期所需的时间比受精卵延迟很多。如水温为29.0~30.0 ℃时,正常受精卵分裂至2-细胞需25~30 min,而未受精卵需1.5~2.0 h。
一般情况下,受精卵是进行正常的完全均等卵裂行为,分裂球界限分明,而未受精卵通常在完成第二次卵裂后即停止发育,且分裂球界限模糊不清。因此,受精卵是否正常进行完全均等分裂是确定卵子受精与否的重要标准(彭昌迪等,2002;Garnica-Rivera et al.,2004)。该结论为后续判定灭活精子是否成功激活卵子并成功加倍为雌核发育二倍体提供了标准,发育至2-细胞期仍能继续正常发育的受精卵即为成功诱导的雌核发育二倍体受精卵。
4、 结论
本研究结果表明,在确保凡纳滨对虾受精卵正常发育的前提下,适当调低培育水温能延迟胚胎发育速度,为人工诱导卵染色体加倍创造较充足的操作窗口期。此外,受精卵是否均等分裂是判断凡纳滨对虾卵子受精与否的重要标准。
参考文献:
1.蔡难儿,林峰,柯亚夫,陈本楠. 1995. 中国对虾人工诱导雌核发育的研究 I———四步诱导法[J]. 海洋科学,(3):35-41.
2.陈本楠,蔡难儿,李光友. 1997. 中国对虾人工诱导雌核发育的研究 II. 紫外线辐射对精子顶体反应和受精能力的影响[J]. 海洋科学,(1):41-47.
3.戴继勋,包振民,张全启,刘健. 1993.60Coγ 射线诱导中国对虾雌核发育的观察[J]. 青岛海洋大学学报,23(4):151-155.
4.李庭古,罗刚,徐国成,邵营泽. 2006. 不同水温对克氏螯虾受精卵孵化的影响[J]. 水产养殖,27(1):16-17.
5.栗治国,张成松,张岩,李富花,相建海. 2013. 温度对脊尾白虾胚胎及幼体发育的影响研究[J]. 海洋科学,37(10):9-16.
6.林琼武,艾春香,李少菁,王桂忠,陈学雷,沈绿珠. 2006. 凡纳滨对虾亲虾驯养、促熟、产卵及无节幼体培育[J]. 厦门大学学报:自然科学版,45(5):688-691.
7.吕建林,龚世园,李浪平. 2006. 克氏原螯虾胚胎发育的初步研究[J]. 长江大学学报:自然科学版,3(4):179-182.
8.孟凡丽,赵云龙,陈立侨,顾志敏,徐谷星,刘启文. 2000. 红螯螯虾胚胎发育研究 I. 胚胎外部结构的形态发生[J]. 动物学研究,21(6):468-472.
9.彭昌迪,郑建民,彭文国,何世强,唐天礼,王维部. 2002. 南美白对虾的胚胎发育以及温度与盐度对胚胎发育的影响[J]. 上海水产大学学报,11(4):310-316.
10.彭金霞,蒋小珍,房振峰,殷勤,韦嫔媛,陈晓汉. 2013. 凡纳滨对虾 COPE 基因序列及低温表达分析[J]. 西南农业学报,26(1):371-376.





