
颅底的生长主要是由颅底软骨联合的软骨内成骨作用的结果,所以软骨联合是颅底的发育中心。大鼠颅底前后向主要有两个软骨联合:蝶骨间软骨联合和蝶枕软骨联合。我们研究了大鼠颅底形成和发育过程中,两软骨联合细胞凋亡的分布情况以及凋亡相关因子(Fas)和一氧化氮(NO)凋亡途径在其发育过程中的作用。
1、材料与方法
1.1试验动物、试剂、仪器
动物:出生后4、8、16、32、48、64及128d的清洁级健康雄性SD大鼠,每组各5只(上海斯莱克实验动物有限公司)。试剂:细胞凋亡TUNEL法检验试剂盒(美国Promega公司),兔抗鼠iNOS,Fas多克隆抗体,生物素化羊抗兔IgG,DAB显色液(武汉博士德生物工程)。仪器:CX21型光学显微镜(日本Olympus公司),JD801型多功能图像分析软件(中国捷达公司)。
1.2方法
1.2.1标本制备TUNEL法及免疫组化染色,将大鼠用过量的戊巴比妥钠腹腔注射麻醉下处死,取材范围为筛骨前部到枕骨大孔,包括蝶骨间软骨联合(iss)和蝶枕软骨联合(sos)。取材后立即置于4%甲醛液固定24h,10%EDTA脱钙4~16周。石蜡包埋,冠状方向制备切片,厚5μm。取各组切片行TUNEL法和iNOS,Fas的免疫组化染色。
1.2.2结果判定标准及统计学方法TUNEL法结果判定,阴性对照:以高压灭菌去离子水代替rTdT酶。阳性对照:同标本肌肉组织。以荧光显微镜下呈黄色荧光的细胞定位阳性。选5个具有代表性的高倍视野(400倍)并取300像素×300像素的面积计数凋亡细胞,取平均值,数据用均数±标准差表示,比较7组样本均数的差别,行两因素方差分析,当总体差别有统计学意义时,再用scheffe法两两比较。应用Stata10.0统计分析软件对实验数据进行统计学处理,P<0.05表示有统计学意义。

免疫组化结果判定,阴性对照:以PBS代替一抗。以棕色颗粒定位Fas、iNOS阳性信号。选3个具有代表性的高倍视野(400倍)。Fas测定A值(opticaldensity,吸光度值)。iNOS测量IA值(累积吸光度值)。取平均值即为因子的表达量。统计方法同前,P<0.05表示有统计学意义。
2、结果
2.1TUNEL法染色结果
4、8d组织的静止区、增殖区、肥大区、交界区发现少量黄色荧光的凋亡阳性细胞,16d的肥大区、交界区和两侧的骨小梁间发现较多的凋亡细胞;32、48、64d标本的阳性细胞明显增多,并且同天数标本的sos较iss的凋亡阳性细胞数要多,统计有显著性差异(P<0.05)(表1)。32d阳性细胞染色见图1。而128d几乎未见凋亡细胞。肌肉组织阳参标本可见强阳性表达。
2.2Fas免疫组织化学结果
4~64d组织皆有Fas蛋白表达,主要存在于肥大区和交界区细胞的细胞膜与胞质中(图2),细胞核中也有少量表达,另外静止区和增殖区也可见淡染的棕黄色阳性细胞。128d时几乎观察不到Fas阳性细胞,sos情况基本同iss,无显著差异(表2)。

2.3iNOS免疫组织化学结果
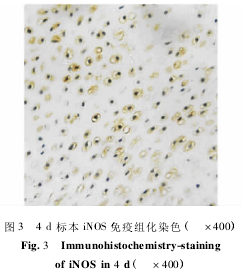
4、8、16d组织的静止区有iNOS蛋白表达(图3),主要定位于细胞质中,为棕黄色阳性颗粒,表达量逐渐减少。而32~128d仅观察到零星的阳性细胞。sos情况基本同iss,统计学无显著差异(表2)。
3、讨论
软骨内成骨是颅底长度发育的基础,而细胞的肥大、成熟、凋亡以及矿化又是软骨内成骨过程的关键。所以矿化与凋亡是共存的。国外有研究证明细胞凋亡参与软骨组织的代谢和生长发育并且已在小鼠颅底发现细胞凋亡现象。我们在正常大鼠颅底软骨联合组织中用TUNEL法检测到了凋亡细胞,有力地佐证了这一观点。软骨细胞适时、适地、适量的凋亡,是颅底根据自身生长、发育、塑形需求而进行的生理性过程。通过调控不同类型细胞数量,进而调整骨形成和骨吸收之间的动态平衡,最终完成颅底骨的正常发育。
3.1Fas相关的细胞凋亡
受体介导途径是细胞凋亡的重要途径之一,Fas是一种细胞膜表面凋亡受体。Fas的配体FasL(Fasligand)与Fas结合后,可以激活caspase-3、caspase-7、Bid蛋白等凋亡相关因子,从而引发凋亡。Fas主要由细胞膜上表达,主要分布在肥大区、交界区软骨细胞,静止区、增殖区也有少量阳性表达。本实验表明Fas阳性细胞的空间分布与TUNEL凋亡细胞分布位置大致相同,表明该途径介导的凋亡与总凋亡有一致性,提示其在颅底软骨联合发育中发挥主要作用。
3.2iNOS相关的细胞凋亡途径
NOS按表达方式分为自发型(包括神经型和内皮型)和诱导型(iducibleNOS,iNOS)两种。iNOS只在细胞受到刺激如缺血缺氧、血红素、细胞因子、IFN-γ、TNF-α、IL-1α后被激活表达。而iN-OS又可产生NO。NO是一种生理病理介质,能诱导多种细胞凋亡并引起各种疾病,其机制可能是通过影响胞外信号调节激酶(Erk)、p38、蛋白激酶C、细胞色素C等引发的。
NO途径在软骨生长发育中的研究较少,李发涛等的细胞培养实验表明NO在兔生长板软骨细胞凋亡中发挥重要作用,可以促进生长板软骨细胞的终末分化。另有研究表明NO抑制剂不能影响Fas诱导的细胞凋亡,说明Fas与NO凋亡途径相对独立。
本实验发现iNOS的表达几乎仅分布在静止区和增殖区。推测可能是4~16d软骨联合静止增殖区的功能活跃,需氧量多,而其离骨髓腔相对较远,缺血缺氧引起iNOS合成,生成NO,启动凋亡。细胞凋亡的发生又使32d后静止区细胞数量锐减,功能明显减少减退,缺氧状态随之减轻。与凋亡现象的研究结果(静止区和增殖区在4~16d有少量的TUNEL凋亡细胞存在,32d后几乎没有TUNEL凋亡细胞)相符。由于静止区和增殖区在软骨内成骨中发挥着重要的细胞储备和增殖作用,而静止增殖区又以NO凋亡途径为主,所以该途径在颅底发育中的作用不容忽视。
3.3颅底iss和sos在生长发育中的差异
Rice等发现颅底软骨生长板的头部、尾部生长速度有梯度变化,枕骨基部最快,蝶前骨的头部最慢。Roberts等也发现软骨联合尾部的生长指数高,头部的生长指数低而基蝶骨发育速度比基枕骨的发育速度要快。本研究发现相同天数标本的sos较iss的凋亡阳性细胞数要高,从一定程度上佐证了蝶枕软骨联合较蝶骨间软骨联合组织改建的速度差异,说明细胞凋亡程度的不同是导致其生长差异的重要因素之一。
而在Fas和iNOS阳性细胞的研究中,sos情况基本同iss类似,说明蝶枕软骨联合和蝶骨间软骨联合的外界生长环境基本一致,但两组织对环境的反应却不相同,这可能与凋亡级联反应的其他因素有关,如可能两组织细胞上fas配体数量不同,或存在某些抑制或促进生长的因子存在,这有待进一步的研究。
参 考 文 献:
[1] Noble BS,Peet N,Stevens HY,et al. Mechanical loading biphasic os-teocytes survival and targeting of osteoclasts for bone destruction in ratcortical bone[J]. Am J Physiol Cell Physiol,2003,284(4) :934 - 943.
[2] Nie X,Luukko K,Fjeld K,et al. Developmental expression of Dkk1-3 and Mmp9 and apoptosis in cranial base of mice[J]. J Mol Histol,2005,36(6 - 7) : 419 - 426.
[3] Yamamoto J,Maeno K,Takada T,et al. Fas ligand plays an impor-tant role for the production of pro-inflammatory cytokines in inter-vertebral disc nucleus pulposus cells[J]. J Orthop Res,2013,31(4) : 608 -615.
[4] Peter ME,Krammer PH. Mechanisms of CD95(Apo21/Fas) Medi-ated apoptosis[J]. Curr Opin Immunol,1998,10(5) : 545 - 551.
[5] Liu ZH,Sun Z,Wang HQ,et al. FasL expression on human nucleuspulposus cells contributes to the immune privilege of intervertebral disc by interacting with immunocytes[J]. Int J Med Sci,2013,10(8) : 1053 -1060.
[6] NathanC,Xie QW. Nitric oxide synthases: roles,tolls andcontrols[J]. Cell,1994,78(6) : 915 -918.
[7] Kwon HJ,Shin JO,Lee JM,et al. Retinoic acid modulates chondro-genesis in the developing mouse cranial base[J]. J Exp Zool B Mol Dev Evol,2011,16(8) : 574 - 583.
[8] Zara S,Rapino M,Centurione L,et al. Inducible nitric oxide syn-thase-activated mitochondrial apoptotic pathway in hypoxic and aged rat hearts[J]. Gerontology,2010,56(6) : 544 - 552.
[9] Zhang ZW,Zhang JL,Zhang YH,et al. Effect of oxygen free radi-cals and nitric oxide on apoptosis of immune organ induced by se-lenium deficiency in chickens[J]. Biometals,2013,26 (2 ) : 355- 365.
[10] 李发涛,宇丽,李冬艳. 一氧化氮在兔生长板软骨细胞终末分化中的生物学作用[J]. 山东医药,2007,47(3) : 26 -28.
[11] Hashimoto S,Setareh M,Ochs RL,et al. Fas/Fas ligand expression and induction of apoptosis in chondrocytes[J]. Arthritis Rheum,1997,40(10) : 1749 - 1755.
[12] Rice DP,Rice R,Thesleff I. FgfrmRNA isoforms in craniofacial bonedevelopment[J]. Bone,2003,33(1) : 14 - 27.
[13] Roberts GJ,Blackwood HJ. Growth of the cartilages of the mid-line cranial base: a autoradiographic study using tritium labeled thymi-dine[J]. J Anat,1984,138(3) : 525 - 535.
[14] Garcia AJ,Tom C,Guemes M,et al. ERα signaling regulates MMP3 expression to induce FasL cleavage and osteoclast apoptosis[J]. J Bone Miner Res,2013,28(2) : 283 - 290.
[15] Rus A,Castro L,Del Moral ML,et al. Inducible NOS inhibitor 1400W reduces hypoxia / re-oxygenation injury in rat lung[J].Redox Rep,2010,15(4) : 169 - 178.
[16] Nakao K,Okubo Y,Yasoda A,et al. The effects of C-type natriuret-ic peptide on craniofacial skeletogenesis[J]. J Dent Res,2013,92(1) : 58 -64.





