
0、引言
海马在学习、记忆和内脏活动等方面起重要作用,与老年神经系统退行性病变密切相关。海马正常发生发育过程是通过细胞增殖与凋亡的协调作用调节的。DCX是神经发生的合适标记物,短暂表达于增殖神经前体细胞,定量标记可反映神经发生水平高低。Caspase-3是细胞凋亡的主要执行者,也是判断细胞凋亡的生化标志(biochemi-calmarker)。目前,应用基因敲除或转基因动物模型研究神经退行性疾病多以C57/BL6小鼠为动物载体,但有关其海马发育过程中细胞增殖与凋亡的系统研究尚鲜见报道。本实验应用免疫组织化学染色、免疫荧光与免疫印记技术结合透射电镜技术对C57/BL6小鼠海马发育过程中细胞增殖与凋亡的变化规律进行系统和动态观察研究,为深入探讨海马发生发育机制以及老年神经退行性疾病的机制研究提供基本的实验依据。
1、材料与方法
1.1实验动物培养与海马标本制备
成年健康C57/BL6小鼠,按雌雄比例1∶2同窝饲养,以雌鼠阴道栓出现计为胚龄(E)0d;以仔鼠出生的最早时间计为生后(P)0d。选取胚龄12、14、16、18d胎鼠和生后1、3、5、7、14、21、28d及2、3m龄仔鼠,每组8只。孕鼠经4%戊巴比妥钠腹腔麻醉后剖腹取出胎鼠,E10、12、14d的胎鼠取全胚,其余各胚日龄胎鼠和仔鼠断头取脑,4%多聚甲醛浸润固定,经水洗后进入系列乙醇脱水,二甲苯透明后石蜡定向包埋,行5μm厚连续切片,免疫组化及免疫荧光染色备用。各组取适量新鲜海马组织置于-80℃保存,用于免疫印迹检测分析。另取E12、16d和P1、P7d海马组织切成约1mm3小块,经3%戊二醛低温浸润固定48h后在经1%锇酸后固定1h,常规电镜标本制备,Epon812环氧树脂定向包埋,LKB-V型超薄切片机半薄切片,厚度1μm,甲苯胺兰染色,光镜观察海马各区定位后再行超薄切片,厚70nm,重金属双染色,EX1200透射电镜观察。
1.2DCX免疫组织化学染色
采用石蜡切片免疫组化Envision法。切片常规脱蜡至水,3%过氧化氢溶液处理30min以去除内源性过氧化物酶,高压修复抗原,加一抗(羊抗鼠DCX1∶200,SantaCruz公司)4℃过夜,滴加生物素标记的二抗(兔抗羊IgG,1∶200,北京中杉金桥生物有限公司)室温孵育10min,滴加链霉菌抗生物素-过氧化物酶溶液室温孵育10min,DAB显色,苏木素核复染,脱水、透明、中性树胶封片,光镜下观察。阴性对照用PBS代替一抗。DCX阳性颗粒呈棕褐色,位于迁移中的神经元胞体以及分化中的神经元轴突。
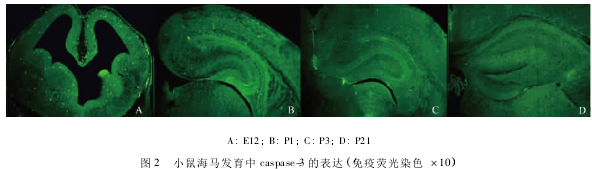
1.3Caspase-3免疫荧光染色
石蜡切片脱蜡水化后,微波修复10min;加非免疫动物血清室温孵育10min;加一抗(兔抗鼠Caspase-3,1∶200,SantaCruz公司)4℃过夜;加FITC标记山羊抗兔IgG(北京中杉金桥生物有限公司)37℃避光孵育30min,65%甘油封片,荧光显微镜下观察,Caspase-3阳性颗粒呈明亮绿色荧光,分布于细胞浆。阴性对照用PBS代替一抗。
1.4Westernblotting检测DCX和Caspase-3蛋白表达
各组冷冻海马组织加入细胞裂解液,0℃下剪碎和超声波粉碎20s后静置30min,4℃下12000r/min离心20min,留取上清液,BCA法测定蛋白含量,并按每20μL含50μg蛋白制成样品,-20℃冰箱保存。取已制备样品适量加入电泳槽,100V电压下电泳,转膜,常温下半干转印,TBST冲洗后,5%小牛血清白蛋白室温封闭1~2h。分别加入一抗(DCX和caspase-3抗体,稀释度1∶200)4℃孵育过夜,TBST缓冲液洗脱3次,每次5min;分别加入二抗室温孵育1h,TBST缓冲液洗脱3次,每次5min,ECL发光显色;采用β-actin作为内参,扫描电泳条带,用凝胶分析软件分析各蛋白目的条带吸光度。根据目的条带与内参条带吸光度的比值表示待测蛋白含量。
1.5统计分析
实验结果采用统计软件SPSS16.0处理,数据资料用x±s表示。对所测各项数据进行重复测量资料的方差分析,P<0.05为差异有统计学意义。
2、结果
2.1DCX免疫组化染色结果
DCX免疫阳性反应产物呈棕褐色,E12d阳性细胞出现在海马结构原基中,E16~E18dCA区各层可见弥散分布的阳性细胞,P1d~P14d阳性细胞在锥体层外周排成一致密带,P1d最宽,P14d消失;分子层及多形层中的阳性细胞,P1~P7d逐渐减少,P14d后消失。P1~P7d阳性细胞弥散分布于齿状回各层,P14d主要分布于颗粒层内1/2,P21d主要分布于亚颗粒细胞层,P28d~3m亚颗粒细胞层阳性细胞逐渐减少(图1)。

2.2Caspase-3免疫荧光染色结果
Caspase-3阳性反应物呈明亮绿色荧光,E12d海马结构原基可见阳性表达;E16~E18d阳性细胞主要分布于CA区锥体层及齿状回颗粒层;P1~P3d逐渐增多;P5~P14d逐渐减少;P21d~3m仅见少量阳性细胞(图2)。
2.3电镜观察结果
(1)细胞增殖(图3A,B):E12d和E16d海马结构中见大量增殖细胞,P1d及P7d仍可见少量增殖细胞,表现为核染色质粗块状,排列散乱,核膜解体,核分裂相等;(2)细胞凋亡(图3C,D):E16d、P1d及P7d均可见凋亡细胞,以P1d居多,表现核染色质浓缩边集,细胞质皱缩,E12d未见到凋亡细胞。
2.4DCX与Caspase-3免疫印迹检测分析结果
DCX与caspase-3免疫印迹蛋白条带见图4,蛋白表达分析结果:(1)DCX蛋白表达量:E18d~P3d逐渐增多(P<0.01);P3~P5d无明显差异(P>0.05);P7d~2m逐渐减少(P<0.01);2~3m无明显差异(P>d0.05)(图5)。(2)Caspase-3蛋白表达量:E18d~P3d逐渐增加(P<0.01);P5~P21d逐渐降低(P<0.01);P21d趋于稳定(P>0.05)(图5)。


3、讨论
海马正常发生发育过程是通过细胞增殖与凋亡的协调作用调节的。DCX是研究神经发生的合适标记物,短暂表达于增殖神经前体细胞,定量标记可反映神经发生水平高低。Caspase-3是细胞凋亡的主要执行者,也是判断细胞凋亡的生化标志(biochemicalmarker)。对细胞增殖与凋亡的形态学认别最可靠的方法是电子显微镜技术。
本实验对C57/BL6小鼠海马DCX免疫组化染色结果显示:E12~E18d均可见大量阳性细胞,与Walker等对小鼠胚胎期神经发生的研究结果相似;P1~P14d阳性细胞在锥体层外周排成一致密带,P1d最宽,P14d消失,与席刚明等对大鼠的研究结果相似,推测可能为新生神经元从外到内,由下托向齿状回逐渐迁移所致;阳性细胞分布:P1~P7d主要位于齿状回(DG)颗粒层和多形层,P14d主要位于颗粒层内1/2,P21d主要位于亚颗粒细胞层,P28d~3m亚颗粒细胞层阳性细胞逐渐减少,这种渐变规律与Muddanna等对大鼠的研究结果相似。本实验DCX免疫印迹分析结果显示:胚胎期至生后2w,DCX蛋白表达量先增后减,变化明显,但均处于较高水平,2m后趋于稳定,与Muddanna等对大鼠的研究结果相似,结合本实验电镜观察结果,E12d、P1d及P7d均可见增殖细胞,推测胚胎期至生后两周为海马结构细胞增殖分化迁移及体积增长高峰。
在海马结构发生、发育及老化过程中始终同时存在着细胞增殖与凋亡,通过这两个过程的协调作用才能保证海马正常的发生、发育及老化过程。Caspase-3是细胞凋亡蛋白酶级联反应的必经之路,也是凋亡的关键酶和执行者。LIU等对大鼠海马研究结果提示:Casepase-3在P2d表达最强,以后逐渐降低,P21d后处于稳定的较低水平。
本实验对C57/BL6小鼠海马Caspase-3免疫荧光及免疫印迹结果与其相似:E12d~P3dcaspase-3阳性表达逐渐增多,P3~P21d表达逐渐减少,P21d后趋于稳定;结合本实验电镜观察结果可见,P1凋亡细胞数量最多,推测小鼠海马结构细胞凋亡高峰在P3d左右。
综上所述,本实验应用免疫组织化学染色、免疫荧光结合透射电镜技术对C57/BL6小鼠海马发生发育过程中细胞增殖与凋亡的变化规律进行了系统观察研究,结果显示:胚胎期至生后两周为小鼠海马细胞增殖和分化迁移高峰,凋亡高峰位于P1~3d;同时采用免疫印迹技术对发育中的细胞增殖与凋亡进行了对比性定量检测,结果发现,小鼠海马发育过程中,于E18d~P5dDCX吸光度比值高于caspase-3吸光度比值,而于p7~p3m则后者显著高于前者,并随鼠龄增长呈进行性增多和加重,说明发育早期增殖细胞数量明显多于凋亡细胞数,以后随鼠龄增长凋亡呈进行性增多。研究结果为深入探讨海马发生发育机制以及老年神经退行性疾病的机制研究提供了基本的定量形态学依据。





