
γ干扰素(IFN-γ)由NK细胞、活化的Th1和细胞毒性T细胞(cytotoxic T cells,CTL)等细胞产生。IFN-γ的免疫学活性主要表现在如下几个方面:
促进NK细胞活性;增强巨噬细胞递呈抗原及其杀菌功能;诱导活化的B细胞产生IgG2a和IgG3;通过上调转录因子T-bet表达促进Th1的分化;通过抑制Th2分化,促进CTL活化,激活巨噬细胞等途径极化机体的细胞免疫功能;提高MHCⅡ类分子在抗原递呈细胞表面的表达量;直接抑制病毒复制效应。因此,IFN-γ是天然免疫和适应性免疫应答过程中很重要的细胞因子之一,在机体抗细胞内寄生菌、抗病毒以及抗肿瘤中发挥着关键作用。基于此,人工制备重组IFN-γ并将其应用于动物传染病和肿瘤治疗,已经在兽医临床取得了较好的效果。
人工舍饲养殖小熊猫过程中,因细菌、病毒和寄生虫等感染引起的小熊猫死亡问题一直令人感到棘手,至今未有较为合理有效的应对措施。本研究以纯化的小熊猫重组IFN-γ为材料,对其免疫活性进行鉴定,为小熊猫传染病及肿瘤的预防和治疗提供新的手段。
1、材料与方法
1.1材料
1.1.1试验用动物成年健康小熊猫6只(2只雌性,4只雄性),饲养于海峡(福州)大熊猫研究交流中心。
1.1.2主要试剂淋巴细胞分离液为上海华精生物高科技有限公司产品;ConA、Hepes、L-Gln、MTT和丙酮酸钠为Sigma公司产品;RPMI-1640培养基为Hyclone公司产品;犊牛血清为Gibco公司产品;β-巯基乙醇,DMSO为Amresco公司产品;青、链霉素,肝素锂抗凝管,小熊猫IFN-γ原核表达蛋白(纯化后冻干),NaHCO3,NaCl,KCl,Na2HPO4·12H2O,KH2PO4均为进口或国产分析纯;辣根过氧化物酶标二抗(羊抗兔IgG-HRP),碳酸盐缓冲液,洗涤缓冲液(PBST),封闭液(含50g/L脱脂奶粉的PBST),终止液(2mol/L的H2SO4),96孔酶标板。
1.1.3主要仪器水平转子离心机,角转子离心机(eppendorf),超净工作台,酶标仪(BIO-RAD),CO2培养箱(Thermo),恒温培养箱,普通光学显微镜,普通冰箱,-70℃超低温冰箱。
1.2方法
1.2.1小熊猫外周血单个核细胞悬液的制备前肢静脉无菌采小熊猫外周血3mL,肝素抗凝。将抗凝血沿离心管壁缓慢叠加到3mL淋巴细胞分离液上,注意尽量不要让血液与淋巴细胞分离液的分界面晃动。
2000r/min离心20min。吸取云雾层细胞到另一干净离心管中,加入两倍体积的PBS(含20mL/L犊牛血清),温和颠倒混匀,1000r/min×10min洗涤细胞,弃上清。重复洗涤细胞2次。最后一次洗涤结束后,弃掉上清,利用台盼蓝染色法染色,3min内计数,活细胞数目要求在95%以上。用完全1640培养基将细胞密度调整为1×107个/mL。
1.2.2淋巴细胞增殖试验
吸取100μL细胞悬液加入到96孔培养板中,试验组加入100μL不同浓度(100×1.56、10-1×1.56、10-2×1.56、10-3×1.56、10-4×1.56、10-5×1.56mg/mL)的小熊猫IFN-γ原核表达蛋白或经热变性处理(煮沸10min)的小熊猫IFN-γ原核表达蛋白(10-1×1.56mg/mL)。对照组加入100μL的完全1640培养液。
37℃、体积分数为5%CO2培养箱中培养72h。细胞培养至68h时,每孔无菌吸取50μL上清弃掉,加入15μLMTT。37℃、体积分数为5%的CO2培养箱中继续孵育4h。细胞培养72h时,每孔吸取100μL上清弃掉,加入100μLDMSO彻底裂解细胞,用酶标仪在490nm波长处测OD值,计算SI值,确定出最佳刺激效果的稀释梯度。
1.2.3PBMC培养上清的制备
分离小熊猫外周血单个核细胞(periphalbloodmononuclearcells,PBMC),步骤同1.2.1,用完全1640培养基将细胞密度调整为1×107/mL。吸取500μL细胞悬液加入到24孔培养板中,再加入500μL浓度为10-1×1.56mg/mL的小熊猫IFN-γ原核表达蛋白溶液,另设PBMC阴性对照。37℃、体积分数为5%CO2培养。分别在刺激后12、24、36、48、60、72h收取细胞上清,置-80℃保存,供IFN-γ测定使用。
1.2.4IFN-γ的间接ELISA测定
1.2.4.1抗原包被不同时间收集的PBMCs培养上清冻干粉,用等量的碳酸盐缓冲液(pH9.6)溶解,然后以100μL/孔包被,另设相应的对照孔。4℃过夜,弃去包被液,用PBST洗5次。
1.2.4.2封闭每孔加入100μL含50g/L脱脂奶粉的PBST,37℃,孵育1h。弃去封闭液,PBST洗涤5次。
1.2.4.3加一抗用PBST将兔抗IFN-γ血清稀释1000倍,每孔加入100μL,37℃,孵育1h。弃去孔中液体,PBST洗涤5次。
1.2.4.4加二抗羊抗兔IgG-HRP用PBST稀释成1∶5000,每孔加入100μL,37℃孵育50min。弃去孔中液体,PBST洗涤5次。
1.2.4.5每孔加入100μL的底物显色液,37℃孵育15min。
1.2.4.6终止加入2mol/L的H2SO4终止反应,测OD450nm值。
2、结果
2.1重组IFN-γ对小熊猫PBMC增殖的影响
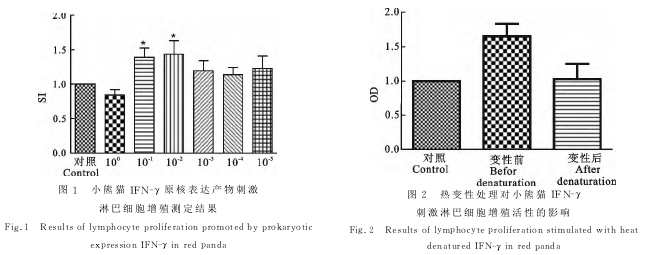
本研究结果显示,浓度组为10-1×1.56mg/mL、10-2×1.56mg/mL的小熊猫IFN-γ原核表达产物与小熊猫外周血T淋巴细胞共孵育后,具有显著刺激T淋巴细胞增殖的效应(P<0.05)。为进一步明确这种细胞增殖效应是IFN-γ本身的免疫活性引起的,而非IFN-γ作为一种抗原性质的作用。
我们对IFN-γ原核表达产物进行了蛋白热变性处理,结果发现浓度为10-1×1.56mg/mL的IFN-γ经热变性处理后,与空白对照组相比,其淋巴细胞增殖效果无显著差异(P>0.05),但与未经热变性处理组相比,淋巴细胞增殖效果显著降低(P<0.05)。本试验结果表明,我们制备的小熊猫IFN-γ原核产物具有刺激T淋巴细胞增殖的免疫活性,经热变性处理的小熊猫IFN-γ刺激T淋巴细胞增殖的活性几乎完全丧失(图1和图2)。
2.2重组IFN-γ对小熊猫PBMC分泌IFN-γ的影响
本试验测定了PBMC在重组IFN-γ作用下,不同时间点培养上清中IFN-γ的水平。结果显示,与对照组相比,试验组IFN-γ含量在60h之前均显著升高(P<0.01,或P<0.05)。与对照组相比,IFN-γ含量在培养72h时的水平并没有显著变化(P>0.05)。结果表明,IFN-γ原核表达产物具有刺激小熊猫外周血淋巴细胞分泌IFN-γ活性。
PBMC培养系统加入的重组IFN-γ在短期内(24h)迅速激活Th1和CTL细胞并分泌IFN-γ,之后随着培养时间延长,效应T细胞活力下降,其分泌能力随之下降并停止。加之IFN-γ则在酸性环境不稳定,故而累积在上清中的IFN-γ则随时间延长而不断衰减,导致培养后期培养上清中IFN-γ水平下降(图3)。

3、讨论
外周血单个核细胞包括T细胞、B细胞、NK细胞以及单核细胞,经过淋巴细胞分离液分离后获得的PBMC主要包括T、B淋巴细胞和极少量的NK细胞。T细胞由Th1、Th2、CTL、Th17等组成,其中Th1、CTL等T细胞的活化分化均需要IFN-γ。
换言之,IFN-γ在细胞培养水平具有刺激T细胞增殖的效应,并且这种作用在一定范围内呈量效正相关的关系。活化以及效应Th1和CTL又具有分泌IFN-γ活性,在其培养上清中又可以检测到IFN-γ,并且上清中IFN-γ水平的高低与活化以及效应Th1和CTL数量紧密相关。基于上述免疫学原理,本研究采用PBMC增殖试验和间接ELISA,分别测定了重组IFN-γ刺激小熊猫PBMC增殖及其培养上清中IFN-γ含量,以此判定小熊猫原核重组IFN-γ的免疫活性。本研究在IFN-γ活性时之所以不选择动物个体水平试验,基于两个原因:小熊猫属于国家珍稀保护动物,数量有限;正常小熊猫个体使用重组IFN-γ效果未必明显,病毒感染或荷瘤小熊猫样本短时间内难以获得。此外,也有研究采用IFN-γ直接抗病毒增殖的特点,通过测定其在细胞培养水平抑制病毒增殖效果来评估的活性。
作为免疫活性细胞因子,其更重要更明显的活性是体现在其免疫学方面,这也是本研究不测定重组IFN-γ抗病毒增殖活性的原因。
本研究结果表明,纯化的小熊猫重组IFN-γ具有较好的免疫活性,能够刺激小熊猫T淋巴细胞增殖及促进其分泌IFN-γ。从培养上清中IFN-γ含量分析,在12h时含量就已经明显升高,提示在这个时间点产生细胞已经充分活化。换言之,我们在培养系统中加入的重组在12h之前就已经发挥了其刺激T细胞增殖的作用,这和我们前期预试验在12h就可以观察到PBMC有细胞大量增殖形成的克隆团现象刚好吻合。由于一般的蛋白质抗原在PB-MC细胞培养系统中刺激淋巴细胞增殖形成克隆团现象通常需要24h,因此,本研究结果充分表明,我们制备的小熊猫重组IFN-γ具有很好的免疫活性。
为进一步证实这一结论,我们对小熊猫重组IFN-γ按照蛋白质热热变性条件进行处理,再将热变性的重组IFN-γ加入到PBMC培养系统中,结果显示其刺激细胞增殖的活性消失。表明重组IFN-γ活性的发挥需要特定空间构象的维持,这与天然IFN-γ活性需要特定构象的特性相一致。本研究结果证明,一旦该重组细胞因子的空间构象被破坏,其免疫活性也就随之丧失。这一结论为下一步制备供小熊猫临床应用的重组IFN-γ提供了极有参考价值的依据。
人类IFN-γ已获得FDA批准可用于医学临床抗病毒抗肿瘤应用,重组IFN-γ已在鸡抗球虫感染、治疗奶牛乳房炎、猪病毒病预防等临床取得了较好的进展。本研究取得的结果,为小熊猫临床抗病毒抗肿瘤等疾病的预防和治疗提供了更有效的途径和手段。与现有的小熊猫临床抗病毒和抗肿瘤药物相比,在组成上和小熊猫体内天然产生的分子完全一致,无任何异源性,因而使用后不会产生排斥免疫反应,更为安全高效。我们下一步将开展小熊猫重组IFN-γ临床应用的研究。





