
核糖体蛋白不仅在核糖体组装和蛋白合成中有重要作用,在细胞周期、凋亡、DNA损伤修复等过程中同样发挥着一定作用。一些核糖体蛋白的异常表达与人类疾病的发生紧密相关。
S3是核糖体小亚基的一个成员,有核酸内切酶的活性,是凋亡前体蛋白,并且是NF-κB复合物中的一个重要亚基。研究发现,S3蛋白通过caspase依赖的方式激活JNK,引起基因毒性应激产生细胞凋亡。在果蝇(Drosophila)中发现,S3基因进行p元件插入可引起minute表型。但是有关S3蛋白对果蝇发育的全面报道及分子机制还鲜有报道。本研究基于前人的工作,采用RNAi法,在果蝇和果蝇S2细胞中降低S3蛋白的表达,从而实现对S3蛋白在果蝇生长发育中的作用的探讨。
1 材料与方法
1.1 S3RNAi转基因果蝇的获取和培养
以果蝇S3cDNA为模板进行PCR扩增(上游引物:5-CAAACTAGTACCATGGGAATGAATGCGAAC-3;下游引物:5-CCAGAATTCCGCAAAACTTTCGCCTCGGACAGATC-3)。将PCR产物克隆到SympUAST-w载体上,获得S3-SympUAST-w质粒。将S3-SympUAST-w质粒通过显微注射的方法注射到果蝇W1118胚胎中。具体步骤如下:选择极细胞形成前(即产卵后10~30min)的胚胎。显微镜下观察胚胎的极性,将含有S3-Sym-pUAST-w质粒和缓冲液的溶液在压力泵负压作用下,经显微注射针注射到果蝇胚胎尾部生殖细胞内。注射过的胚胎继续培养。经多步筛选获取S3RNAi转基因果蝇。用到的其它果蝇品系:act5c-Gal4、Hsp70-Gal4、ey-Gal4、gmr-Gal4、sca-gal4和vg-Gal4。除特别说明,果蝇均在18℃/25℃的玉米粉-蔗糖培养基上培养。
1.2 统计果蝇幼虫体长
Hsp70-Gal4雌蝇与S3RNAi雄蝇杂交,使之在培养基上间隔1h产卵。产卵后24h,37℃热激30min。热激后间隔24h随机收集幼虫,每组10只,直到对照组发育至蛹期。用配有CCD摄像头(莱卡)的MZ16体视显微镜对幼虫拍照。通过MetaMorph软件分析并统计幼虫体长。
1.3 吖啶橙染色
在PBS缓冲液中解剖S3RNAi/vg-Gal4三期幼虫翅膀disc,解剖好的disc立即放到4 ℃果蝇培养基(Gib-co)中,使之维持正常的生理环境。再将之转移到一个加有50μL培养基的载玻片上,用100μL的培养基清洗1次。以浓度为1μg/mL的吖啶橙(Sigma)室温染色5min。染色后即刻用荧光显微镜拍照观察。
1.4 果蝇S2细胞中进行S3RNAi
通过PCR扩增果蝇S3基因编码序列,其中采用的上游引物(含有一个T7启动子)为:5-TAATACGACT-CACTATAGGGAGAATGCGAACCTTCCGATTT-3,采用的下游引物为:5-TAATACGACTCACTATAGG-GAGAACTTGGCACGCTGACCAC-3)。PCR产物经纯化试剂盒纯化(Roche Molecular Biochemicals)。以纯化的产物为模板,用MEGAscript T7体外转录试剂盒(Ambion)合成单链RNAs(ssRNAs)。ssRNAs在95°C持续5min,65℃中退火30min,自然降温至室温,即生成双链RNAs(dsRNAs)。dsRNAs经乙醇沉淀后重悬在合适体积的无RNase水中。通过琼脂糖凝胶电泳对dsRNAs进行定量,保存在-80℃备用。
果蝇S2细胞培养在Schneider基本培养基(Gibco)中,并补加终浓度为10 %胎牛血清(Gibco)、160μg/mL青霉素、250μg/mL链霉素和4 mmol/L L-谷 氨 酸 (Sigma)。S2细 胞 中 干 扰S3mRNA表 达:细 胞 以1×106个/mL的密度培养在35cm培养盘的无血清培养基里。
S3dsRNAs(5μg/mL)加到1mL无血清培养基中,室温培养1h。1h后,补加终浓度为10%胎牛血清的正常培养基2mL继续培养。分别在干扰后的第4、8d收集S3RNAi细胞,相同条件下,GFPdsRNA用作对照。
1.5 RT-PCR
根据RNeasy Mini Kit(Qiagen)试剂盒提取第8dS3RNAi组和GFPRNAi组细胞总RNA。在进行RT-PCR之前,提取的RNAs用DNase(TaKaRa)进行处理。纯化的RNA用作第一链cDNA合成。用M-MLV反转录酶(Invitrogen)和oligo-dT引物合成cDNA。为了检测是否有基因组污染,实验中同时检测了每一组RNA样品在没有加反转录酶时对照基因的表达。在25μL反应体系中,每个样品用1μL cDNA做模板。
PCR反应条件:95℃预变性5min;94℃持续30s,60℃持续30s,72℃持续45s,如此30个循环;最后72℃延伸8min。用到的引物见表1。【表1】

1.6 统计分析
所有实验至少重复3次,通过Excel软件进行分析。数值以“平均值±标准差”表示。用t检验进行显着性分析,p<0.05表示差异显着。
2 结果
2.1 S3蛋白表达减少对果蝇幼虫发育的影响
用act5c-Gal4和Hsp70-Gal4驱动子分别驱动S3蛋白在果蝇体内广泛和诱导性删除。结果发现S3RNAi/act5c-Gal4死在胚胎期,对照组发育正常。对照组在幼虫期维持5~7d,正常发育到蛹期和成蝇。最初48h,S3RNAi/Hsp70-Gal4与对照组相比,体长无大的差异;72h后较对照组幼虫体长显着短小(图1a、b)。【图1】

S3RNAi/Hsp70-Gal4发育延缓,在幼虫期维持10~12d,体长偏小,生命缺少活力,最终死在蛹期之前(图1c)。上述结果表明S3蛋白在果蝇早期发育过程中有重要作用。
2.2 S3蛋白表达减少对果蝇眼睛、翅膀和刚毛发育的影响
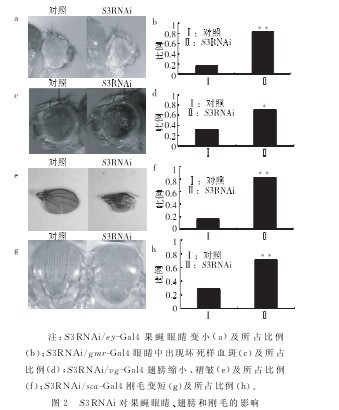
实验进一步用ey-gal4、gmr-gal4、vg-gal4和sca-gal4驱动子在果蝇眼睛、翅膀和刚毛中删除S3蛋白。果蝇复眼是由一定数目的单眼和特异性视网膜细胞精确排列组成的。S3RNAi/ey-gal4(图2a、b)眼睛明显变小。GMR-Gal4特异的驱动眼睛中的色素细胞和光感受器神经元。S3RNAi/gmr-Gal4眼中出现坏死样血斑(图2c、d),表示在S3RNAi后有细胞死亡出现。S3RNAi/vg-gal4翅膀 变 小,且 有 很 多 褶 皱 (图2e、f)。另外S3RNAi/sca-gal4果蝇刚毛变短(图2g、h)。这些表型说明S3蛋白表达减少后可能有细胞凋亡的发生,从而引起了异常表型的出现。【图2】
2.3 吖啶橙染色和细胞计数
在S3RNAi/vg-gal4果蝇三期幼虫翅膀disc中,吖啶橙染色发现有明显的凋亡信号(图3a)。而果蝇S2细胞在转染了S3dsRNAs后,与对照组相比,细胞生长阻滞,数目明显减少(图3b)。说明S3基因被删除后细胞增殖受到影响,并有细胞死亡的发生。这进一步证实了S3蛋白表达减少后引起的果蝇表型异常是由细胞凋亡引起。【图3】

2.4 RT-PCR检测S3RNAi后与细胞周期、细胞凋亡相关基因的变化
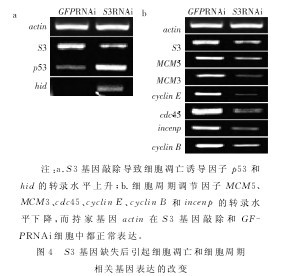
通过RT-PCR检测S2细胞中干扰S3mRNA后凋亡相关基因(p53和hid)和细胞周期相关基因(MCM5,MCM3,cdc45,cyclin E,incenp和cyclin B)的转录水平,结果如图4a、b。在S3RNAi后p53和hid转录水平明显升高。而MCM5,MCM3,cdc45,cyclin E,incenp和cyclin B转录水平均降低。这种变化与它们各自在细胞凋亡中的作用一致,从而进一步证实了在S3RNAi后确实有凋亡的发生,并且与细胞周期异常相关。【图4】
3 讨论
本实验证实了S3蛋白对果蝇正常发育是不可缺少的。
S3RNAi后果蝇出现的缺陷表型暗示了,S3蛋白表达减少可能抑制了细胞增殖,并造成细胞凋亡的出现。细胞的生长是由细胞增殖引起的细胞数目增加和细胞凋亡导致的细胞数目减少之间的动态平衡决定的。细胞计数和免疫染色实验进一步验证了在S3干扰后确实有细胞凋亡的发生。RT-PCR结果再一次证实了该结论。
P53蛋白通过释放细胞色素C激活caspase启动细胞凋亡。Hid蛋白是果蝇中重要的凋亡诱导因子,可直接或间接激活p53基因来诱导细胞凋亡。并且hid基因还可以通过激活caspase诱导凋亡发生。在S3基因干扰后hid和p53基因转录水平升高。
MCM3和MCM家族的其它成员在基因复制中有着重 要作用。在抑制细胞周期过程中p5 3基因负调控MCM 。而cdc4 5基因在调控细胞周期过程中与MCM5/cdc46相互作用。
Cyclin B表达水平降低可以引起G2阻滞,该过程受到p53基因依赖的转录抑制。
Incenp与Aurora B和survivin相互作用,形成染色体分离所必须的复合物:Aurora B/incenp/sur-vivin[18-20]。研究发现,survivin表达水平升高可减少p53基因表达,是因为通过caspases,Survivin调控了Mdm2的分裂,从而增加了p53基因的降解。过表达cyclin E通过激活caspase诱导造血细胞凋亡。在S3RNAi后MCM5、MCM3、cdc45、cyclin B和incenp mRNA表达减少,而cyclin E mRNA增加。
总之,S3RNAi后检测到的细胞凋亡基因和细胞周期基因的变化均与它们在凋亡中的作用是一致的。S3RNAi后通过细胞凋亡和细胞周期阻滞影响了果蝇发育,造成异常表型的出现。
参考文献:
[1]Wan F,Anderson D E,Barnitz R A,et al.Ribosomal proteinS3:a KH domain subunit in NF-kappaB complexes that me-diates selective gene regulation[J].Cell,2007,131(5):927-939.
[2]Jang C Y,Kim H D,Kim J.Ribosomal protein S3interactswith TRADD to induce apoptosis through caspase depend-ent JNK activation[J].Biochem Biophys Res Commun,2012,421(3):474-478.
[3]Saeboe-Larssen S,Lyamouri M,Merriam J,et al.Ribosomalprotein insufficiency and the minute syndrome in Drosophi-la:a dose-response relationship[J].Genetics,1998,148(3):1215-1224.
[4]Junger M A,Rintelen F,Stocker H,et al.The Drosophilaforkhead transcription factor FOXO mediates the reductionin cell number associated with reduced insulin signaling[J].J Biol,2003,2(3):20.





