
2014年 3月,世界卫生组织证实了几内亚暴发的埃博拉疫情,此次流行是有记录以来最严重的一次,也是该病首度登陆西非.研究人员认为一名于2013年 12月 6日死亡的 2岁大的婴儿是此次疫情的源头.该病不仅在几内亚境内不断蔓延,还波及临近的西非国家.由于其传染性强、病死率高、尚无正式上市的特效药物和疫苗,埃博拉疫情在西非乃至全世界引起了巨大的恐慌.2014年 8月 8日,世界卫生组织宣布此次疫情为国际突发公共卫生事件,并呼吁各国积极协助受影响的地区.
那么,西非埃博拉疫情到底有多严重,应如何有效控制疫情?本文将收集现有疫情通报和文献报道,对埃博拉出血热的历史、流行现状作一综述,并探讨有效的防控策略.
1 埃博拉出血热与埃博拉病毒
埃博拉出血热(Ebolahemorrhagicfever),又名埃博拉病毒病,是一种由埃博拉病毒引起的严重的、高病死率的流行性出血热.埃博拉出血热的症状通常在 8到 10天的潜伏期之后出现,病人最初一般表现为非特异性的流感样症状,包括发热、寒颤、乏力、肌肉痛、头痛等,发病第五天左右可出现严重的皮疹,广泛的病毒复制还可以出现全身性的血管性表现和神经系统表现,以及肝脏、脾脏、肾脏、生殖腺等的损伤.对于死亡病例,一般在感染后的第 6到 16天之间因多器官功能衰竭死亡.
埃博拉病毒属丝状病毒科,是非节段的单股负链 RNA病毒,病毒长度各不相同,一般直径约为 80nm,最长可达 14000nm.埃博拉病毒基因组一共编码了 3个非结构蛋白(sGP,ssGP和 Δ-peptide)和 7个结构蛋白(3′?NP?VP35?VP40?GP?VP30?VP24?L?5′).N蛋白(NP)、L蛋白、VP30、VP35与病毒RNA联系紧密,共同构成 RNP复合体.其中 NP为核衣壳蛋白,编码含 737个氨基酸的蛋白质;L蛋白具有聚合酶功能,对基因的复制和转录相当重要,而这整个过程又受到 VP30和 VP35的调控.VP24为小型膜蛋白,与病毒的成熟密切相关;VP40为基质蛋白,有助于病毒样颗粒在细胞中的表达和宿主细胞出芽.糖蛋白 GP1,2主要负责调节病毒对宿主细胞的粘附和侵入过程.
埃博拉病毒可分为 5个基因型,即本迪布焦型(BDBV)、扎伊尔型(EBOV)、苏丹型(SUDV)、莱斯顿型(RESTV)和塔伊森林型(TAFV),在生物安全等级上和天花病毒同为最危险的第 4级.前三种型别在非洲曾引起严重的出血热流行,病死率高,据WHO统计,部分型别的病毒感染病死率最高可达90%,但后两种型别感染暂未发现死亡报道.
2 埃博拉出血热疫情由来已久
1976年,在苏丹恩扎拉和刚果民主共和国扬布库同时出现了两起埃博拉病毒感染疫情,此乃人类首次发现埃博拉病毒.由于后者发生在位于埃博拉河附近的一座村庄,该病由此得名.
非洲大陆是埃博拉出血热的主要疫源地,除非洲曾发生暴发疫情的地区外,北美、欧洲、泰国、菲律宾也曾发现过感染者,但仅限于实验室感染,未形成人间传播.截至 2014年以前,世界卫生组织通报了不同规模大小的埃博拉疫情共 24次,均发生在非洲,以扎伊尔型和苏丹型常见(见表 1).累计报告病例 2387例,死 亡 1590例,总 体 病 死 率 为66?61%.汇总各次疫情的病死率,计算得病死率平均期 望 为 67?20% (95% 置 信 区 间 [56?95%,77?46%]).不同型别的埃博拉病毒感染,病死率也不同,扎伊尔型的病死率 78?39%(95%置信区间[69?68%,87?10%]),高于苏丹型的 62?82%(95%置信区间[45?33%,80?31%]).【表略】
有研究者发现不同型别的埃博拉病毒感染的病死率存在统计学差异,扎伊尔型病死率高于苏丹型(P=0?011,多变量分析),而虽然本迪布焦型病死率看起来更低,但因暴发疫情次数较少,未发现差异有统计学意义.
3 2014年西非埃博拉出血热疫情
自 2013年 12月,发生在几内亚东南部森林地区的一场埃博拉疫情正悄然席卷而来,直到 2014年3月 25日,随着 13例病例被检测出埃博拉病毒(扎伊尔型)阳性,才正式证实了本次起于几内亚的埃博拉疫情.此时,报告疑似病例已达 86例,其中死亡60例,疫情不断发展,迅速蔓延到塞拉利昂、利比里亚、尼日利亚等地.
3.1 总体情况
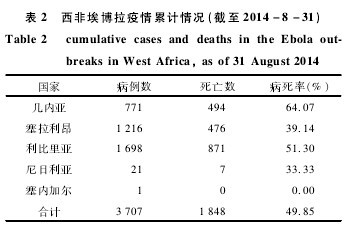
截至 2014年 8月 31日,本次发生在西非的埃博拉疫情总共报告病例 3707例(包括可能病例、确诊病 例 和 疑 似 病 例),死 亡 1848例,病 死 率49?85%.波及的国家和地区包括几内亚、塞拉利昂、利比里亚、尼日利亚和塞内加尔,所有数据均来源于WHO疫情通报(见表 2).其中塞内加尔截至目前只发现一例确诊病例,并且没有死亡病例或更多的疑似病例发现.【表2】
另外,刚果共和国自今年 8月初开始亦发生了埃博拉扎伊尔型病毒引起的埃博拉疫情,截至 9月4日,共发现病例 72例,其中 48例死亡.但根据病毒株的比对和流行病学调查,本次发生在刚果共和国的埃博拉疫情与西非埃博拉疫情没有联系,故不纳入西非埃博拉疫情的统计.(数据来源:ECDCIn?ternalDecision,3September2014.)
3.2 流行趋势
本次西非埃博拉疫情无论在规模还是地理分布上都是空前的,据欧洲疾病预防控制中心(EuropeanCentreforDiseasePreventionandControl)收集的每周病例报告数据分析显示,目前西非埃博拉疫情正处于快速增长阶段,且未见高峰(见图 1,来源于欧洲疾病预防控制中心统计报告).
其中,医护人员感染埃博拉病毒的情况同样让人担忧,据 WHO分布,截至 2014年 8月 31日共有257名医护人员受感染,其中死亡者 140名.【图略】
3.3 地区分布
疫情最早在几内亚发生,并持续暴发,而利比里亚于 2014年第 11到第 14周也发生了小规模暴发,但在第 15周开始疫情终止.直到 2014年第 23和第25周,塞拉利昂和利比里亚先后正式开始了本次埃博拉疫情,并迅速发展.受此影响,尼日利亚在 2014年第 31周之后也发生了埃博拉疫情,但规模不大.
详见图 2(来源于欧洲疾病预防控制中心统计报告).另外,2014年 8月 30日塞内加尔报告了唯一一例埃博拉出血热病例,经流行病学调查确认为输入性病例,此后该地区并未发现其他疑似病例.
4 预防与控制
目前针对埃博拉出血热尚无正式上市的特效治疗药物,尽管在美国和加拿大有几种候选的药物和疫苗已经在动物实验中取得了令人鼓舞的成效,但离临床试验和上市仍有较大距离.2014年 8月12日,WHO宣布允许尚未注册的药物和疫苗在病人知情、科学研究数据充足等情况下应用于西非埃博拉出血热的治疗中,9月 4日又再次指导推动埃博拉出血热临床试验药物和疫苗在西非疫情中的干预研究,但药物的效用到底如何,仍需要很多的工作,试验药物和疫苗目前的库存不足也是令人担忧的一个问题.
流行病学证据显示,埃博拉出血热的第一代患者都与非人类灵长类和其他哺乳动物接触有关,密切接触感染该病毒的死亡或存活的黑猩猩、大猩猩、森林羚羊、猕猴、豪猪和圈养猪均可被感染.感染者的血液、唾液、汗液、精液及分泌物具有感染性,埃博拉病毒可经过皮肤、呼吸道或结膜等途径感染密切接触者,人与人之间还可通过气溶胶造成吸入性传播.除了家庭成员之外,医护人员、试验操作人员也是主要的高危人群.医护人员与病人接触、实验室人员进行实验操作时必须严格执行个人防护措施,实验必须在生物安全 4级实验室内完成.
目前埃博拉疫情的肆虐,一方面是由于病毒的高传染性、高致病性以及目前治疗水平有限的影响,但另一方面也是由于西非当地的卫生资源短缺、健康卫生意识不足和防控措施不到位所致.针对传染病在人群中传播的三个基本环节,我们需在优化卫生资源配置的基础上,采取以下相应的措施来进行埃博拉疫情的防控.(1)控制传染源.埃博拉疫情发现后,对病人和感染者实施严格的隔离措施;封锁疫区,严格控制疫区人口流动;其他国家应对来自非洲的进口动物和往来人员采取严格的检疫措施;同时,研制出更快速的埃博拉出血热诊断方法和试剂,早期发现病人和隐性感染者,也是控制传染源的重点.(2)切断传播途径.要求医护人员采取严格的防护措施;严格消毒病人的分泌物和排泄物;疫区禁止举行传统葬礼等聚集性活动.(3)保护易感人群.
加强健康教育、引导人们正确认识埃博拉出血热、对相关人员进行培训都是必要的预防和控制措施.另外,源头控制是人兽共患病防控的关键,在最近几次人群发生埃博拉疫情之前,研究人员都检测到了感染埃博拉病毒的动物尸体残骸,包括大猩猩、黑猩猩和小羚羊的尸体,但对于真正的埃博拉病毒的自然宿主,部分研究者认为是果蝠,但目前仍未有充分证据证实.这提醒我们必须依靠公共卫生和兽医领域的专家共同合作,在“惟一健康(OneHealth)”的框架下,研究埃博拉病毒在动物界的真正起源,监测其在人类和非人灵长类动物及其他哺乳动物中的传播流行规律,做到及时预警、及时控制、彻底杜绝埃博拉出血热在人间的传播.





