
动脉粥样硬化( atherosclerosis,As) 是一个慢性炎症性疾病。业以证明,血小板活化后可释放大量的趋化因子,行使着除了止血以外的强大的炎症和免疫调节作用,促进 As 的发展。血小板因子 4( platelet factor 4,PF4) 是血小板活化后释放的最丰富的蛋白之一,不仅存在于 As 的早、晚期病变,且与病变分级、临床症状等临床参数相关,表明 PF4 在As 的发展中起重要作用。已有研究显示 PF4 可诱导炎症型巨噬细胞形成、单核细胞黏附于受损的内皮等炎症过程。鉴于 PF4 与 As 临床疾病严重程度的相关性,PF4 在 As 中的作用有待更深一步的研究。由血管炎症引发的异常血管重塑在 As 发生发展中起主导作用。基质金属蛋白酶 9( matrixmetalloproteinase-9,MMP-9) 作为炎性细胞因子在血管重构、斑块不稳定性及其破裂中起着重要作用。在重构的血管,MMP-9 被大量的表达、分泌和活化。巨噬细胞、肥大细胞等炎性细胞是血管组织 MMP-9 的重要来源。而炎性因子如肿瘤坏死因子 α 和白细胞介素等可诱导 MMP-9 表达。但PF4 对 MMP-9 表达的影响还未见文献报道。Toll 样受体4( toll-like receptor 4,TLR4) 是天然免疫中介导细胞跨膜信号传导的 Toll 样受体家族成员。研究显示在人 As 斑块中 TLR4 的表达显著提高; 活化的TLR4 可上调 MMP-9 表达、降解基质蛋白; 在大鼠模型中,TLR4 高表达可促进大鼠 As 斑块的形成和血管重构。因此,本研究观察 PF4 对巨噬细胞MMP-9 表达的影响及 TLR4 在其中的作用,旨在探讨 PF4 对 As 斑块稳定性的可能影响。
1、 材料与方法
1. 1 主要材料
重组人血小板因子 4( PF4) 购自 Peprotech 公司,脂多糖( LPS) 购自上海捷瑞公司,佛波脂( PMA)购自 Sigma 公司,胎牛血清购自杭州四季青生物研究所,RPMI1640 培养基购自美国 GIBCO 公司,TLR4 抗体型阻断剂购自 Biolegend 公司,Trizol Re-agent 和引物分别从上海生物工程技术有限公司购买和合成,cDNA 第一链合成试剂盒购自 Fermentas公司,Taq PCR MasterMix 以及 DNA Marker 购自北京天根公司,MMP-9 一抗购自北京博奥森生物公司,TLR4 一抗购自 eBioscience 公司。THP-1 单核细胞系购自上海细胞库。
1. 2 细胞培养
THP-1 单核细胞在含 10% 胎牛血清的 RP-MI1640 培养基中,静置于 37℃ 、5% CO2培养箱中培养。实验前,细胞用 160 nmol/L PMA 孵育 24 h,使其诱导成为巨噬细胞。换无血清的 RPMI1640 培养基培养 12 h,同步化后进行实验。巨噬细胞分别经PBS( 溶剂对照) 、不同浓度 PF4( 25 ~ 200 μg / L) 、脂多糖( LPS,100 μg/L) 处理 4 h 或 12 h,RT-PCR 和Western blot 检测 MMP-9 和 TLR4 表达; 为进一步研究 TLR4 在其中的作用,细胞经 TLR4 阻断剂( 25μg) 预处理 30 min 后,再与 PF4 孵育特定时间,检测MMP-9 表达。
1. 3 RT-PCR 反应
收集细胞,Trizol Reagent 试剂提取总 RNA。各样本取 0. 2 μg 总 RNA 按 cDNA 第一链合成试剂盒说明书进行逆转录。用 Taq PCR MasterMix 试剂进行 PCR 循环: 95℃ 温育 5 min,95℃ 变性 45 s,54℃退火 45 s,72℃延伸 1 min,共 32 个循环,72℃,继续延伸10 min。4℃冷却。反应结束后,取反应产物进行 1. 5%琼脂糖凝胶电泳,溴化乙锭染色,UVP 型凝胶图象分析系统摄图。TLR4、MMP-9 和 GAPDH 产物大小依次为 507 bp、476 bp 和 240 bp。以各组目的基因与 GAPDH 灰度值比值代表目的基因的 mR-NA 相对表达量。每组实验重复 3 次。
1. 4 Western blot 分析
收集细胞,提取细胞总蛋白。取 50 μg 蛋白质加入 5 × SDS 凝胶上样缓冲液,煮沸 100℃ 变性 5min。取变性蛋白质行 12% SDS-PAGE 电泳,并转移至 PVDF 膜上。5% 脱脂牛奶室温封闭,加入一抗TLR4 抗体、抗 MMP-9 抗体和抗 β-actin 抗体,4℃ 过夜。TBST 洗膜。加入辣根过氧化物酶标记的二抗,室温孵育 2 h。发光剂激发荧光,显影、定影后进行图像分析。以目的蛋白和内参蛋白的灰度值比值,作为各组间蛋白相对表达量。每组实验重复 3 次。
1. 5 统计学分析
所有数据均用x ± s 表示。用 SPSS 15. 0 统计分析软件进行统计处理,两组间比较用 Student’s t 检验,多重比较在 ANOVA 分析后用 Dunnett's-t 检验。P < 0. 05 为差异有显著性意义。
2、结 果
2. 1 PF4 上调 THP-1 源性巨噬细胞 MMP-9 表达
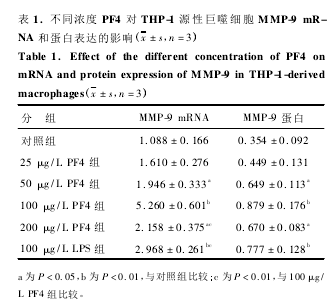
THP-1 源性巨噬细胞未经处理时,细胞有 MMP-9 mRNA 表达。细胞经不同浓度 PF4 ( 25 ~ 200 μg /L) 处理 4 h 后,RT-PCR 结果显示( 图 1) ,与对照组比,细胞 MMP-9 mRNA 水平随着 PF4 浓度的增加而逐步升高。其中,最大效应浓度为 100 μg/L( P <0. 001) ,且高于 LPS 组的 MMP-9 mRNA 水平( P <0. 01; 表 1) 。与 MMP-9 mRNA 水平一致的是,经不同浓度( 25 ~200 μg/L) PF4 处理 12 h 后,THP-1 源性巨噬细胞 MMP-9 的蛋白水平也较对照组显著上调,当 PF4 浓度为 100 μg/L 时,MMP-9 蛋白水平增高最为明显( P <0. 01,图 1 和表 1) 。
2. 2 PF4 上调 THP-1 源性巨噬细胞 TLR4 表达
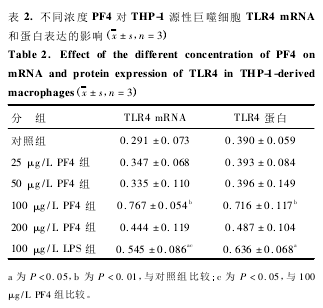
对照组细胞有 TLR4 mRNA 表达。经不同浓度的 PF4 孵育后,与对照组比较,25 μg/L 和 50 μg/L的 PF4 对巨噬细胞 TLR4 的 mRNA 表达水平无明显调节作用,然而 100 μg/L PF4 显著上调 TLR4 的mRNA 表达水平( P < 0. 001) ,与 LPS 阳性对照组比较,TLR4 的 mRNA 表达水平显著上调( P < 0. 05,图 2 和表 2) 。PF4 浓度达 200 μg/L 时,TLR4 mR-NA 表达水平略有降低,但仍高于对照组。Westernblot 结果显示,与对照组比较,100 μg / L PF4 显著上调 TLR4 的蛋白表达水平( P < 0. 05; 图 2 和表 2) ,与基因水平的检测结果基本一致。
2. 3 TLR4 阻断剂逆转 PF4 上调巨噬细胞 MMP-9表达
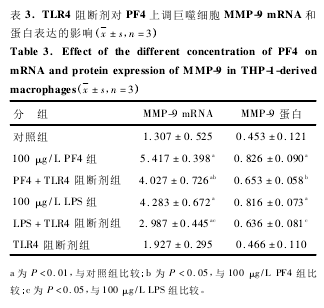
为了探索 PF4 上调巨噬细胞 MMP-9 表达是否通过 TLR4 信号环节,实验采用 TLR4 阻断剂预处理细胞后,观察 PF4 对巨噬细胞 MMP-9 表达的影响,RT-PCR 和 Western blot ( 图 3 ) 结果均显示,加入TLR4 阻断剂后,其 MMP-9 mRNA 和蛋白表达水平均较 PF4 单独孵育组显著降低( P < 0. 05) 。同时,LPS 和 TLR4 阻断剂共处理组的 MMP-9 mRNA 和蛋白表达水平也较 LPS 单独孵育组低( P < 0. 05) ,表明 TLR4 是调节巨噬细胞 MMP-9 表达的重要环节( 表 3) 。
3、 讨 论
血小板作为多功能细胞,不仅在止血过程中起作用,而且在炎症、免疫和 As 等多种病理过程中起重要作用。新近的观点认为,活化的血小板通过释放多种活性因子影响 As 的发展。在众多的活性因子当中,PF4 的含量最丰富,被认为是巨噬细胞成熟和血小板活化的标记物。值得注意的是,在 As性疾病患者血液中 PF4 水平较正常对照者显著增高。但 PF4 在 As 的发生发展中起何种作用尚未阐明。
人 PF4 基因位于 4 号染色体长臂,全长 1000bp,含有 3 个外显子,是小诱导基因( the small induc-ible gene,SIG) 家族中的一员。SIG 家族成员的基因组的外显子结构极其相似,且其蛋白质的氨基酸序列有同源性,都含有 4 个保守的半胱氨酸残基。
SIG 在凝血、感染、细胞生长方面扮演重要角色。大量研究表明,PF4 在血栓和动脉粥样硬化斑块形成中起重要作用。离体实验发现,PF4 可诱导单核细胞存活、表达细胞因子、形成氧自由基和黏附于受损的内皮; 诱导炎性巨噬细胞( 无 CD163 表达) 形成; 抑制低密度脂蛋白受体( low density lipopro-tein receptor,LDLR) 降解、促进 LDL 氧化; 诱导氧化型低密度脂蛋白( ox-LDL) 与血管细胞和巨噬细胞结合等。动物实验证实,敲除血小板 PF4 基因,可减少 ApoE- / -小鼠 As 病变面积。本实验发现 PF4 可诱导巨噬细胞表达 MMP-9,且 TLR4 参与此过程。结果显示,PF4 可以促进 THP-1 源性巨噬细胞 MMP-9 的表达。THP-1 源性巨噬细胞经不同浓度 PF4( 25 ~200 μg/L) 处理后,MMP-9 的 mR-NA 和蛋白水平均随着 PF4 浓度的增加而逐步升高,尤其以浓度为 100 μg/L 时升高最为显著。
基质金属蛋白酶类( matrix metalloproteinases,MMP) 不仅是一种能分解细胞外基质的糖蛋白酶类,也是连接炎症和血管重构的炎症介质。研究证实动脉粥样硬化斑块纤维帽的厚度直接影响斑块的稳定性,纤维帽越薄则斑块越易破裂。纤维帽主要由胶原纤维与平滑肌细胞构成。MMP-9 是降解胶原的主要酶类之一,严重影响斑块的稳定性。
实验研究表明,肿瘤坏死因子 α 等多种炎性因子可诱导巨噬细胞、中性粒细胞等表达和分泌大量的MMP-9。而局部 MMP-9 含量增多不仅降解细胞外基质、促使平滑肌细胞从中膜迁移入内膜并增殖,还诱导炎症细胞迁移、募集和黏附至血管壁,使血管壁细胞增殖或凋亡; 在 MMP-9 基因缺失的小鼠,As 斑块内胶原含量增加,而巨噬细胞含量减少、斑块面积缩小。临床研究发现,急性脑梗死的患者外周血 MMP-9 的水平明显升高,提示 MMP-9可能参与脑梗死的病理过程。新近研究发现,血清MMP-9 水平与人颈动脉总斑块分数、斑块不稳定性独立相关。本实验发现 PF4 促进巨噬细胞 MMP-9 表达上调,提示 PF4 可能通过促进 MMP-9 的表达,加剧血管炎症反应及斑块的不稳定性。
TLR 是固有免疫细胞膜上识别系统的重要组成部分。TLR4 是 TLR 家族成员,在内皮细胞、巨噬细胞、中性粒细胞、树突状细胞及心肌细胞表达。
TLR4 可通过识别 LPS、热休克蛋白 60 等,参与免疫调节和炎症反应。我们的实验结果显示,PF4( 100 μg/L) 显著上调 TLR4 的 mRNA 和蛋白表达水平。文献报道 LPS 可激活 TLR4。本实验以 LPS为阳性对照,结果显示,与 100 μg/L LPS 比较,100μg/ L PF4 能上调巨噬细胞 MMP-9 和 TLR4 表达。
TLR4 阻断剂是一种抗体型阻断剂,本研究发现,TLR4 阻断剂可逆转 PF4 上调巨噬细胞 MMP-9 的表达,表明 TLR4 是 PF4 上调巨噬细胞 MMP-9 表达的重要信号环节。然而,50 μg/L PF4 处理组不能显著改变 TLR4 mRNA 和蛋白表达水平,提示 PF4 上调 MMP-9 表达除了依赖 TLR4,可能还受其它的信号环节调节。文献报道,TLR4 介导的信号转导有MyD88 依赖性和非依赖性途径。但调节 MMP-9表达的 PF4-TLR4 通路的下游是何种信号分子尚需进一步研究证实。
总之,本研究结果表明 PF4 经 TLR4 上调巨噬细胞 MMP-9 表达。PF4 可能通过上调 MMP-9 表达,促进 As 的发生发展。





