
病理性疼痛的一个重要分类是炎症性痛.炎性痛是是由各种生物(细菌、真菌、病毒等)、物理、化学或免疫源性炎症在细胞水平对组织完整性所造成的损伤.它的发生发展与组织损伤和炎症的[1]产生密切相关 .福尔马林模型是一个公认的诱导炎性痛的理想模型,福尔马林经过一定倍数的稀释后,注射于小鼠或大鼠后足掌部皮下,可提供一个持续的伤害性刺激,从而激发一种明显的、弥散[2]的、长时间持续的自发性疼痛行为反应 .研究显示,在小鼠福尔马林疼痛模型中,脊髓谷氨酸(glutamate,[3]Glu)水平显着增高 .Glu作为一种兴奋性神经递质,是诱发疼痛形成和持续的重要因素.
星形胶质细胞(Astrocytes,AS)作为中枢神经系统中,数量最多、体积最大的一类胶质细胞,在维持神经元内外环境、生存、迁移、免疫调节、信号转导、等方面具有重要作用.特别是,AS通过谷[4]氨酸-谷氨酰胺循环来调控谷氨酸的传递 .AS通过其膜上特异性谷氨酸转运体1(glutamate transporter1, GLT1)和谷氨酸天冬氨酸转运体(glutamateaspartatetransporter,GLAST)将突触间隙中的Glu摄入,并由谷氨酰胺合成酶(glutamine synthetase, GS)转化为谷氨酰胺输送回神经元,从而有效维持持续的谷氨酸能突触传递和保护突触后神经元免受兴奋性毒性损害.研究证实,在福尔马林致炎性痛模型中存在[5]脊髓AS的激活,提示AS参与了炎性痛的过程 .然而,在此模型中,活化的AS是否增强对Glu再摄取和转化,进而参与痛觉的调控尚未见报道.
综合以上研究背景,本实验选择福尔马林制备炎性痛模型,通过观察脊髓后角胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP), GLT1, GLAST和GS表达的变化,以探讨脊髓后角AS参与痛觉调节的作用机制.
1 材料和方法
1.1 动物分组及模型制作
健康的雄性ICR小鼠20只(南京医科大学动物中心提供),体重26-28g.动物随机分为2组.①模[6]型组:在安静、自然光环境下,按文献 方法复制炎性痛模型,用微量注射器在小鼠右后足背皮下注射2.5%的福尔马林40μl.②对照组:动物行40μl生理盐水后肢足背注射.60min后,小鼠行断头术处死,快速取脊髓L4-L5节段,于冰盘中快速分离脊髓背侧,-20℃保存待用.兔抗GFAP抗体、兔抗GS抗体、兔抗GLT-1抗体和兔抗GLAST抗体均购于武汉博士德公司,Glu定量检测试剂盒由南京建成生物研究所提供.
1.2 Glu检测试剂盒检测生化指标
利用南京建成生物研究所提供Glu检测试剂盒,测定L4-L5节段脊髓后角中Glu的含量,操作步骤严格按照试剂盒说明进行.
1.3 Western blot检测
取两组小鼠组织,进行蛋白提取和浓度测定.10% SDS-PAGE凝胶电泳分离蛋白结束后,转移槽转移蛋白质到PVDF膜.转移后的PVDF膜用含5%脱脂奶粉的TBST缓冲液室温包被2h后,浸入含5%脱脂奶粉的TBST稀释的一抗(GFAP,1 1000;GS,1:500,GLT-1,1:1000,GLAST,1:1000)中 ,4℃过夜,TBST漂洗后转入用5%脱脂奶粉的TBST稀释的HRP偶联的二抗(1:1000)中,室温2h,TBST充分漂洗后,ECL发光系统检测目的蛋白及GAPDH的蛋白表达水平.本部分实验重复3次.吸光度值测定应用Leica全自动图像分析仪测定,以目的蛋白的光密度值(OD)与内参OD的比值作为目的蛋白相对光密度值.
1.4 统计学分析
数据用均数±标准误(X±S.E.M.)表示.采用t检验进行组间数据比较.P < 0.05被认为存在显着性差异.
2 结果
2.1 脊髓后角Glu含量的测定
与对照组相比,模型组脊髓后角Glu含量显着升高(图1)
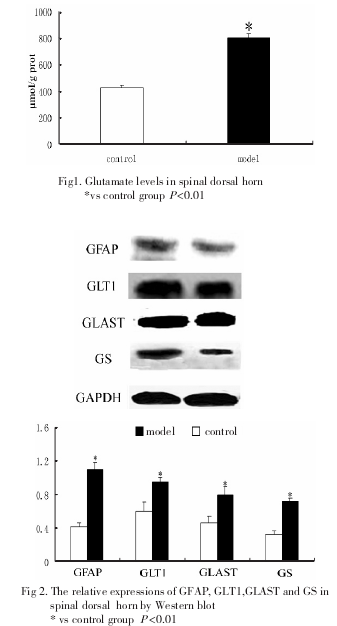
2.2 GFAP、GLT1、GLAST和GS在脊髓的表达
Western-blot检测结果显示,与对照组相比,模型组脊髓后角内GFAP, GLT1,GS和GLAST蛋白水平升高,差异有显着性(图2).
3 讨论
为了研究炎性痛的机制,通常通过小鼠或大鼠后足注射炎性物质制作炎性痛觉过敏模型来模拟患者临床疼痛症状.目前,福尔马林致痛模型是一个较好的用于研究急性组织损伤所致持续性炎性痛的[2]动物模型 .Glu是中枢神经系统主要的兴奋性氨基酸神经递质,因伤害性刺激、组织损伤或神经损伤而释放.福尔马林引起的组织损伤和炎症使脊髓Glu释放增加,神经元兴奋性增高,兴奋阈值降低,[7]引起中枢敏化和疼痛过敏 .本实验中,脊髓后角Glu含量的增高也证实了这一观点.
目前,越来越多的研究表明AS在中枢敏化方面具有关键性作用,特别是AS通过谷氨酸-谷氨酰胺循环对Glu起重要调节作用 .AS通过Glu转运体摄取了突触间隙中80%的Glu,并通过GS催化,转变成谷氨酰胺,再转运到神经末梢,重新生成Glu.本研究中,我们检测到脊髓后角AS蛋白表达上升,这一结[9]果较之既往仅观察AS形态的改变 ,从蛋白水平进一步证实了在此模型中,存在脊髓AS的激活.GLAST和GLT1选择性分布在AS细胞膜上,GS在[4]脊髓也主要存在于AS内 .研究表明,药物封闭AS上Glu转运体会导致疼痛过敏并增强脊髓后角神经元对[10]于外周机械以及热刺激的反应性 .而下调Glu转运[11]体的表达也与痛觉增敏相关 .本实验结果显示,脊髓后角内Glu转运体GLT1、GLAST均有不同程度升高.这可能是在高浓度Glu的刺激下,AS通过上调GLT-1和GLAST来增强Glu摄取能力,以便维持细胞外低水平的Glu浓度和阻止Glu兴奋性毒性.
Glu在突触间隙浓度的维持还依赖于GS的作用.Glu被细胞摄取后,必须经过GS转化为谷氨酰胺才失去其毒性作用.研究显示,应用GS抑制剂后,阻断了谷氨酸-谷氨酰胺循环通路,降低了Glu摄取率,[12]从而产生细胞毒性 .本实验中,模型组增高的GS,不仅清除了AS摄取的Glu,而且为神经元提供了更多的合成Glu的原料谷氨酰胺,从而维持了突触末梢Glu的持续释放.
总之,本实验首次阐明在福尔马林致炎性痛模型中,脊髓AS通过谷氨酸-谷氨酰胺循环参与疼痛传递的调节.根据此结果推测,在持续性炎性痛中,应用针对谷氨酸转运体、或者GS的药物不失为一种新的治疗方法.
【参考文献】
[1] Yaster M, Guan X, Petralia RS, et al. Effect of inhibition of spinalcord glutamate transporters on inflammatory pain induced byformalin and complete Freund's adjuvant [J]. Anesthesiology, 2011,114: 412-423.
[2] Hough LB, Rice FL. H3 receptors and pain modulation: peripheral,spinal, and brain interactions [J]. J Pharmacol Exp Ther, 2010, 336:30-37.
[3] Skyba DA, Lisi TL, Sluka KA. Excitatory amino acid concentrationsincrease in the spinal cord dorsal horn after repeated intramuscularinjection of acidic saline [J]. Pain, 2005, 119: 142-149.
[4] Jiang E, Yan X, Weng HR. Glial glutamate transporter and glutaminesynthetase regulate GABAergic synaptic strength in the spinal dorsalhorn [J]. J Neurochem, 2012, 121: 526-536.
[5] Qin M, Wang JJ, Cao R, et al. The lumbar spinal cord glial cellsactively modulate subcutaneous formalin induced hyperalgesia in therat [J]. Neurosci Res, 2006, 55: 442-450.
[6] Ohsawa M, Mutoh J, Asato M, et al. Carnosine has antinociceptiveproperties in the inflammation-induced nociceptive response in mice[J]. Eur J Pharmacol, 2012, 682: 56-61.
[7] Vidal-Torres A, Carceller A, Zamanillo D, et al. Evaluation offormalin-induced pain behavior and glutamate release in the spinaldorsal horn using in vivo microdialysis in conscious rats [J]. JPharmacol Sci, 2012, 120: 129-132.
[8] Shen J. Modeling the glutamate-glutamine neurotransmitter cycle [J].Front Neuroenergetics, 2013, 5: 1-13.
[9] Wang J, Geng B, Shen HL, et al. Amino acid transport system A isinvolved in inflammatory nociception in rats [J]. Brain Res, 2012,1449: 38-45.
[10] Weng HR, Chen JH, Cata JP. Inhibition of glutamate uptake in thespinal cord induces hyperalgesia and increased responses of spinaldorsal horn neurons to peripheral afferent stimulation [J].Neuroscience, 2006, 138: 1351-1360.
[11] Nie H, Weng HR. Impaired glial glutamate uptake inducesextrasynaptic glutamate spillover in the spinal sensory synapses ofneuropathic rats [J]. J Neurophysiol, 2010, 103: 2570-2580.
[12] Tsuboi Y, Iwata K, Dostrovsky JO, et al. Modulation of astroglialglutamine synthetase activity affects nociceptive behaviour andcentral sensitization of medullary dorsal horn nociceptive neuronsin a rat model of chronic pulpitis [J]. Eur J Neurosci, 2011, 34:292-302.





