
肺挫伤是创伤病人中常出现的一种闭合性损伤,创伤导致的肺组织出血、水肿是急性呼吸窘迫综合征的主要危险因素,老年患者由于身体各项功能都出现衰退趋势,加上基础疾病较多,因此病情更加复杂、凶险,显著加大了救治难度〔1〕,早期采取有效措施减轻肺水肿对于改善患者预后具有重要意义〔2,3〕,研究肺挫伤水肿的机制,对于肺挫伤患者的临床治疗具有重要的指导意义。本研究检测水通道蛋白( AQP) 1 和 4 在挫伤肺组织中的表达变化,探讨肺水肿的形成机制。
1 材料和方法
1. 1 肺挫伤模型制作及分组
健康老年雄性 SD 大鼠 100 只,体重 450 ~500 g,由昆明医科大学实验动物中心提供。肺挫伤模型采用金属球自由落体打击法制作,老年大鼠麻醉后放置于水平实验台上,180 g 重物自 1 m 高处自由落体,垂直撞击于大鼠右侧胸廓,于设定时间点麻醉后断头处死,分为四组: 假手术组,模型 1、3 和 6 h 组,每组 25 只,其中 10 只做水含量测定,10只做分子生物学检测,5 只做组织病理检测。
1. 2 肺组织含水量的测定
大鼠麻醉后取肺组织,称量右肺中叶肺组织湿重,后置于 100℃ 恒温鼓风干燥箱中干燥 2 d 后称重,计为干重。根据下列公式计算肺组织水含量: ( 湿重-干重) /湿重×100%。
1. 3 肺组织 HE 染色
取大鼠右肺上叶组织,4% 多聚甲醛固定后,切片,常规脱水、脱蜡,行 HE 染色。
1. 4 RT-PCR
根据标准的 RNA 提取步骤提取总 RNA,使用反转录试剂盒( Promega) 进行反转录,具体操作根据说明书进行。利用琼脂糖凝胶电泳检测各组 AQP1 和4 的表达,以 β-ac-tin 作为内参照,Image J 软件定量分析各电泳条带的灰度值,RT-PCR 产物以各样本目的基因与 β-actin 的灰度值进行比较,AQP1 上游引物序列: 5'-AAAGTGGCAAGGAAGGGACA-3'; 下游引物序列: 5'-GCTGTGGATGTTGGGAAAGAG-3'。AQP4 的上游引物序列: 5'-TTGGACCAATCATAGGCGC3'; 下游引物序列:5'-GGTCAATGTCGATCACATGC-3'; β-actin 上游引物序列: 5'-GAGAGGGAAATCGTGCGTGAC-3'; 下游引物序列: 5'-CATCT-GCTGGAAGGTGGACA-3'。
1. 5 Western 印迹分析
老年大鼠 100 mg 肺组织加入裂解液匀浆,冰上碾磨匀浆后,12 000 r/min 离心 10 min 取上清,BCA法蛋白定量,取蛋白样品 50 μg,电泳后转膜,5%的脱脂奶粉封闭 1 h,β-actin、AQP4 和1 抗体( 均购自美国 Santa cruz 公司) 稀释液孵育( 1 ∶200) ,4℃过夜,TBST 洗膜,5% 的牛奶稀释的辣根过氧化物酶标记的兔抗羊二抗,洗膜后,按照 ECL 说明书,1 ∶1配置发光工作液,凝胶成像仪成像。
1. 6 统计学分析
采用 SPSS17. 0 软件进行单因素方差分析及 LSD-t 检验。
2 结 果
2. 1 肺组织湿 /干重比和病理改变
模型 1、3、6 h 组湿 /干比重( 0. 932 4±0. 079 6、1. 537 8±0. 071 3、2. 378 0±0. 071 3) 显著高于假手术组( 0. 799 1±0. 069 3) ( P<0. 05) 。模型 3、6 h 组与模型 1 h 组有显著差异( P<0. 05) 、挫伤后 1 h 组织肺泡腔内未出现明显水肿液,3 h 后,光镜下见挫伤肺组织间质出现明显肿胀,肺泡壁毛细血管出现明显扩张、红细胞外漏、水肿明显,肺泡腔内出现少量水肿液; 挫伤后 6 h,黏稠液体充满肺泡腔,肺泡间隔出现明显水肿,有大量炎性细胞浸润,假手术组未出现明显异常。
2. 2 各组肺组织 AQP1 和 4 的 mRNA 和蛋白表达量
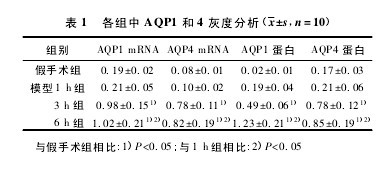
与假手术组相比,模型 3、6 h 组肺组织内 AQP1 和 4 mRNA 和蛋白表达明显升高( P<0. 05) 。与模型 1 h 组比较,模型 6 h 组有显著差异( P<0. 05) 。见图 1 和图 2,表 1。【图略.表1】
3 讨 论
研究表明弥漫性肺泡损害、低氧血症、挫伤区肺组织的血水肿、通气与换气功能障碍时肺挫伤的主要病理生理机制〔4〕,其中肺水肿是导致肺通气功能障碍的主要原因,引起肺组织水肿的原因主要有两方面: 一方面,创伤直接破坏血管内皮和肺泡上皮的屏障完整性,使通透性增加〔5〕; 另一方面,肺挫伤后继发性产生的炎性介质,活性氧残基导致肺泡水的清除能力明显降低〔4〕。水代谢异常显著降低了肺组织的顺应性和氧合功能,是影响患者预后的重要因素。
研究证实 AQP 在肺挫伤后组织水肿形成中发挥重要作用,其中,AQP1 在肺挫伤后组织中的表达量明显升高〔6〕,Verk-man 等〔7〕在敲除 AQP1 基因的研究发现,AQP1 参与渗透压驱动的肺内水运动,能够促进肺水肿的形成; 袁军等〔6〕在大鼠肺挫伤模型中研究发现 AQP1 的表达在肺挫伤后明显升高,可能是肺水肿的重要参与者。AQP4 蛋白最初在 1994 年从大鼠的肺组织中克隆出来的一种选择性水转运体,属于汞不敏感性AQP 家族〔8〕,采用电镜和免疫细胞化学技术检测发现 AQP4 定位于肺组织的气管、支气管上皮及成纤维细胞的膜基质侧顶部,此外 AQP4 也存在于气管、支气管的柱状上皮的基质侧,AQP4 在肺泡水的转运及气道表面液体的调整中发挥重要作用。Verkman 等〔7〕证实发现 AQP1 缺失可导致肺泡毛细血管间的水通透性下降 10 倍,AQP1 和 4 均敲除小鼠水通透性降低 14 ~16 倍。研究采用血管外肺水( EVLW) 技术发现,AQP4的主要作用是保持肺泡相对干燥,在正常状态下表达较少,血管外肺水量的增加可以显著诱导 AQP4 蛋白表达,以纠正“渗出-吸收”的失衡〔7,9〕。朱丽华等〔10〕在大鼠油酸性急性肺损伤模型中发现,AQP4 在油酸导致损伤的肺组织中表达明显升高,这与本实验的研究结果具有一致性,同时还证明早期使用肾上腺能 β2 受体激动剂特布他林可以上调肺泡Ⅱ型细胞 AQP4 表达,明显减少肺泡腔渗出,减轻肺损伤,显著减少细胞外肺水的含量,提示 AQP4 在肺泡水肿中可以加强水转运发挥重要的抗水肿作用; 推测肺挫伤后 AQP4 表达升高,是一种肺挫伤后的代偿性升高,可能利于减轻肺泡腔水肿。以往研究证实 AQP1在肺挫伤后表达也明显升高,本研究结果与前期研究具有一致性〔11,12〕,AQP1 蛋白的表达增加则可以加重肺水肿,因此调节二者比值的平衡可能对于肺水肿早期的治疗具有重要意义,未来还需要进一步使用敲除 AQP4 或 1 基因及两者同时敲除的基因验证二者在肺挫伤中肺水肿的作用。
参考文献
1 李景华 . 老年人严重肺挫伤的治疗体会〔J〕. 现代诊断与治疗,2012; 23( 5) : 508-9.
2 罗玉龙,李超峰,苏鹏霄 . 严重肺挫伤 150 例诊治体会〔J〕. 吉林医学,2009; 30( 19) : 2244-6.





